大鼠尾椎髓核干细胞的分离与分化能力
2018-12-07徐宏光金中行
沈 阳,徐宏光,张 屿,王 效,肖 良,刘 晨,金中行
(皖南医学院第一附属医院 弋矶山医院 脊柱外科,安徽 芜湖 241001)
下腰痛与椎间盘退变密切相关,在人群中普遍存在。研究表明,超过半数以上的腰部疼痛是由椎间盘退变导致的[1-2]。目前,对于椎间盘退变的治疗仍然以内科治疗为主,其远期疗效并不理想,而对于外科治疗,虽然能快速解决椎间盘退变带来的症状,但是并不能延缓椎间盘退变的病变进程。除此之外,椎间盘由位于中央区域的髓核、外围的纤维环以及上下侧的软骨终板共同组成,作为人体内最大的无脉管结构,细胞主要通过扩散作用汲取邻近椎体血管内的氧气及营养物质,因此来自血液及骨髓的外源性干细胞难以到达椎间盘组织[3]。故椎间盘在长期的上身负荷下易发生退变。也正是椎间盘持续的退变,导致椎间盘内组织水分降低,细胞外基质增加,细胞数目大幅度降低,组织钙化等病理改变[4-5]。
随着干细胞与再生医学的兴起,人们对干细胞的生物特性的了解不断深入,给椎间盘退变的治疗带来了新的希望。如何有效获取干细胞,成为椎间盘退变生物治疗的关键。本文根据前期的研究,改进了髓核组织的消化方法,通过低密度接种培养,获取细胞集落,后通过多向分化及单克隆形成能力检测,验证该细胞集落具有干细胞特性。
1 材料与方法
1.1 实验动物 4周龄SD大鼠10只,雌雄不限,体质量100~200 g,由江苏省南京市青龙山动物研究中心提供。
1.2 实验试剂 0.25%EDTA-胰酶(Gibco),0.2%Ⅰ型胶原酶(Sigma),青霉素-链霉素溶液(15070063,Gibco),磷酸盐缓冲液(PBS)(SH30256.01,hyclone),DMEM/F12培养基(Gibco),干细胞胎牛血清(Gibco),干细胞成骨分化诱导培养基(A1007201,Gibco),干细胞成脂肪分化诱导培养基(A1007001,Gibco),干细胞成软骨分化诱导培养基(A1007101,Gibco),茜素红染色液(南京森贝伽生物科技有限公司),油红O染色剂(O0625,Sigma),番红染色液(南京森贝伽生物科技有限公司),结晶紫染色剂(C8407,索莱宝),10 cm培养皿。
1.3 实验方法
1.3.1 获取大鼠尾椎髓核原代细胞(nucleus pulposus cells,NPCs) 取4周龄SD大鼠幼鼠10只,给予颈椎脱臼法处死后,全部浸没于75%的酒精10 min,无菌条件下分离大鼠尾椎C1~C5节段,解剖显微镜下分离椎间盘中央部分的髓核组织,将髓核都浸泡在含有双抗的PBS中10 min,取出后PBS冲洗3次,加入0.25%EDTA-胰酶,置于37℃温水浴箱中40 min后离心并弃上清,最后分别加入0.2%Ⅰ型胶原酶和重新置于水浴箱中消化1 h左右,每30 min震荡1次以加速消化。待组织完全消化后用200目滤网过滤,1500 r/min离心5 min,弃上清,重新加入含有10%的FBS培养基吹打混匀,备用。整个获取过程在2 h内完成,以便于更好地保持髓核细胞的活性。
1.3.2 获取大鼠尾椎髓核干细胞(nucleus pulposus stem cells,NPSCs) 将得到的NPCs吹打混匀,chamber计数板计数,按照50、100、200个/cm2的密度接种于10 cm培养皿,每皿加入6~8 mL的含有20%FBS的DMEM/F12培养基,置于37℃,5%CO2的培养箱,每3 d换液1次,培养10 d。显微镜下观察细胞集落的形态。用4%的多聚甲醛固定30 min,PBS冲洗3次后,再使用0.1%的结晶紫染色10 min,观察集落形态,统计集落形成率,倒置相差显微镜下细胞数少于20个的集落忽略不计。
1.4 多向分化能力检测 将上述得到的细胞集落经0.25%的胰蛋白酶消化后进行体外扩增培养,取第2代细胞,按照每孔2×104的密度接种于24孔板,加入1 mL含有10%FBS的DMED/F12培养基,待细胞融合达80%,按如下步骤进行诱导分化。
加入成骨分化诱导培养基,每3 d换液1次,诱导21 d后,4%多聚甲醛固定细胞15 min,加入适量茜素红染液染色30 min后,PBS轻轻冲洗2遍,倒置相差显微镜下观察。
加入成脂肪分化诱导培养基,每3 d换液1次,每次换液时不要把原培养基全部吸出,诱导21 d后,如上方法进行细胞固定,油红O染液染色30 min,然后苏木素复染30 min,PBS冲洗后置于显微镜下观察。
按照micromass法[6]进行成软骨方向分化诱导,加入成软骨分化诱导培养基,每3 d换液1次,诱导21 d,固定细胞,番红染色30 min,冲洗后置于显微镜下观察。
1.5 单克隆形成能力检测 单克隆形成能力反映出细胞的强大增殖能力,据国外文献报道,在接种密度<50个/cm2时[7],只有具有干细胞性质的细胞,才能得以生存下来。我们将获得的细胞集落使用0.25%的胰蛋白酶消化后,收集细胞悬液,按照50个/cm2的密度接种于10 cm培养皿上,加入8 mL含20%FBS的DMEM/F12培养基,置于37℃,5%CO2的培养箱,每3 d换液一次,培养15 d后,结晶紫染色,观察是否有细胞集落形成。
2 结果
2.1 NPCs与NPSCs形态学比较 NPCs接种后,大约48 h贴壁,形态多不规则,呈三角形或不规则四边形,倒置相差显微镜下可见细胞内部含有较多“空泡”(图1A)。髓核细胞按照不同密度接种培养后,3 d后可见细胞贴壁(图1B),5 d见贴壁细胞增殖形成细胞集落(图1C)。随着培养时间的延长,10 d时,可见较大形态的细胞集落形成。高倍镜下观察,细胞多呈梭形,内部无“空泡”结构(图1D)。
2.2 多向分化能力 含钙基质可以被茜素红染液染成红色或者鲜红色。在诱导成骨分化4 d,使用多聚甲醛固定细胞后,经茜素红染色,显微镜下可见视野大片被染成深红色含钙骨基质。油红O为脂溶性染料,在脂肪内能高度溶解,可特异性的使组织内甘油三酯等中性脂肪着色。在成脂肪分化诱导15 d左右,轻轻吸取上清液,多聚甲醛固定,实验组加入适量油红O染色剂,显微镜下可见细胞内有较多透亮的红色脂肪滴。
番红染色原理在于嗜碱性的软骨与碱性染料番红结合呈现红色。在成软骨诱导18 d左右,经番红染色,可见实验组有软骨片被染成深红色。见图2。

A.NPCs呈不规则三角形,内部含有较多“空泡”结构;B~D.髓核细胞按照不同密度接种培养。不同时间内细胞集落的形态变化。B.接种3 d后,可见已经贴壁的细胞增殖形成较小的细胞集落;C.接种培养5 d,细胞集落逐渐变大;D.接种培养10 d,可见均一的呈圆形的细胞集落。
图1 NPCs与NPSCs形态比较

A.成骨方向分化,含钙基质被茜素红染成鲜红色;B.成脂肪方向分化,细胞内脂肪滴被油红O染成亮红色;C.成软骨方向分化,可见大片的软骨基质被染成深红色。
图2 NPSCs三系分化
2.3 单克隆形成能力检测 在进行单克隆能力检测时,高倍显微镜下可见集落中的细胞形态大部分呈规则的梭形,细胞内部无“空泡”。结晶紫染色,肉眼可见被染成紫色的细胞集落。见图3。
3 讨论
近几年随着组织工程学的兴起,干细胞及相关临床转化[8-9]引起人们的高度重视,椎间盘缺乏血供,无神经支配,生理状态下处于长期封闭的腔隙内,因此,椎间盘组织可以逃避细胞免疫及体液免疫,成为“免疫豁免”[10-11]的组织之一。目前向发生退变的椎间盘移植干细胞有两种途径:移植技术及载体。正是椎间盘这种“免疫豁免”的特性,我们可以向椎间盘内直接注射干细胞,在动物模型[12]和人体模型[13]中,这种方法已经被证实对于治疗椎间盘退变有明显作用。但是干细胞直接注射治疗也存在很多缺点,由于干细胞具有多向分化的特性,在注射时若发生泄露,在脊柱峡部会发生骨化而造成椎管狭窄[14]。细胞载体很好地解决了这个问题,载体一方面可以防止细胞泄露,另一方面可以提供干细胞生长的微环境。包括凝胶载体和生物载体,前者包括胶原蛋白凝胶、透明质酸凝胶等,后者包括微球支架[15]和其他生物增强支架[16]等。
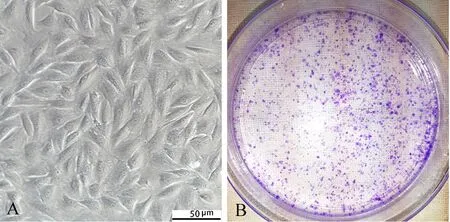
A.高倍镜下集落中的细胞形态;B.单克隆形成能力检测,按照不同密度接种培养得到的细胞集落再次进行单克隆后,依然具有低密度形成细胞集落的能力。
图3 NPSCs单克隆形成能力检测
本实验将NPCs低密度接种于培养皿中培养,将获得的细胞集落进行了多向分化诱导和单克隆形成能力检测,可以初步判断通过该法获得的细胞具有干细胞特性,也符合干细胞鉴定标准。当然,本文也存在不足,未进行免疫学鉴定,但是目前关于成体干细胞的研究还属于初步阶段,很多成体干细胞表面的标记物还是未知的,需要我们进一步去完善。NPSCs的分离与鉴定,经过进一步的研究与完善,将有望解决种子细胞来源问题,为今后的组织工程奠定良好基础。
