离子反应类试题常考题型及其解答策略
2018-12-06栾厚福
栾厚福
黑龙江
离子反应是重要的化学用语,在基本概念和基础理论知识中占有极其重要的地位,贯穿中学化学始终,是中学化学教学的重点和难点。在高考题和联考题等大型考试中选择题主要以离子方程式正误判断、离子共存形式命题,在非选择题中主要结合工艺流程、元素化合物等题考查离子方程式的书写与计算等。
一、离子方程式的正误判断
离子方程式是用实际参加反应的离子符号表示化学反应的式子,书写时一般遵循“写、拆、删、查”四步,且沉淀、气体、单质、氧化物和弱电解质五类物质需写成化学式形式。考试时通常从四个选项中选出正确或错误的离子方程式。解答这类试题如果还按照“写、拆、删、查”书写离子方程式再做出正误判断,显然比较耗时。一般说来,解答离子方程式正误判断类试题,可以通过以下“六看”快速排除2~3个选项,从而提高解题效率。
1.看是否遵循客观事实、不能主观臆造
离子方程式是根据化学方程式进行书写的,因此书写离子方程式必须遵循客观事实,以事实为基础。

2.看各物质形式书写是否正确
书写离子方程式时易溶、易电离的物质需写成离子形式,沉淀和弱电解质(含多元弱酸的酸式酸根离子)等五类物质需写成化学式形式。



3.看是否遵循原子守恒和电荷守恒等
书写离子方程式同样也要遵循原子守恒、电荷守恒,如果是氧化还原反应,还要遵循得失电子守恒等关系。



4.看是否符合“少量、过量”等限定条件
某些反应中相同的反应物,由于反应物用量(或滴加顺序)、浓度、溶液酸碱性等不同,对应的离子方程式也不同,因此在判断或书写离子方程式时要注意这些限定条件。



5.看是否漏写某些离子间的反应
有的离子反应中有多种离子参加反应,有时可能漏写某些离子,比较常见的有:


6.看各离子的配比情况是否正确

通过上述“六看”不能确定的离子方程式,可再根据四步书写的方法进行书写判断,从而选出符合题意的选项。
【例1】[2018·湖北省部分重点高中联考]能正确表示下列反应的离子方程式的是
( )

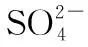
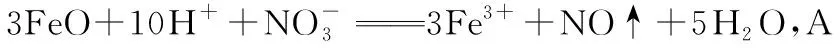
【答案】C
【点评】解答本题根据“六看”可快速排除A项和B项,再结合限定条件按照离子方程式的书写步骤和方法即可选出正确答案。书写与量有关的离子方程式通常按照“以少定多”的原则来书写,量少的离子完全反应,化学计量数定为“1”,以此来确定量多离子前边的化学计量数。
【例2】(1)[2018全国卷Ⅰ·27题节选]Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.010 00 mol·L-1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为____________,该样品中Na2S2O5残留量为____________g·L-1(以SO2计)。
(2)[2017天津卷·10题节选]SO2的除去(双碱法):用NaOH吸收SO2,并用CaO使NaOH再生


从平衡移动的角度,简述过程②NaOH再生的原理________________________。
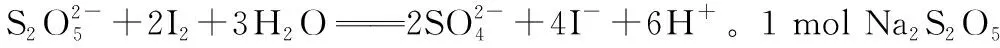
根据关系式:
Na2S2O5~ 2SO2~ 2I2
2×64 g 2 mol
m(SO2) 0.010 00 mol·L-1×10.00×10-3L
解得m(SO2)=6.4×10-3g。
解得x=0.128 g,即该样品中Na2S2O5残留量为0.128 g/L。



【点评】非选择题中书写离子方程式时,要注意抓住题中信息,准确的找出反应物和生成物,根据化合价变化或少量、过量等限定条件写出离子方程式,完成书写后可根据电荷守恒、原子守恒等进行检查。
二、离子共存问题
离子共存,是指多种离子在指定的溶液中不发生任何化学反应。一般说来,在溶液中能大量共存的离子不能发生以下六类反应。
1.不能生成难溶物或微溶物

2.不能生成气体或挥发性物质

3.不能生成弱电解质

4.不能发生氧化还原反应

5.不能发生互促水解反应

6.不能发生络合反应
在溶液中能发生络合反应的离子不能大量共存。如Fe3+与SCN-因生成络合物而不能大量共存。
在判断离子共存类试题时,还要结合试题中每个选项给出的限定条件进行综合分析,离子共存类试题中常见的限定条件主要有以下几类。
1.无色透明溶液

2.能使指示剂呈特殊颜色的溶液
如能使紫色石蕊变红的溶液呈酸性,使紫色石蕊变蓝(或使酚酞变红)的溶液呈碱性,使甲基橙变红的溶液呈酸性。
3.可能呈酸性或呈碱性的几种溶液
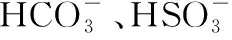
②能和Al反应生成H2的溶液:该溶液可能呈酸性或碱性,如稀硫酸或NaOH溶液均能与Al反应生成H2;需注意的是HNO3溶液无论浓稀与Al均不能生成H2。

④溶液中c(H+)=10-10mol/L的溶液,溶液呈碱性(即pH=10);而溶液中水电离出的c(H+)=10-10mol/L的溶液,溶液可能呈酸性或碱性(即pH=4或10)。
4.特定溶液
如0.1 mol/L的FeCl3溶液中,I-不能与其共存(发生氧化还原反应)。
【例3】[2015·江苏卷]常温下,下列各组离子一定能在指定溶液中大量共存的是
( )

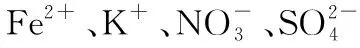
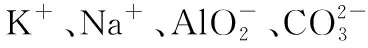
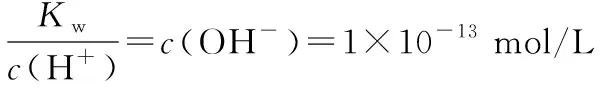
【答案】B
【点评】解答此类试题需认真审题,注意是一定能大量共存、可能大量共存,还是不能大量共存;还要认真挖掘各个选项中的隐含条件,根据选项判断溶液究竟呈酸性还是碱性,以及溶液呈酸性或碱性时,H+或OH-能否与给定离子发生反应等。
【例4】[2018·长春一模]下列各组离子或物质是否能够大量共存的评价及离子方程式的书写均正确的是

( )

【答案】D
【点评】随着高考制度改革,命题越来越新颖,这种离子方程式(或离子共存类)与评价类试题越来越多,要引起广大考生的注意,这可能是未来的命题趋势。

