反刍动物瘤胃原虫的化学感知及信号通路研究进展
2018-12-05崔爽青李胜利孙海洲张春华张崇志邴新帅
崔爽青,李胜利,孙海洲,金 鹿,桑 丹,张春华,张崇志,邴新帅,白 刚
(1.内蒙古农业大学 内蒙古 呼和浩特 010018;2.内蒙古农牧业科学院动物营养与饲料研究所,内蒙古 呼和浩特 010031;3.鄂尔多斯市农畜产品质量安全中心,内蒙古 鄂尔多斯 017000)
瘤胃微生物在反刍动物消化、健康和免疫过程中发挥着重要作用[1],胃肠道微生物被视为反刍动物的一个“微生物器官”,提供给宿主所不具备的消化代谢植物纤维等营养物质的能力[2]。原虫对小肠的蛋白质供应量已不同于以前低质粗饲料水平下建立模型的估测量,瘤胃原虫在维持瘤胃内稳态和为动物机体供应能量和蛋白质上发挥着重要作用。因此,瘤胃微生物特别是瘤胃原虫的组成和营养代谢特点对于精准养殖有重要的借鉴意义。
1 瘤胃微生物与瘤胃发酵
瘤胃是一个十分复杂的厌氧微生物发酵系统,这个微生态体系包括不同的原核微生物(细菌和古菌)、真核微生物(原虫和真菌)和噬菌体。这些微生物在瘤胃中主要占据着三个生态位:液相、食糜和消化道粘膜,75%以上的瘤胃微生物附着于瘤胃食糜和粘膜[3]。瘤胃中原虫数量虽然比细菌少得多,但是由于其体积较大,在瘤胃中的生物量可以达到10%~50%[4]。瘤胃内的原虫主要属于纤毛虫纲(Ciliates)均毛虫科(Holotrichidae)的绒毛虫属(Dasytricha)和头毛虫科(Ophryoscolecidae)的双毛虫属(Diplldinium)、内毛虫属(Entodinium),其中以内毛虫和双毛虫最多,约占纤毛虫总数的85%~98%。
Russell[5]报道,在瘤胃微生物降解饲料过程中所产生的大量挥发性脂肪酸(VFA),经瘤胃壁渗透进入血液吸收后,可为反刍动物提供50%~70%的能量需求。此外,反刍动物机体60%~70%的蛋白需求,是由外流出瘤胃的微生物提供的。Bach[6]指出,外流出瘤胃的微生物蛋白总量的多少,依赖于瘤胃内营养底物的可利用性以及瘤胃微生物对于这些营养底物的利用效率。多年以来,传统的瘤胃代谢经验模型在反映营养物质降解过程的复杂性和提高其利用效率方面,进行了诸多有益尝试。但不尽如意的是,这些模型受限于对不同日粮条件下瘤胃微生物蛋白产量及其外流量规律的认识不够深入。
2 瘤胃内原虫外流速率与蛋白质周转
在当前奶牛和绵羊营养领域,Dijkstra模型(1994)[7]和康奈尔净碳水化合物和蛋白质体系(CNCPS)[8]已被开发用来提高日粮营养物质的利用效率及减少氮向环境中的排放。需要指出的是,这些模型的建立都是基于这样一个概念,即瘤胃内氮周转(intra-ruminal N recycling)的增加是由于原虫的大量自溶引起,并且假定原虫很少甚至没有外流出瘤胃。这些假设均建立在数量非常有限的体内(invivo)试验观测结果,有主观臆断之嫌,不免也就影响了这些模型对瘤胃代谢模拟的实效。Dijkstra 在其1994 提出的模型中,最初假定原虫外流出瘤胃的速率是固相流通速率(kp)的一半;而CNCPS 体系则假定没有原虫外流出瘤胃[9]。1998 年版的Dijkstra 模型依据近几年的大量报道,调高了此前版本所设定的原虫外流速率[10]。Hook[11]研究指出,Dijkstra1998 版模型在此方面的认定是基于Bauchop与Clarke[12]在早期电子显微镜的研究结果,而且也未考虑吸附于瘤胃固相颗粒上的内毛原虫量,如此一来出现了该模型低估了原虫代谢池的大小。Dehority[13]和Williams[14]研究指出,众多学者基于对饲喂后瘤胃等毛原虫的行为研究结果,武断地推测瘤胃中内毛原虫亦有着相似的瘤胃“宅”(sequestration)现象。分析Prins等[15]在这方面的报道,发现这些推断大多来源于体外批次培养的研究结果。在体外批次培养情况下,累积的高浓度乳酸能够溶解原虫细胞。Kebreab[16]撰文指出,目前基于原虫自溶的瘤胃建模,很可能夸大了原虫细胞在瘤胃内的真实自溶量。在这方面,Firkins[17]进一步指出,现有诸多模型版本中模拟原虫代谢动力学,是完全基于绵羊和奶牛在低干物质采食量(DMI)情况下的研究结果;现实情况是,当奶牛DMI增加时,瘤胃固相外流速率(kp)也随之增加,原虫细胞外流向小肠的速率亦同步增加,瘤胃原虫世代间隔会降低,原虫生长效率加快;在上述两方面的共同作用下,瘤胃内原虫氮无效再循环将会降低;另外,原虫的外流还很可能受到固相颗粒的“表面附着”(apparent attachment)影响。多年以前,Bauchop和Clarke[12]利用扫描电镜技术,观察到在绵羊瘤胃内前毛虫属(Epidinium)原虫表面附着于饲草颗粒,并由此产生了“dogmas”这一瘤胃微生物学名词,意指原虫附着于饲料和颗粒。从Williams 与Coleman[14]在这方面详尽研究的思路来看, Dehority[18]完全忽视了原虫长期附着饲料颗粒的重要生物学意义。Sylvester[19]和Karnati[20]的研究指出,瘤胃内原虫的外流速率几乎与瘤胃固相kp相当。Sylvester等[21]在体外试验中也指出,原虫可根据转化间隔调整其世代周期。
Dehority和Tirabasso[22]已充分研究揭示,等毛原虫具有识别糖浓度梯度变化的感知作用。尽管他们的结果显示,由分子的化学感知(chemosensing)到原虫游动之间有一定的时间间隔,但这足以表明此现象与细胞间糖原浓度变化相关。Leick和Lindemose[23]曾用“化学增活(chemokinesis)”一词用于强调四膜虫(Tetrahymena)无方向性的随机运动。当饲料被反刍动物摄入到瘤胃中时,诸多以糖类、氨基酸和肽等形式存在的化学感应因子亦随之在瘤胃液中释放。Williams和Coleman[14]报道,摄食后的奶牛瘤胃液中,等毛虫的化学感知作用将随着糖的降解和贮存而降低,并停留在瘤胃中部。Russell[5]报道,较细菌而言,氨基酸和肽对瘤胃原虫生长的刺激作用更明显。Dehority[13]注意到,在充足供应营养底物后,奶牛瘤胃内的等毛原虫趋于下沉向性运动(ventral swimming),当其采食完后背向运动(dorsal swimming),并且在不同的日粮类型下整个种群内的绝大多数同步协作。这一点的研究对于瘤胃建模的意义非常重大,因为背向游动可增加等毛原虫外流出瘤胃的机率。因此,对于内毛原虫和等毛原虫来说,瘤胃外流速率的增加势必会加快其生长速率以补偿增加的外流速率。
对于瘤胃原虫的研究,主要集中于全部或部分驱除原虫对于反刍动物消化代谢的影响。樊艳华[24]汇总了1962~2012年国内外关于瘤胃驱原虫来提高反刍动物氮利用率的研究结果,总结得出驱原虫后有机物、中性洗涤纤维和粗蛋白在整个消化道内的降解率都降低,有机物和中性洗涤纤维在瘤胃的降解率降低,瘤胃pH、NH3-N以及VFA降低,微生物蛋白的合成效率增加。Mosoni等[25]研究发现,短期(10周)驱原虫后分解纤维的菌群减少,日粮中纤维物质的降解率降低,产甲烷菌减少,甲烷排出降低;而长期(2年)驱原虫后分解纤维的菌群和产甲烷菌都增加。韩春艳等[26]、秦炜赜等[27]、经语佳等[28]和赵士萍等[29]近年来也进行了驱除原虫实验,得到了与之前学者类似的结果。驱除原虫对反刍动物来讲有利有弊,但他们都没有考虑原虫蛋白对反刍动物小肠蛋白质的贡献。
3 瘤胃内原虫化学感知信号通路
反刍动物对氮的利用率只有20%~35%,集约化牛羊养殖场相当关注N的利用效率,因为这直接关系着养殖成本和环境压力。有鉴于此,国内外学者相继开发了诸如Dijkstra[10]和CNCPS等[8]知名模型并广泛使用。这些模型对微生物N的外流速率及其外流小肠量的估测是既不准确又不精确的,特别是对瘤胃中非液相阶段的原虫数量几乎未知。正如Firkins等[30]指出的,这些缺憾扩大了对代谢蛋白质(metabolizable protein,MP)量预测的边际错误。生产实践中,为避免MP预测错误,牧场主往往采用过量饲喂饲料蛋白质的“矫枉过正”做法,造成N利用率下降、宝贵的蛋白饲料资源浪费和环境污染。
多年来,国际上一些学者对非瘤胃原虫的营养化学感知作用及细胞信号转导,进行了非常有益的探索,很有借鉴意义。Keizer-Gunnink等[31]和Leick等[32]报道,cGMP依赖性蛋白激酶G(PKG)与纤毛膜化学感应相关,可刺激纤毛虫细胞生长;阻断cGMP激活的PKG,可导致纤毛虫的游动时间越长。Satir[33]指出,在这种因营养梯度改变而发生的信号介导中,cAMP的水平升高与蛋白激酶A(PKA)和钙调素活性增加关联。Fukami等[34]发现,在营养化学感知因子的诱导下,单细胞真核生物其细胞内相对比胞外能适应更高的Ca2+浓度。Bartholomew等[35]对四膜虫的研究发现,一些钙依赖过程如β-微管蛋白(β-tubilin)的钙调蛋白激活磷酸化可介导纤毛逆转。Leick和Lindemose[23]认为,葡萄糖和氨基酸营养的化学感知作用,可激活原虫磷脂酰肌醇3-P 激酶(PI3K)-TOR 信号通路,促进纤毛运动和相应增加养分消化过程中的有效性。另外,相关研究亦显示,蛋白激酶G(protein kinase G) 参与细胞膜信号传导。
Lampert等[36]建立了非瘤胃纤毛原虫化学感知作用和囊泡转运及传递模型。在这一模型中,磷脂酰肌醇3-P激酶、雷帕霉素靶蛋白(mTOR)、蛋白激酶C、、二酰基甘油、肌醇1,4,5-三磷酸、亚硝基铁氰化钠(sodium nitropusside)、渥曼青霉素(wortmanin)、胰岛素(insulin)等参与了调节作用,其中渥曼青霉素为PI3K的抑制剂,胰岛素可以解救(rescue)渥曼青霉素对PI3K抑制作用,亚硝基铁氰化钠能够激活鸟苷酸环化酶(guanylyl cyclase)最终活化蛋白激酶G,染料木黄酮(genistein)为受体酪氨酸激酶的阻断剂。
磷脂酰肌醇-3-激酶(PI3K)是一个包括许多脂质激酶的家族,由1个调节亚基(P85)和1个催化亚基(P110)组成。mTORC1是mTOR的复合物之一,是一种重要的信号调控分子, 它通过磷酸化作用调控细胞内mRNA的翻译,参与膜蛋白转运、蛋白质降解、蛋白激酶C信号转导和核糖体合成。mTORC1可以对氨基酸、激素、生长因子、葡萄糖产生应答。它们通过mTORC1 信号传导通路调节S6K1(ribosomal protein S6 kinase)和4E-BP1 (eukaryoticinitiation factor 4Ebinding protein 1)的磷酸化, 进而从翻译水平上调节基因表达。在细胞中,胰岛素及胰岛素样生长因子通过其受体及胰岛素受体底物激活PI3K/AKT/mTORC1通路,而其他生长因子多通过E-Ras激活PI3K/AKT/mTORC1通路。磷酸酶基因(PTEN)使磷脂酰肌醇三磷酸(PIP3)的D3位去磷酸化以抑制在PI3K的催化下磷脂酰肌醇二磷酸(PIP2)向PIP3的转变。AKT在PIP3作用下向细胞膜转位,继而被PI3K激活的PI3K依赖性激酶1(PDK1)同时磷酸化激活,直接磷酸化激活mTORC1。磷酸化的AKT还可以使TSC2磷酸化,抑制TSC2的活性,加速TSC1与TSC2的降解,这个过程引起mTORC1在TSC1-TSC2复合物抑制的状态下释放,从而激活mTORC1,增强其信号传导通路。激活的mTORC1通过调节下游因子作用于基因的调控。
通过对非瘤胃原虫对碳水化合物和肽的化学感知作用的研究表明,瘤胃原虫这一单细胞真核生物存在营养化学感应(nutrient chemosensing)机制,并通过PI3K/AKT/mTORC1通路实现复杂的细胞通信与感应,以此来保障瘤胃发酵和机体稳衡控制(homeostasis)。营养化学感应机制,是指通过营养物质及其代谢产物与细胞膜或细胞内受体结合, 或营养物质载体跨膜运输引起细胞体积和细胞膜电势的变化。这些营养物质感应受体能够引起细胞信号传导系统的级联反应,最终导致大量蛋白质表达和活性的改变。
瘤胃微生物把瘤胃发酵饲料产生的能量用于自身的生长、维持、贮存糖原和能量溢出。能量的主要流向与微生物的生长效率和饲料的营养利用效率密切相关。在高精料日粮条件下,原虫可以将用于生长和维持以外多余的碳水化合物合成储备碳水化合物(贮存糖原),供日后动员使用或直接流到小肠被动物机体吸收。另外,在碳水化合物严重过剩时将发生能量溢出[37]。原虫的自身维持和能量溢出不可逆地消耗ATP,减少了可用于蛋白质合成的ATP,相比之下储备碳水化合物存在着合成和降解的可逆关系,成为细胞内的ATP的“缓冲池”(如图1)。在生物界中,蓝藻也存在类似的“溢出代谢”现象[38-40]。蓝藻中的糖原合成和使用,是适应光和养分可用性变化的常见机制,其糖原合成与光合作用和由glgC基因(slr1176)编码的关键酶ADP-葡萄糖焦磷酸化酶(AGPase)有关。这对于研究瘤胃原虫对小肠蛋白质的贡献,提高能量利用率,重新准确评估机体的能量利用率,有很大启发。
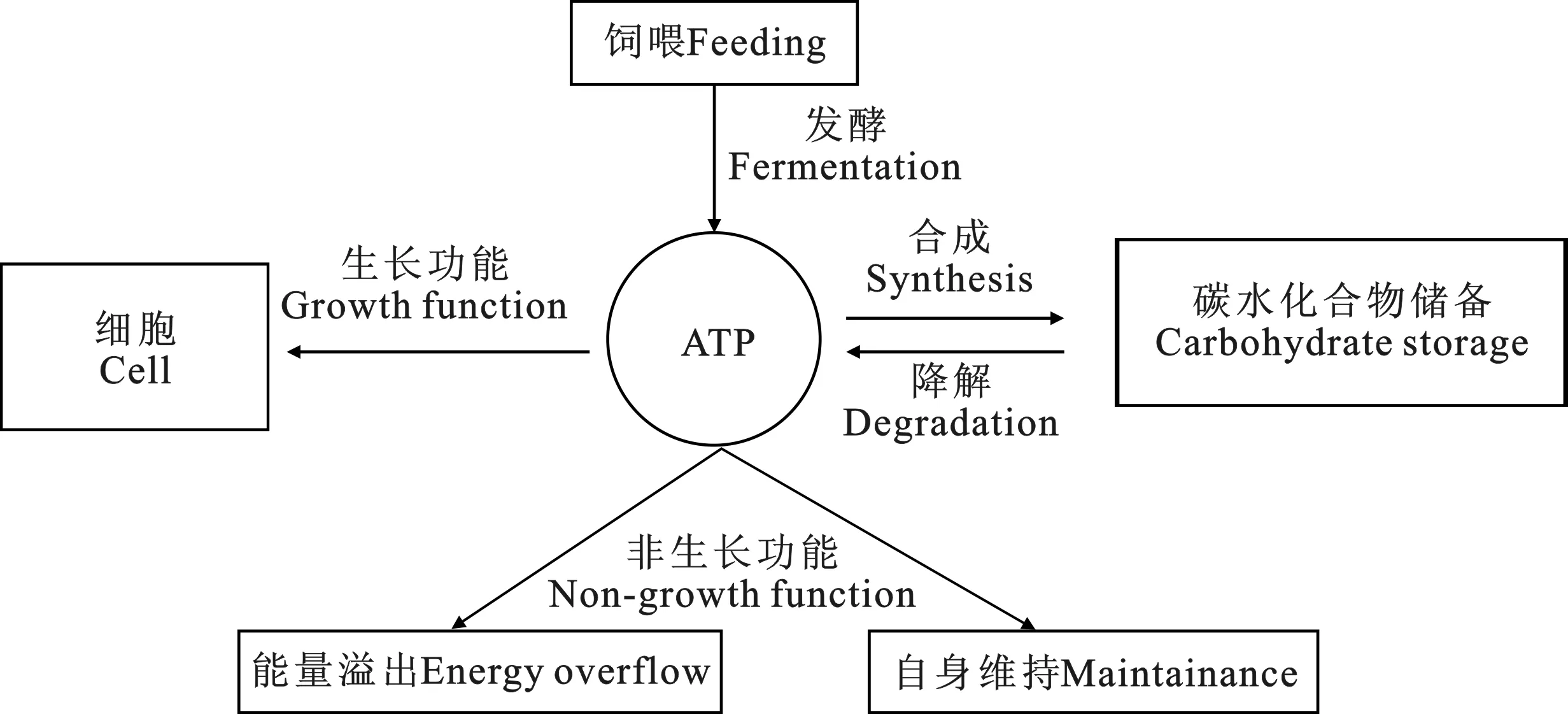
图1 瘤胃微生物ATP能量分配到生长功能、非生长功能和储备碳水化合物Fig.1 Partitioning of ATP toward growth functions, non-growth functions, and synthesis of reserve carbohydrate
4 小 结
在现在高精料的饲养条件下,原虫的生物量随之提高[41],而瘤胃原虫可以贡献高达50%的微生物生物量[42],这使其成为流出瘤胃的微生物蛋白的重要组成部分。沿用以前低质粗饲料条件下微生物对小肠蛋白质的供应量的估测方法,低估了瘤胃原虫对小肠蛋白的供应量,造成了饲料粗蛋白的过量供给,从而造成宝贵的蛋白饲料资源浪费和环境污染。研究瘤胃内原虫对各种营养物质化学感知作用,以及内毛原虫、纤毛原虫等不同种属原虫对于不同信号传导调节剂感受差异以及相关分子机制,将有助于了解在瘤胃内原虫在微生物功能中的重要作用,更好地预测瘤胃氮循环,减少粪尿氮的排放,提高反刍动物氮的利用率。
