鲤池塘养殖中后期藻华动态与水环境特征
2018-12-05付琴琴高云霓宋冬蓥胡旖媚陈婧婉赵燕楠聂万林
付琴琴, 高云霓, 董 静, 王 磊, 宋冬蓥, 胡旖媚, 陈婧婉, 赵燕楠, 聂万林
(1.河南师范大学水产学院/河南省水产动物养殖工程技术研究中心,河南新乡 453007;
2.宜昌市农产品质量安全监督监测站,湖北宜昌 443000)
池塘养殖是我国水产养殖的主要方式之一,2016年《中国渔业统计年鉴》显示,池塘养殖面积占我国淡水养殖总面积的43.94%,远高于水库、湖泊和河沟等其他养殖方式。然而,高密度、高投饵率和高换水率的传统养殖模式使得养殖水环境富营养化问题日益严重,藻华现象普遍,不仅严重影响渔业产量和质量,制约水产养殖业的健康发展,还对人类健康构成威胁[1]。因此,养殖水体营养过剩和藻华污染问题,已成为国内外学者广泛关注的重要课题之一。
目前,关于水华期间藻类群落结构变化的研究水体多为湖泊、水库等大型水体[2-3],对养殖水体的研究并不多[4]。养殖池塘水体相对于自然湖泊有水体面积较小、水体较浅、营养盐浓度较高等特点[5],不仅能为水华暴发提供稳定的水体环境,而且相对于大型水体,还能够加快并放大浮游藻类群落结构与环境因子间的响应过程,对藻华水体的生态学研究具有重要意义[6]。另外,浮游藻类生长周期短,对环境变化敏感,所以环境条件的变化能很快引起浮游藻类群落结构变化,因此适当缩短采样间隔可以更精确地反映养殖池塘水华期间藻类群落结构与环境因子的联系[4,7-8]。
以2个鲤(Cyprinuscarpio)养殖池塘为研究对象,对比观测养殖中后期藻华动态和水环境特征,结合养殖生态环境中各要素间的相互关系,深入剖析引起养殖水体藻华暴发的内因和外因,从而对养殖水体藻华的预防和控制及优良藻相和养殖生态的构建进行指导,促进池塘养殖的健康绿色发展。
1 材料与方法
1.1 养殖池塘概况

1.2 样品采集与处理
于2016年9—11月,连续6周密集采样监测池塘藻类和水质变化,现场用YSI水质分析仪测定水温(WT)、pH值、电导率、盐度等指标,于池塘中心区域水面下0.5 m采集1 L水样带回实验室分析水质指标,具体包括碱度(AT,酸碱滴定法)、总氮浓度(TN,碱性过硫酸钾法)、总磷浓度(TP,钼锑抗分光光度法)[9]、活性磷浓度(PO4-P,钼锑抗分光光度法)、氨态氮浓度(NH3-N,纳氏试剂分光光度法)、硝态氮浓度(NO3-N,紫外分光光度法)和亚硝态氮浓度(NO2-N,酚二磺酸分光光度法)[8]。现场采用25号浮游生物网采集藻类带回实验室分类鉴定,同时采集1 L水样,用鲁哥氏液固定,带回实验室沉淀浓缩后镜检计数。
1.3 藻类样品分析
在光学显微镜下,参照《中国淡水藻类》[10]《中国淡水生物图谱》[11]《淡水微型生物图谱》[12]及《湖泊富营养化调查规范》[13]等资料对藻类样品进行鉴定和计数。
1.4 数据分析
采用Excel 10.0对数据进行整理和统计,用SPSS 20.0进行差异显著性分析,用CANOCO 4.5软件进行相关性分析。Shannon-Wiener香农维纳多样性指数(H)、Pielou均匀度指数(J)、Margalef物种丰富度指数(D)和McNaughton优势度(Y)均参照文献[14]进行计算。采用典范对应分析(CCA)对藻类种类和营养因子间的相互关系进行研究[15-16],为了使藻类密度数据呈正态分布,对藻类种属密度、营养因子数据都进行lg(x+1)处理[17]。
2 结果与分析
2.1 池塘藻类动态
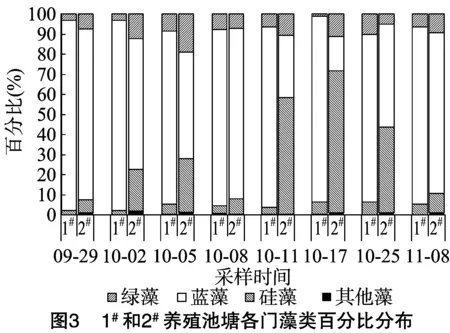
2.1.1 种类组成 调查期间1#池塘鉴定出20种(属),2#池塘鉴定出藻类22种(属),隶属于绿藻、蓝藻、硅藻、裸藻4门,绿藻门种类最多(表1)。但试验期间优势种主要为蓝藻门的铜绿微囊藻(Microcystisaeruginosa),2#养殖池塘中,除10月中旬硅藻门的梅尼小环藻(Cyclotellameneghiniana)为优势种外,其他时段铜绿微囊藻仍占优势。
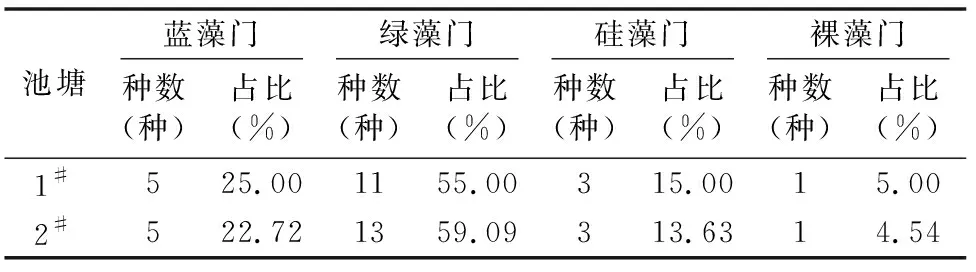
表1 池塘藻类种数及占比
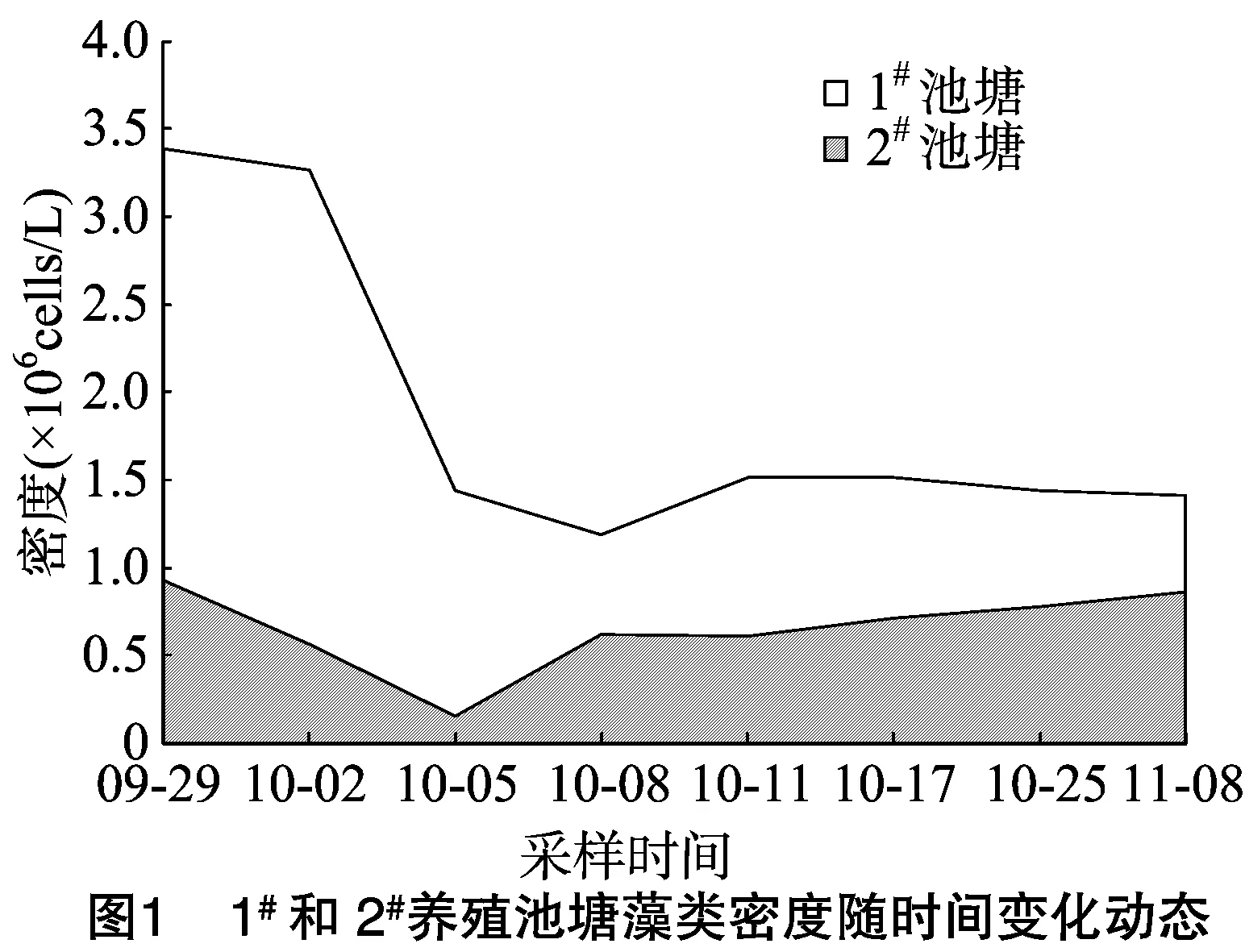
2.1.2 藻类密度 由图1可知,1#池塘藻类密度高于2#池塘,变化范围为1.18×106~3.39×106cells/mL,平均值为1.89×106cells/mL,高峰出现在9月底;2#池塘藻类密度变化范围为0.16×106~0.92×106cells/mL,平均值为 0.65×106cells/mL,高峰也出现在9月底。
作为优势种的蓝藻门铜绿微囊藻,其密度随时间变化趋势如图2所示,与图1藻类密度趋势较为一致,其中1#池塘中铜绿微囊藻细胞密度在9月底最高,为3.20×106cells/mL,优势度占藻类密度比例为94.32%,10月上旬下降到1.03×106cells/mL,从10月中旬到试验结束一直维持在1.19×106~1.35×106cells/mL范围内,优势度不低于82.89%;2#池塘中微囊藻细胞密度随时间的变化幅度较小,试验期间一直维持在0.07×106~0.75×106cells/mL范围内,优势度波动较大,为 16.92%~84.07%(表2)。这与养殖池塘中藻类组成的变化有关,试验前期2个池塘的优势藻类均为蓝藻,其次为硅藻和绿藻,裸藻最少。试验后期,1#池塘的优势藻类仍为蓝藻,但2#池塘的优势藻类为硅藻(图3)。
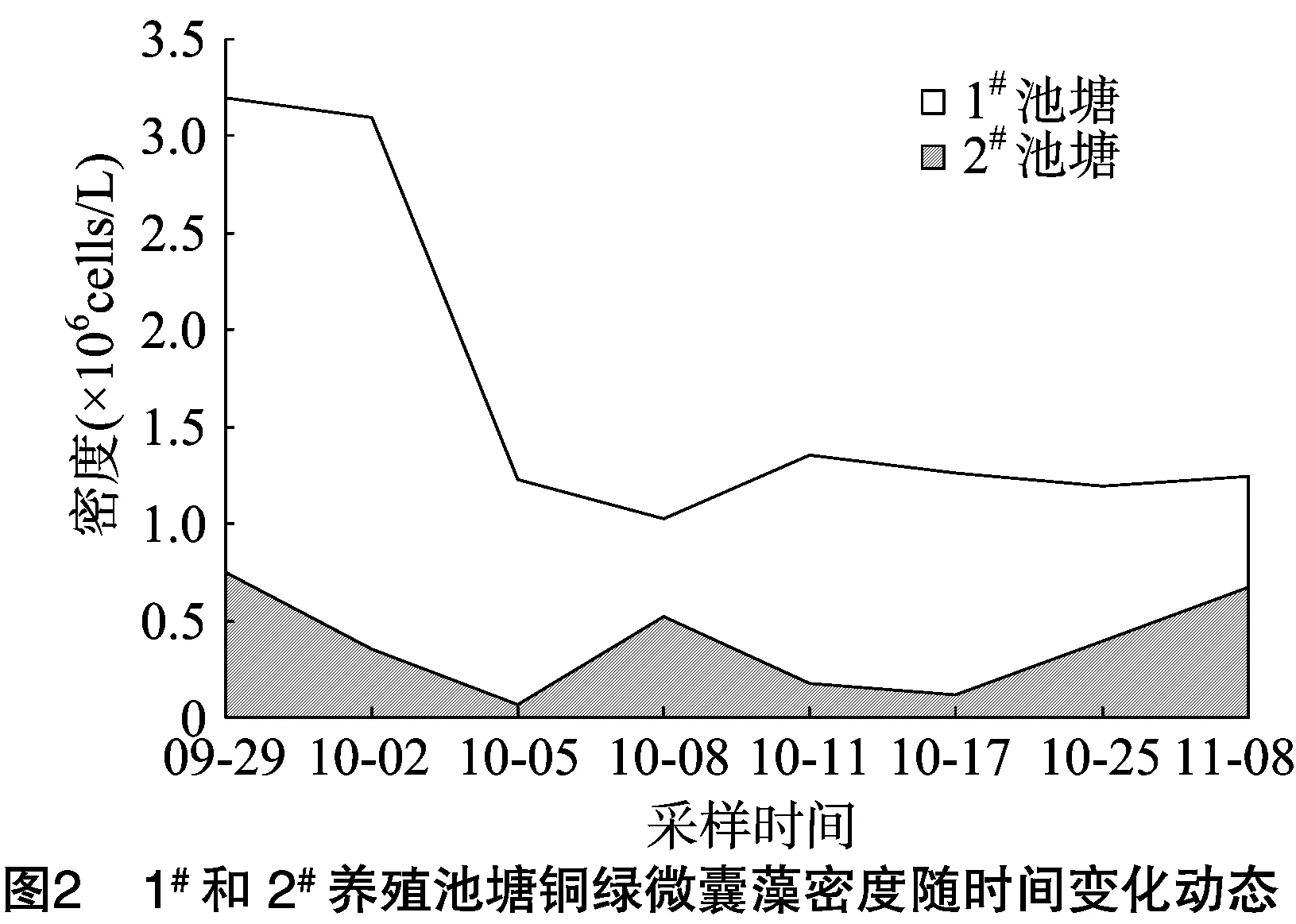
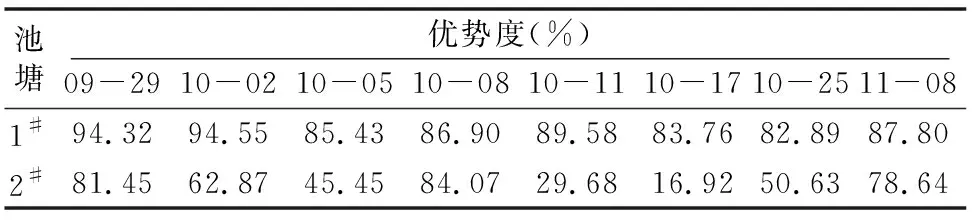
表2 1#和2#养殖池塘中铜绿微囊藻优势度
2.1.3 池塘藻类群落多样性 由图4可知,1#、2#池塘藻类多样性指数(H)分别为0.32~0.79、0.73~1.72,均匀度指数分别为 0.12~0.28、0.29~0.65,丰富度指数分别为0.85~1.13、0.89~1.31。2#池塘多样性和均匀度指数明显优于1#池塘。
2.2 池塘理化环境
从表3可以看出,调查期间2个池塘水温、pH值、电导率、盐度值、碱度均无明显差异,且变化范围基本一致。
2.3 氮磷营养指标变化
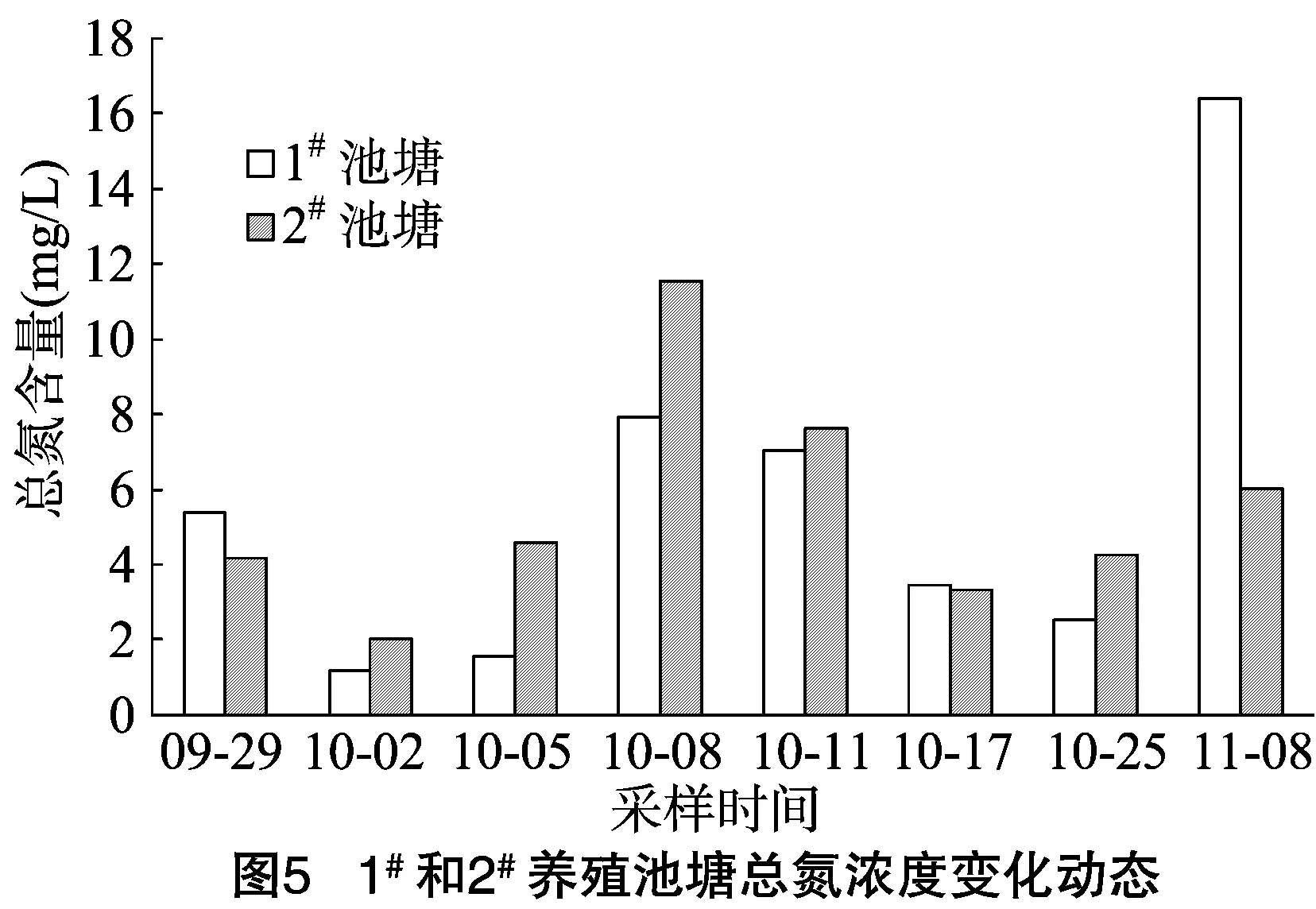
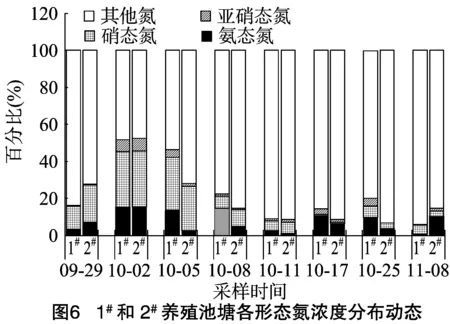
由图5可知,试验期间,1#和2#池塘总氮浓度均有较大波动,但均值差别不大,分别为5.68、5.44 mg/L。1#和2#池塘TN含量变化范围分别为1.18~16.40 mg/L和2.02~11.54 mg/L,2个池塘的变化趋势较为一致。由图6可知,硝态氮、亚硝态氮、氨态氮浓度在总氮浓度中所占比例较少,1#池塘3种氮的平均含量分别为0.42、0.08、0.33 mg/L,2#池塘分别为0.55、0.07、0.30 mg/L。截至10月上旬,硝态氮所占比例整体最高,之后的大多数情况下,氨态氮所占比例最高,亚硝态氮含量则整体处于最低水平。
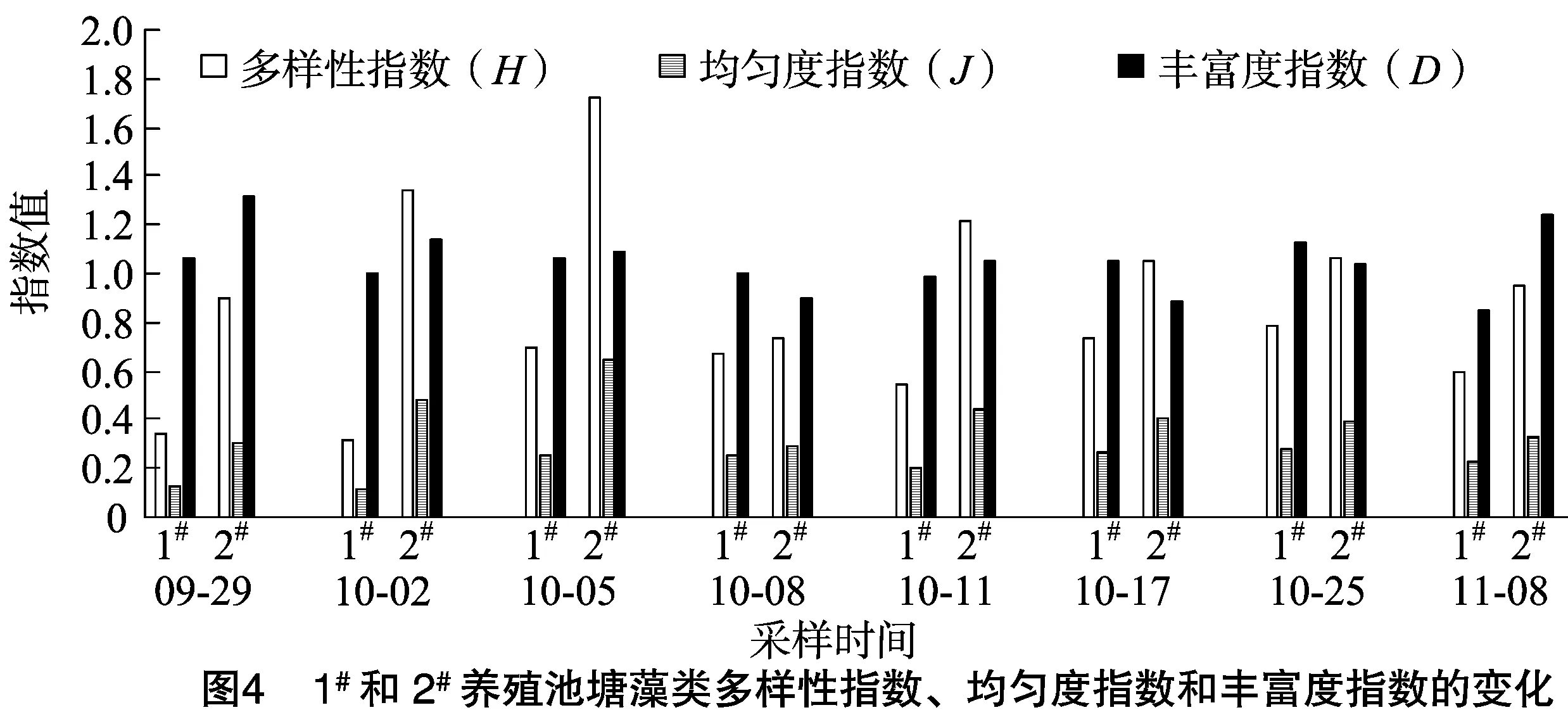
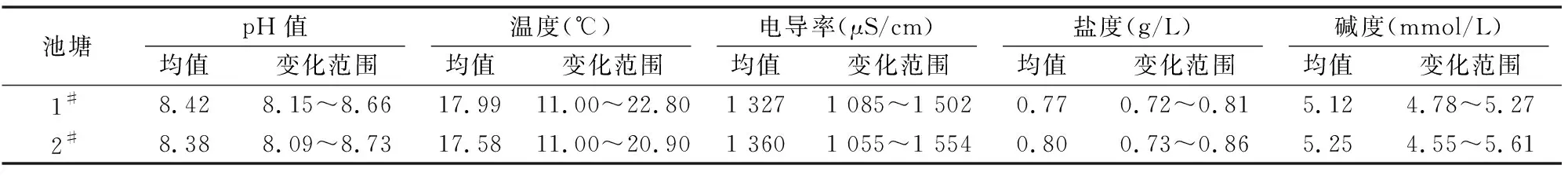
表3 试验期间养殖池塘各项理化指标均值和变化范围
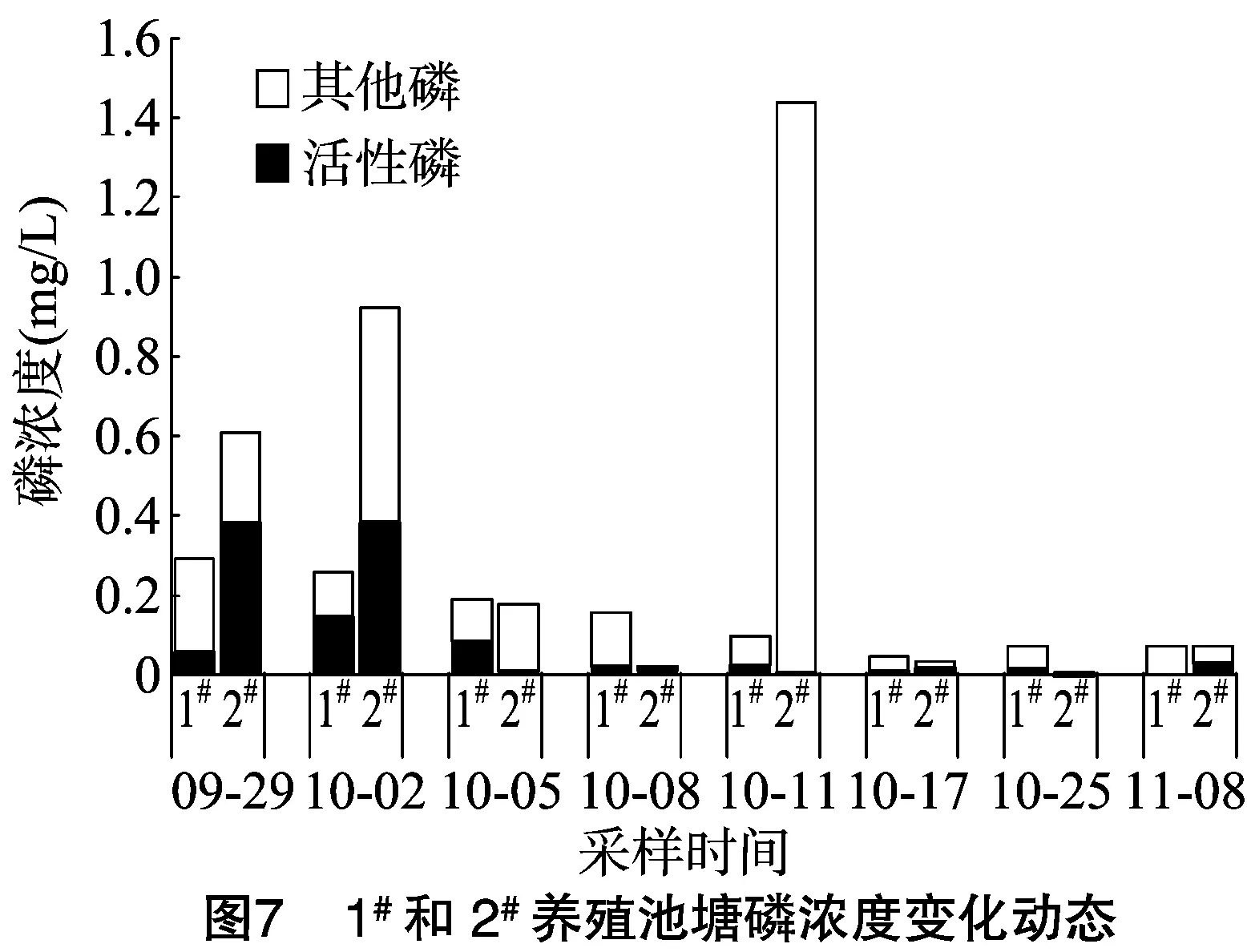
然而,2个池塘磷浓度有明显差异,1#、2#池塘TP浓度均值分别为0.15、0.41 mg/L,波动范围分别为 0.04~0.29、0.01~1.44 mg/L,活性磷浓度均值分别为0.04、0.11 mg/L,波动范围分别为0.00~0.15、0.01~0.38 mg/L。1#池塘TP浓度变化不明显,2#池塘TP浓度波动较大;2个池塘活性磷浓度整体呈下降趋势(图7)。
根据总氮、总磷浓度计算的氮磷比,1#、2#池塘均值分别为62.40、267.57,变化范围分别为4.57~231.24、2.19~1 105.04。
2.4 池塘藻类与营养因子的相关性
为确定2个池塘藻类增长与营养因子间的相关性,将2个池塘藻类种群密度与营养因子进行CCA分析。由表4可见,1#池塘CCA分析中,前2个排序轴的特征值分别为0.12、0.06,前2个营养因子轴与物种轴之间的相关系数分别为 1.00、0.98,4个排序轴共解释了86.50%的藻类群落变化及91.30%的藻类群落变化与环境营养因子间的关系,说明排序能较好地反映1#池塘浮游藻类与营养因子间的相关关系。由表5可见,在2#池塘CCA分析中,前2个排序轴的特征值分别为0.16、0.07,前2个营养因子轴与物种轴之间的相关系数分别为1.00、0.98,4个排序轴共解释了83.50%的藻类群落变化及96.30%的藻类群落变化与营养因子间的关系,说明排序能较好地反映2#池塘浮游藻类与营养因子间的相关关系。
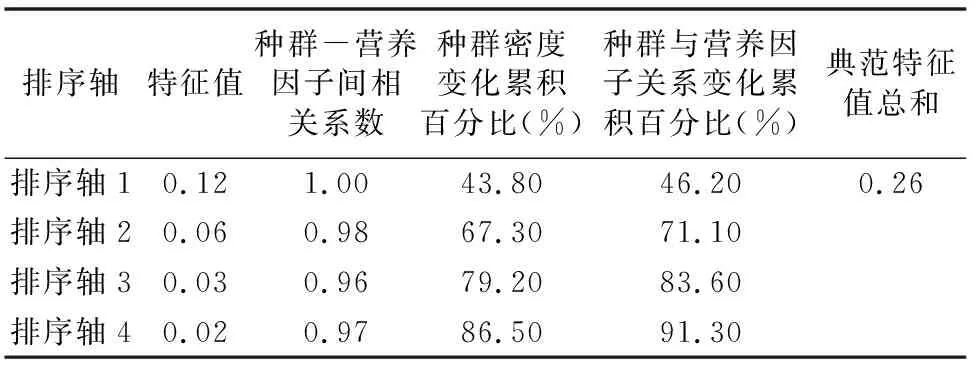
表4 1#池塘藻类种群密度变化和营养因子间的CCA排序结果
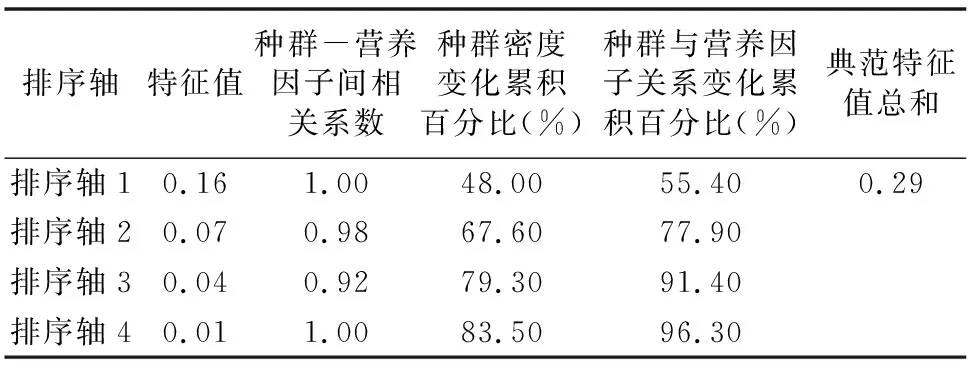
表5 2#池塘藻类种群密度变化和营养因子间的CCA排序结果
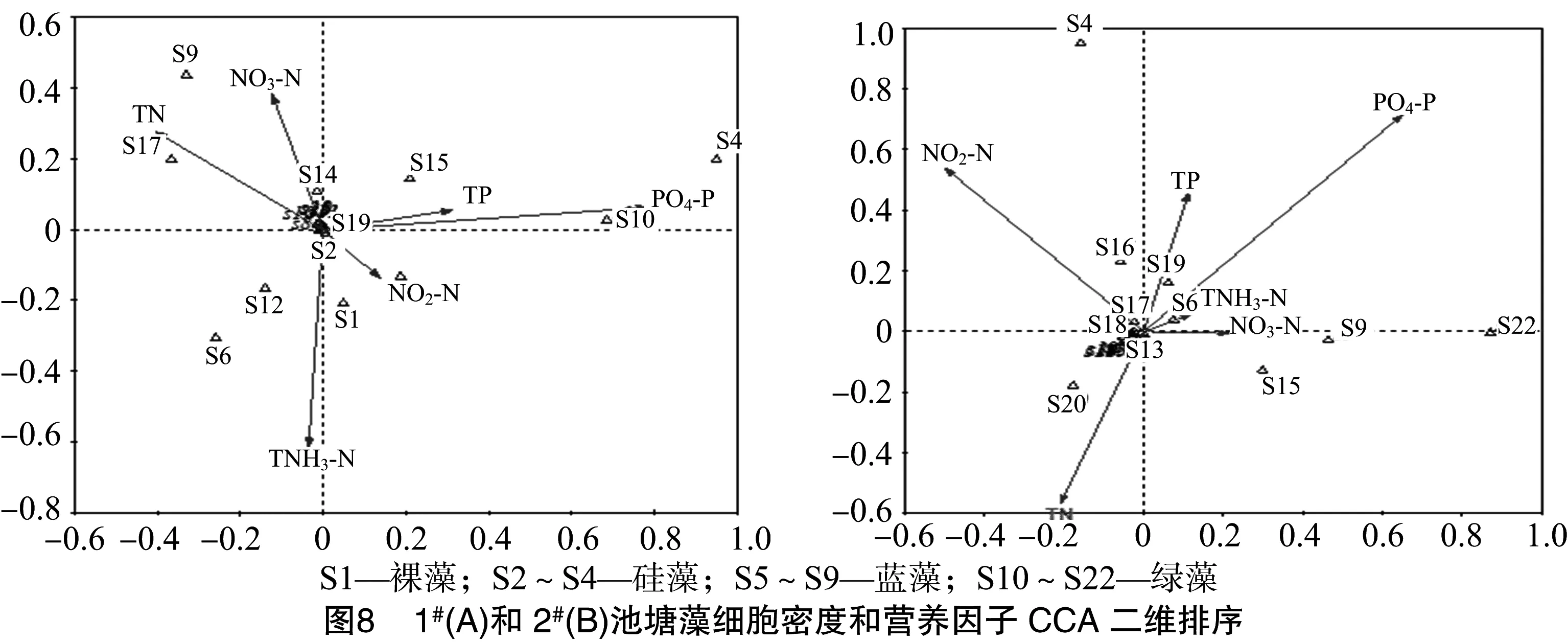
由图8-A可见,1#池塘中,第1排序轴与PO4-P浓度呈正相关关系(0.78),与TN浓度呈负相关关系(-0.40),第2排序轴与NO3-N浓度呈正相关关系(0.38),与NH3-N浓度呈负相关关系(-0.61),1#池塘中菱形藻(Nitzschiasp.,S4)、盘星藻(Pediastrumsp.,S15)、空星藻(Coelastrumsp.,S16)与PO4-P、TP浓度呈正相关关系,平裂藻(Merismopediasp.,S9)、集星藻(Actinastrumsp.,S17)与TN、NO3-N浓度呈正相关关系,与NO2-N浓度呈负相关关系,螺旋藻(Spirulinasp.,S6)、多芒藻(Golenkiniasp.,S12)和囊裸藻(Trachelomonassp.,S1)与NH3-N浓度呈一定的正相关关系,颤藻(Oscillatoriasp.,S7)与NO2-N浓度呈正相关关系。其他种类大都聚集在轴心位置,可能受到多个营养因子的综合影响。根据各营养因子的轴长可知,调查期间影响1#养殖池塘藻类群落结构动态的营养因子由强到弱依次为PO4-P>NH3-N>TN>NO3-N>TP>NO2-N。
由图8-B可见,2#池塘中,与第2排序轴相关的分别是PO4-P(0.70)和TN(-0.56),2#池塘中盘星藻(S15)、十字藻(Crucigeniasp.,S22)、螺旋藻(S6)、平裂藻(S9)的分布格局与NH3-N、NO3-N浓度呈正相关关系,菱形藻(S4)、空星藻(S16)、月牙藻(Selenastrumsp.,S19)与PO4-P、TP、NO2-N 浓度呈正相关关系,与TN浓度呈负相关关系。卵囊藻(Oocystissp.,S20)与TN浓度呈正相关关系,与其他营养因子呈负相关关系。其他种类大都聚集在轴心位置,可能受到多个营养因子的综合影响。根据各环境因子的轴长可知,调查期间影响2#养殖池塘藻类群落结构动态的营养因子由强到弱依次为PO4-P>TN>NO2-N>TP>NO3-N>NH3-N。
3 讨论
3.1 养殖池塘藻类群落特征
作为初级生产者,浮游藻类的种类组成和生物量决定着水生态系统的结构和功能,是评价水体营养程度和水质状况的重要指标之一[18]。对于池塘等养殖水体,藻类在改善和调节生态系统物质循环和能量流动方面发挥着重要作用[19],参与调节水体溶解氧、营养盐水平,是营造良好水色和合适透明度的基础[5]。尽管针对传统养殖池塘藻类群落结构的报道不多,但在池塘养殖基础上构建的新型养殖模式中,藻类群落特征成为一个不可或缺的检验指标。在陶粒浮床-池塘养殖系统中共检出藻类8门111属179种,多样性指数范围为 1.50~2.46,优势种以绿藻门的栅藻(Scenedesmus)和绿球藻(Chlorococcum)为主[20]。主养鲈鱼的浅水、深水池塘,藻类多样性指数均值分别达到3.00、2.81[21]。而本试验中的藻华池塘藻类种数和多样性指数明显偏低,且在大多数情况下优势种为蓝藻水华种类,这与健康养殖生态环境所需要的绿藻和硅藻等饵料藻占优势的藻类群落结构特征不同。
杨文等调查了某小型藻华池塘,共检出藻类5门54种属,其中绿藻最多,其次为蓝藻,但其水华优势种为丝状蓝藻[4],与本试验2个池塘铜绿微囊藻为水华优势种不同。尽管试验期间2个池塘表层肉眼都能观察到1层藻华,但其藻类群落特征仍有明显差异,具体表现在3个方面:藻细胞密度1#池塘明显高于2#池塘;水华蓝藻铜绿微囊藻细胞密度1#池塘也明显高于2#池塘,且1#池塘优势度不低于82.89%,而2#池塘在10月中旬硅藻门梅尼小环藻所占比重超过50%;1#池塘多样性指数和均匀度指数均明显低于2#池塘。
本调查养殖池塘规模较小,时间集中在养殖中后期,养殖品种为鲤和鲫,均为杂食性鲤科鱼类,养殖密度不高,但水体中藻细胞密度较高。南亚野鲮养殖池塘中混养鲤密度为0.5尾/m2时,可促进藻类生长,但达到1.0尾/m2时,这种效应即部分消失[22]。本试验中鲤的养殖密度达到2.0尾/m2,但总体养殖密度不高,对藻华的调控作用较小。2#池塘的藻类平均细胞密度低于1#池塘,可能与2#池塘中混养较多鲫有关,鲫在自然水体中的主要食物来源是藻类[23],对养殖池塘中藻类生物量也会有一定影响。
3.2 影响养殖池塘藻华动态的因素
影响藻类群落演替规律的生态因子,根据其作用方向可简单分为上行、下行效应,上行效应主要是在食物链上端的浮游动物、滤食性鱼类带来的影响,下行效应则主要是水体理化成分的影响。杨文等通过调查某小型藻华池塘浮游藻类群落动态及其影响因子认为,相比于浮游动物的影响,水体理化因子对藻类的群落演替影响力更大[4]。浮游藻类群落结构及其变化与光照、水温、营养盐浓度以及其他外界环境有关[24-25]。
与藻华池塘浮游藻类群落结构及其变化相关的理化因子主要包括pH值、水温等。López-Archilla等在研究西班牙富营养化湖泊时发现,pH值的升高是导致蓝藻水华暴发的主要因素[26]。在pH值低于7.1的处理中,铜绿微囊藻生长速率受到显著抑制[27]。本研究中2个池塘pH值变化范围为 8.09~8.73,一直处于较高水平,这种环境更有利于蓝藻生长,而不利于其他藻类生长[28],因此蓝藻生长占优势,并暴发蓝藻水华。研究表明,大部分蓝藻的最适温度为25~35 ℃,高于绿藻和硅藻[29],所以蓝藻在温度较高的水体中具有竞争优势,成为优势种。然而,本试验期间2个养殖池塘水温相对较低,1#、2#池塘平均水温分别为17.99、17.58 ℃,最高水温为22.80 ℃,最低水温为11.00 ℃,但铜绿微囊藻水华仍未消失。微囊藻水华在水温低于10 ℃的冬季仍小范围出现在太湖部分水域,且具有光合作用活性[30]。由此说明铜绿微囊藻水华可以在较广的温度范围内暴发。然而,本试验中2个池塘铜绿微囊藻细胞密度并不高,说明较低的温度对蓝藻的生长有一定影响。大部分硅藻都较为喜低温,与水温呈负相关关系[31],在本试验中10月中下旬硅藻在2#池塘中占优势,可能与当时水温降低较快有关。因此,可以认为水温是影响浮游藻类群落变化的重要因素之一。
然而,各类水体暴发藻华最根本的原因还是水环境中氮磷营养盐浓度的剧增。氮磷营养盐是影响浮游藻类群落结构的主要营养因子,同时也是藻类生长最主要的营养元素[32],本试验中氮磷浓度对养殖池塘的藻类群落分布均有明显影响,但其影响程度与氮磷形态相关。温度和硝态氮浓度变化是促进孟加拉某湖泊暴发微囊藻水华的诱因[33]。微囊藻水华暴发的水体总氮水平一般较高,而大多数情况下认为,磷浓度是影响藻类群落结构最重要的因素。Fernández等研究显示,除了季节因素导致的温度和太阳辐射外,总磷浓度是促进藻华暴发的关键因子,而在水华蓝藻种类中,磷会限制项圈藻的发展,但不会对微囊藻的生长产生限制[34]。本试验CCA分析结果显示,可溶性活性磷是影响2个养殖池塘藻类群落分布的主要环境营养因子,这与胡韧等在研究3座南亚热带串联调水水库浮游藻类群落的CCA结果[35]一致。本研究中,TN、TP、NH3-N、NO3-N等营养因子与2个养殖池塘藻类群落分布的相关性存在差异,这种差异可能与不同池塘中的优势种不同有关[8]。其中,NH3-N浓度与1#池塘藻类群落分布的相关性明显大于2#池塘,而NO2-N浓度与2#池塘藻类群落分布的相关性明显大于1#池塘,这可能与各养殖池塘不同的藻类群落对各种氮的吸收差异有关,此外营养盐浓度及其他营养因子也可能导致这种现象[36]。
不论是本试验中的养殖池塘,还是各类水库、湖泊、河流,蓝藻水华的暴发通常都是多重营养因子综合作用的结果[37]。郑丙辉等在研究三峡支流大宁河水华敏感期(2008年4—5月)浮游藻类分布特征与环境因子关系时发现,氮是调查期间影响浮游藻类细胞密度的关键因子,TN、TP、NO3-N、NO2-N、悬浮物浓度和透明度是影响浮游藻类组成的主要因素[38]。杨文等对小型藻华池塘生物-环境相关分析的结果显示,pH值、水温、光照度、总磷浓度等理化因子对藻类群落结构动态的影响力强[4]。本研究中的养殖池塘,包括磷酸盐在内的可溶性活性磷浓度是影响藻华动态的关键因素。
4 结论
2个鲤池塘养殖中后期均有不同程度的藻华现象,铜绿微囊藻在整体上是水华优势种,在1#、2#池塘中的优势度分别为 82.89%~94.55%、16.92%~84.07%。氮磷营养因子与藻类CCA分析结果显示,可溶性活性磷浓度是影响池塘藻华动态变化的主要因素,有必要在养殖中后期从内源和外源进行调控。
