miR-19a调控BMPR2与VEGF在肺动脉高压大鼠肺血管重构中的作用
2018-12-04林志武程生稞付勇杨齐邓明彬
林志武,程生稞,付勇,杨齐,邓明彬
(西南医科大学附属医院,四川泸州646000)
miRNA是一种无编码功能的单链RNA,主要干扰游离mRNA的翻译,实现转录后调控,参与调节细胞分化、增殖、凋亡,在肺动脉高压(PAH)形成中起重要作用[1]。miR-17-92基因簇能调节血管内皮生长因子(VEGF),诱导肿瘤血管增殖,且能调控骨形成蛋白Ⅱ型受体(BMPR2)表达。目前研究已表明,BMPR2与其配体结合后能明显抑制血管平滑肌细胞的分化、增殖,与PAH形成密切相关[2,3]。miR-19a是miR-17-92基因簇最重要的成员之一,可诱导肿瘤血管形成及血管内皮增殖,但其作用机制尚不明确。2016年3月~2017年11月,本课题拟构建PAH动物模型,通过腺相关病毒(AAV)转染miR-19a相关序列实现差异性表达,观察miR-19a调控BMPR2与VEGF在PAH大鼠肺血管重构中的作用,为PAH的治疗提供新的靶点和手段。
1 材料与方法
1.1 主要材料 实验动物:健康雄性SD大鼠30只,6~8周龄,体质量180~200 g,均由西南医科大学动物实验中心提供。主要试剂及仪器:miR-19a AAV质粒(上海和元生物技术公司);鼠抗BMPR2 IgG(1∶1 000,Bioworld),鼠抗Tubulin IgG(1∶5 000,Proteintech),HRP标记羊抗鼠IgG(1∶10 000,Proteintech);总RNA提取试剂盒(上海华舜公司),PCR试剂盒(北京天根生化科技公司),逆转录试剂盒(美国Invitrogen公司),BCA蛋白测定试剂盒(大连宝生物工程公司)。动物呼吸机(北京金洋万达科技公司),电泳仪(上海天能科技公司),PCR仪(Applied Biosystems),荧光定量PCR仪(杭州博日科技公司),凝胶成像系统(美国Biorad公司),压力换能器(北京新航兴业科贸公司)。
1.2 实验方法
1.2.1 大鼠PAH模型制备与分组转染处理 24只大鼠用2%戊巴比妥钠腹腔注射麻醉,固定气管导管接呼吸机,开胸切除左侧全肺,均PAH造模成功(8周后均出现饮食、活动耐量降低,呼吸频率升高,肺动脉管腔狭窄)。将模型大鼠随机分为P0、P1、P2、P3组各6只,另取6只仅左侧开胸作为假手术对照(C组)。P1、P2、P3组经气管分别导入滴度1×1012vg/mL的过载miR-19a AAV质粒、封闭miR-19a AAV质粒、空载miR-19a AAV质粒转染肺组织,P0、C组均经气管导入等量生理盐水。将各组分笼饲养于SPF级动物中心,喂养8周。
1.2.2 大鼠平均肺动脉压力(mPAP)测定 各组用2%戊巴比妥钠腹腔注射麻醉,剪开胸骨。用充满肝素的头皮针穿刺肺动脉主干,链接压力换能器与生物机能实验系统,记录波形并计算mPAP。
1.2.3 肺动脉组织形态观察及肺细小动脉平均中膜厚度(MT)测算 取各组完整右肺,部分以4%多聚甲醛固定24 h;石蜡包埋,连续5 μm厚切片。常规苏木精伊红染色,在显微镜下观察肺动脉组织结构改变,计算MT。
1.2.4 肺组织中miR-19a、VEGF mRNA检测 采用实时荧光定量PCR法。TRIzol冰上裂解大鼠肺组织后快速提取总RNA,按逆转录试剂盒说明书操作得到cDNA,以此作为模板行实时荧光定量PCR。miR-19a、VEGF分别以U6、β-actin作为内参,引物均由生工生物工程有限公司合成(见表1),以2-ΔΔCt计算目的基因相对表达量。
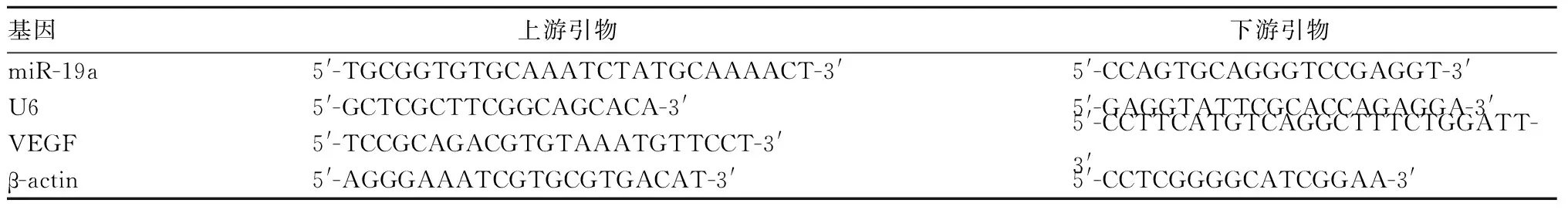
表1 miR-19a、VEGF及内参引物序列
1.2.5 肺组织中BMPR2蛋白检测 采用Western blotting法。将各组部分右肺组织置于含PMSF的裂解液中,4 ℃下以13 000 r/min离心5 min,取上清。BCA法测蛋白浓度,分别取20 μL蛋白样品进行SDS-聚丙烯酰胺凝胶电泳,200 mA恒流转膜1 h。5%脱脂奶粉室温摇床封闭30 min,一抗4 ℃摇床过夜,次日1×TBST漂洗5 min×3次;二抗TBST稀释室温孵育1 h,1×TBST漂洗5 min×3次。将膜置于Super ECL Plus超敏发光液2 min,暗室中胶片曝光,最后显影、定影处理。扫描胶片后利用Quantity One图像分析软件分析条带灰度,以BMPR2与butulin条带灰度比值表示BMPR2蛋白的相对表达量。
2 结果
2.1 各组mPAP比较 C、P0、P1、P2、P3组mPAP分别为(15.36±2.31)、(26.42±1.32)、(33.57±2.85)、(20.10±0.94)、(25.74±1.31)mmHg,C组 2.2 各组肺动脉形态及MT比较 与C组比较,P0、P1、P2、P3组均有不同程度的内皮细胞结构紊乱,肺动脉中膜增厚、管腔狭窄;与P3组比较,P1组血管重构程度增强,而P2组血管重构程度减弱,P0组无明显变化。C、P0、P1、P2、P3组MT分别为5.4%±4.8%、20.1%±5.0%、35.1%±9.1%、13.4%±5.3%、18.4%±4.5%,C组 2.3 各组肺组织中miR-19a、VEGF mRNA表达比较 肺组织中miR-19a、VEGF mRNA表达C、P2组 表2 各组肺组织中miR-19a、VEGF mRNA表达比较 注:与C组比较,aP<0.05,bP<0.01;与P3组比较,cP<0.05,dP<0.01。 2.4 各组肺组织中BMPR2蛋白表达比较 C、P0、P1、P2、P3组肺组织中BMPR2蛋白分别为0.96±0.20、0.42±0.13、0.55±0.12、1.1±0.42、0.46±0.07,P0、P1、P3组低于C、P2组(P<0.05或<0.01)。 PAH是先天性心脏病最常见并发症之一,具有高发病率和高病死率的特点,异常血流动力学导致的血管内皮损伤、调节因子失衡是形成先心病肺动脉高压(CHD-PAH)的关键因素[4],但其潜在的分子机制知之甚少,治疗方式局限。近年来,随着对miRNA的深入认识,其已成为PAH的研究热点。本实验采用单侧全肺切除构建肺内高血流状态,用于模拟先天性心脏病异常血流动力学,以探索PAH的发生发展过程并寻找潜在的治疗靶点。 本研究结果显示,在单侧全肺切除制备的PAH模型中miR-19a表达增加,表明miR-19a可能是PAH形成的重要调节因子,与陈伟丹等[5]的研究结果相符合。本实验将携带过载miR-19a、封闭miR-19a、空载miR-19a序列的AAV质粒通过呼吸道转染至PAH大鼠肺组织中,结果显示各组miR-19a表达出现明显差异;转染过载miR-19a后PAH大鼠mPAP、MT增加且肺血管重构加重,而转染封闭miR-19a后则出现相反的结果。这提示miR-19a对肺血管重构起重要调节作用,可能是miR-19a影响了血管平滑肌细胞、内皮细胞的增殖。 BMPR2蛋白是BMP信号通路的膜受体,与其配体结合后实现细胞内信号传导[6],可调控肺动脉平滑肌细胞内效应蛋白的合成[7],抑制平滑肌细胞等增殖,维持血管内稳态[8]。研究发现,诱导肺内皮细胞中miR-17-92的表达上调,能够明显减少BMPR2蛋白表达,导致BMP信号通路受损[9,10]。由于miR-19a是miR-17-92基因簇的一员,查询基因库后发现BMPR2基因序列3′UTR端能与miR-19a的碱基序列互补,因此推测miR-19a能调控BMPR2的表达。本研究结果显示,封闭miR-19a后PAH大鼠肺组织中BMPR2蛋白表达增加、MT降低。这表明封闭miR-19a可以促进BMPR2蛋白表达,并且激活BMP信号通路,抑制平滑肌细胞增殖能力,从而改善肺血管重构,降低mPAP。而转染过载miR-19a后,PAH大鼠肺组织中BMPR2蛋白表达降低,mPAP、MT升高;但与空载miR-19a大鼠比较,并未观察到BMPR2蛋白进一步下降。这可能与BMPR2蛋白表达和生物活性与蛋白泛素化、溶酶体酶降解以及受多种miRNA调控等因素有关[11~13],其机制还需进一步研究。 VEGF是一种强效促血管生成因子,而miR-17-92簇可增强VEGF促进内皮增殖、新生血管形成[3]。本研究结果显示,过载miR-19a后PAH大鼠肺组织中VEGF mRNA表达升高、肺血管重建明显,而封闭miR-19a后结果则相反。这表明miR-19a可调节VEGF表达影响血管内皮细胞的增殖活性,但VEGF引起细胞反应受多种因素的影响[14,15]。有研究表明,平滑肌细胞的增殖效应也可促进VEGF在自身中的表达,进而加重血管重构[16]。本实验结果显示,当BMPR2表达降低时,VEGF mRNA表达量上升,两者具有相反的趋势。由此我们推断,BMPR2表达减少后所导致的平滑肌细胞增殖,可能一定程度激活了VEGF表达,促进血管重构,从而增加了肺血管阻力。 综上所述,miR-19a能通过负性调控BMPR2的表达,影响肺动脉平滑肌的增殖及凋亡,同时又能调控VEGF,促使血管内皮细胞的增殖,而BMPR2又与VEGF间可能存在相互作用的关系,在PAH形成过程中起关键作用,为CHD-PAH的临床研究及治疗提供了新的靶点。
3 讨论
