紫苏PfPDAT1基因序列及表达特性分析
2018-12-04周雅莉安茜任文燕李璐赵静王计平
周雅莉,安茜,任文燕,李璐,赵静,王计平
(山西农业大学 农学院,山西 太谷 030801)
紫苏(Perillafrutescens(L.) Britt.),是唇形科紫苏属一年生草本植物[1],主要分布在中国、尼泊尔、韩国和越南等东南亚国家,且中国已有2000多年的栽培历史[2]。紫苏作为一种多用途的经济作物,是卫生部首批颁布的既是药品又是食品的60种“药食同源”作物之一[3],近年来倍受国内外关注。紫苏籽出油率高达45%~55%,不饱和脂肪酸含量丰富,占总含油量的90%以上,其中以人体必需脂肪酸(α-亚麻酸)含量最高,可作为食用油中不饱和脂肪酸的重要来源[4]。
三酰甘油(triacylglycerol, TAG)是紫苏等油料作物种子油的重要组成成分,在种子发育过程中大量积累。通常人们认为植物种子油脂合成过程中TAG的合成有两种途径:一种是依赖脂酰-CoA的Kennedy途径[5];另一种是不依赖于脂酰-CoA的合成途径(即PDAT途径)。磷脂:二酰甘油酰基转移酶(PDAT)是催化TAG合成最后一步酰基化反应的关键酶,该酶以磷脂为酰基供体,以二酰甘油(DAG)为受体,将磷脂酰胆碱Sn-2位的酰基转移到DAG 的Sn-3位上,产生TAG和溶血磷脂酰胆碱[6,7]。PDAT途径最早发现于酿酒酵母,且被认为是酵母对数生长时TAG合成的主要途径[7]。已有研究表明,PDAT基因是调节植物种子油脂合成积累的关键酶基因[5~8],该基因催化形成的TAG中,Sn-3位多为不饱和脂肪酸,尤其是亚麻酸[9],不饱和脂肪酸的含量与植物抗逆性密切相关,那么PDAT基因除了调控植物种子油脂代谢之外,是否参与植物对逆境胁迫的响应,目前研究甚少。本试验从紫苏转录组数据库中筛选获得PDAT1基因全长cDNA序列,分析其序列特征及编码蛋白结构,并对紫苏不同组织及干旱、高盐、低温等逆境胁迫下该基因的表达特性进行了分析,为深入研究PDAT基因在紫苏生长发育过程中的重要作用提供理论依据。
1 材料与方法
1.1 试验材料
供试紫苏品种为山西省农科院棉花研究所提供的‘晋苏1号’。
1.2 试验方法
1.2.1 试验材料处理
筛选籽粒饱满的‘晋苏1号’种子置于灭菌后的10 mL离心管中,先用蒸馏水冲洗,然后加入0.01% 的升汞消毒8 min,无菌水洗涤3~5次,将种子播种于铺有灭菌滤纸的培养皿中,置于恒温光照培养箱(25 ℃)中培养。待紫苏种子长出侧根后转至1/2 MS液体培养基中,幼苗第4片真叶长出后选取长势较为一致且生长健壮的幼苗进行逆境胁迫处理,每5株幼苗作为一组处理,每个处理重复3次,以不作胁迫处理的幼苗作为对照。
根据李璐[6]研究结果表明,PEG、NaCl胁迫处理6 h 时紫苏幼苗抗逆性状有明显差异,所以本试验选择 6 h 作为最佳处理时间。PEG模拟干旱处理:将幼苗根部分别在15%、20%和25%的PEG6000溶液中浸泡6 h;NaCl处理:将紫苏幼苗根部分别在50 mmol·L-1、100 mmol·L-1和150 mmol·L-1的NaCl溶液中浸泡6 h;低温处理:将幼苗分别置于4 ℃光照培养箱3 h、6 h与9 h。处理后取幼苗第4片真叶在液氮中速冻,存于-80 ℃冰箱保存备用。
分别在紫苏不同发育时期从大田取回根、茎、叶、花、种子等试验材料,液氮速冻后,-80 ℃保存备用。
利用TRNzol RNA提取试剂盒提取‘晋苏1号’不同器官及不同逆境胁迫处理后叶片的总RNA,反转录为cDNA,稀释至100 ng·μL-1保存备用。所用试剂盒购买自天根生化科技(北京)有限公司。
1.2.2 引物设计
应用Primer Premier 5软件设计荧光定量PCR引物(表1)。

表1 引物信息Table 1 Primer information
1.2.3PfPDAT1基因生物信息学分析
从高通量测序获得的紫苏转录组数据库中筛选获得PfPDAT1基因的cDNA序列,通过BLAST(http: //blast.ncbi.nlm.nih.gov/Blast.cgi)进行同源序列比对后,运用在线分析软件对该基因进行生物信息学分析。利用在线软件ProtParam(http://web.expasy.org/protparam/)对紫苏PfPDAT1蛋白质的基本理化性质进行分析;利用PSORT II(http://psort.hgc.jp/form2.html)和NCBI-CDD(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对PfPDAT1蛋白进行亚细胞定位、功能结构域预测;通过SOPMA(http://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对PfPDAT1蛋白进行二级结构的预测;采用SWISS-MODEL(http://swissmodel.expasy.org/)在线软件对PfPDAT1蛋白进行三维结构分析与建模。运用MEGA7多序列比对软件对紫苏PfPDAT1蛋白与其它多种高等植物氨基酸序列进行比对,并构建系统进化树。
1.2.4PfPDAT1基因的表达特性分析
以18SrRNA作为内参基因[10],用于基因表达特性分析,应用CFX96TMOptics Module(BIO-RAD)荧光定量分析仪进行PCR扩增。荧光定量PCR反应体系(10 μL):cDNA模板1 μL、2×SYBR Premix EX TaqⅡ(Tli RnaseH Plus) 5 μL、10 μmol·L-1PfPDAT1-F 0.4 μL、10 μmol·L-1PfPDAT1-R 0.4 μL、50×ROX Reference 0.2 μL、dd H2O 3 μL。扩增程序为:95 ℃ 3 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 20 s,30次循环;65 ℃ 1 min,95 ℃ 15 s。每个样品进行3次生物学重复和3次技术重复。
2 结果与分析
2.1 PfPDAT1基因的序列特征
紫苏PfPDAT1基因cDNA全长序列为2 097 bp,其中包括1 554 bp开放阅读框,编码517个氨基酸残基(图1)。推测的蛋白分子式为C2536H3893N685O757S26,相对分子量为56.9235 kDa,其理论等电点pI为5.45,不稳定系数为33.52,理论半衰期为30 h,说明紫苏PfPDAT1基因编码的蛋白质为稳定蛋白质。脂溶系数为74.95,亲水性系数为-0.276,预测该蛋白为亲水性蛋白质。PSORT II数据库亚细胞定位结果显示,紫苏PfPDAT1被定位于细胞质的可信度达69.6%,可判断其为膜内蛋白,且定位于细胞质中。

图1 PfPDAT1基因全长cDNA序列及翻译氨基酸序列Fig.1 Full-length of cDNA and deduced amino acid sequences of PfPDAT1 gene注: 下划线 ATG 为起始密码子;TAA 为终止密码子;方框为保守的 PfPDAT 1结构域。Note: ATG (Start codon) and TAA (stop codon) are shown in underline; boxes delineate the conserved domain of PfPDAT1.
应用SOPMA软件预测的PfPDAT1二级结构显示:PfPDAT1具有35.98 % α-螺旋,5.61 % β-转角,16.05 %延伸链和42.36 %无规则卷曲。其三维结构如图2所示与二级结构分析结果相似,紫苏PfPDAT1蛋白主要由α-螺旋与无规则卷曲组成,而β-转角与延伸链则分散于整个蛋白质中。通过NCBI数据库对该基因进行功能结构域预测结果表明,PfPDAT1全长序列符合PLN02517 super family(phosphatidylcholine-sterol O-acyltransferase)超家族特征,PLN02517属于磷脂酰胆碱酰基转移酶超家族,据此预测PfPDAT1具有酰基转移功能。

图2 紫苏PfPDAT1蛋白三维结构预测Fig.2 Tertiary structure of PfPDAT1 protein注:蓝色螺旋表示C端;红色螺旋表示N端。Note: Blue represents the C-terminal helix;red represents the N-terminal helix.
2.2 紫苏PfPDAT1蛋白的系统进化树
利用Clustal X软件进行多序列比对,结果发现紫苏PfPDAT1的氨基酸序列在系统进化上与其他物种具有高度同源性,说明已经从紫苏转录组数据库中获得PfPDAT1基因cDNA片段。使用MEGA7软件,构建紫苏与其他几种植物PDAT1蛋白的系统进化树。由如图3可见:紫苏PfPDAT1与芝麻的亲缘关系最近,聚在同一个亚组中;与油橄榄、麻风树和毛果杨相距较近,与拟南芥相距较远。

图3 紫苏PfPDAT1与不同物种PDAT1蛋白的系统进化树分析Fig.3 Phylogenetic analysis of PfPDAT1 and other PDAT1 proteins from different species
2.3 PfPDAT1基因在不同组织中的表达特性
由图4可知,PfPDAT1基因在紫苏根、茎、叶、花及种子中均有表达,但不同组织中表达量存在差异,其中在根系中表达量最低,而在种子中表达量相对较高,约是根系的3.2倍。推测紫苏PfPDAT1基因在不同组织器官中的功能不同。

图4 ‘晋苏1号’不同组织中PfPDAT1表达特性分析Fig.4 Relative expression level of PfPDAT1 gene in different organs of ‘Jinsu 1’ 注:a、b、c、d和e代表在0.05水平方差分析差异显著性。Note:a、b、c、d and e indicate significant difference at 0.05 level.
2.4 PfPDAT1基因在不同逆境条件下的表达特性
干旱、高盐、低温作为主要的非生物胁迫,严重影响植物的生长发育。为研究PfPDAT1对逆境胁迫的反应,经PEG、NaCl和低温处理紫苏幼苗后,采用实时荧光定量PCR检测紫苏PfPDAT1的相对表达量。由图5 A可知,在不同浓度PEG6000处理下PfPDAT1表达量都有所提高,总体呈现先升高后下降的趋势,且在PEG6000浓度为20% 时表达量最高;在不同浓度NaCl条件下PfPDAT1表达量都明显提高,且在100 mmol·L-1时表达量最高(图5B);低温胁迫处理下PfPDAT1基因表达量都增加,呈现先升高后降低的趋势,且在低温处理6 h时表达量最高(图5C)。这些结果充分表明,干旱、高盐和低温处理能够显著诱导紫苏PfPDAT1基因的表达。
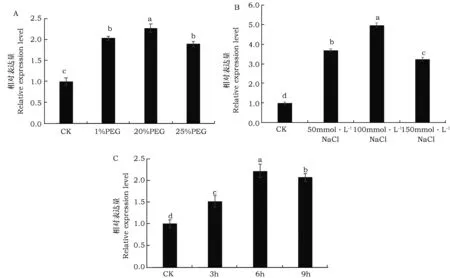
图5 PfPDAT1基因在不同逆境条件下的表达特性分析Fig.5 Relative expression level of PfPDAT1 gene under different stresses注:A:PEG胁迫下PfPDAT1基因的相对表达量;B:盐胁迫下PfPDAT1基因的相对表达量;C:4 ℃低温胁迫下PfPDAT1基因的相对表达量。a、b、c和d代表在0.05水平方差分析差异显著性。Note: A:Relative expression level of PfPDAT1 under drought stress;B:Relative expression level of PfPDAT1 under salt stress;C:Relative expression level of PfPDAT1 under chilling stress. a, b, c and d indicates significant difference at 0.05 level.
3 讨论与结论
甘油三酯(triaeylglyeerols,TAG)是动、植物体内最主要的油脂贮藏形式,植物种子中TAG的合成和积累是一个十分复杂的生理过程。研究表明DGAT和PDAT是影响种子中TAG合成两条途径最后一步酰基化反应的关键酶,对于调控种子油脂合成发挥重要作用[11]。有研究证实,DGAT和PDAT对于TAG的合成作用可能相互交叠[9~12]。在TAG不依赖于酰基-CoA的合成途径中,磷脂:二酰甘油酰基转移酶(phospholipid diacylglycerol acyltransferase,PDAT)被认为是TAG合成的限速酶[8]。为了更好地了解PDAT酶在紫苏生长发育过程中的重要作用,本研究对紫苏PfPDAT1基因进行了详细分析,获得PfPDAT1基因的cDNA序列,其全长为2 097 bp,共编码517个氨基酸残基;结构域分析表明紫苏PfPDAT1具有明显的植物PDAT结构特征,并具有PDAT酶活性;多序列比对分析发现紫苏PfPDAT1蛋白与芝麻、油橄榄、麻风树、毛果杨等植物的同源序列具有高度一致性,同源性最高达到89%,说明PDAT1基因具有高度保守性。
DGAT或PDAT基因过表达对植物种子中油脂合成具有重要调控作用。研究发现,当DGAT1基因发生突变后,拟南芥种子中经过PDAT1途径合成的TAG含量仅为野生型的70%,且该基因催化产生的TAG中不饱和脂肪酸含量较多[9]。Sandager[13]等人发现,酵母DGAT发生突变时,TAG含量相比野生型下降50%,而当PDAT和DGAT均发生突变时,TAG仅为野生型的1%。另外,拟南芥PDAT或DGAT1过表达的种子中TAG含量相比野生型均无明显变化[14]。本研究对‘晋苏1号’不同组织中PfPDAT1基因的表达特性进行了分析,结果表明,PfPDAT1在‘晋苏1号’的根、茎、叶、花和种子中均有表达,但不同组织中其表达量存在差异,PfPDAT1在根系中表达量最低,而种子中表达量最高,表明该基因在紫苏种子发育过程中起重要作用。
植物抗逆性与膜脂内不饱和脂肪酸含量呈正相关[6,15]。在许多植物中,盐和干旱胁迫导致多不饱和脂肪酸减少[16]。Fan等研究发现脂肪酸通过PDAT、三酰甘油脂肪酶和油脂等发生氧化反应生成甘油三酯(TAG),从而维持植物体内膜脂的动态平衡[17]。Pan等对绿衣衣藻的研究表明PDAT具有酰基转移酶和脂肪酶2种活性,胁迫条件下,通过PDAT基因的过表达作用,TAG含量明显提高,从而缓解逆境胁迫对细胞的伤害[18]。本研究分析了‘晋苏1号’不同逆境胁迫下PfPDAT1基因的表达特性,结果表明,不同逆境胁迫处理下PfPDAT1基因的表达量都有所增加,且呈现先升高后下降的趋势,其中在100 mmol·L-1NaCl、20% PEG6000和4 ℃处理6 h时PfPDAT1基因表达量最高。推测PfPDAT1基因参与紫苏应答非生物胁迫的过程,该研究结果为探究紫苏PfPDAT1在抵御逆境胁迫中的作用提供理论支撑。
