稳定同位素标记多肽的合成及应用
2018-12-04徐仲杰
孙 雯,徐仲杰,罗 勇
(1.上海化工研究院有限公司,上海 200062;2.国家同位素工程技术研究中心 上海分中心,上海 200062)
稳定同位素(2H、13C、15N和18O)标记多肽及蛋白质,作为定量蛋白质组学中的“化学标签”,普遍应用于生物样品的检测及示踪等领域。蛋白质组学的定量分析方法主要利用高分辨率质谱,将同位素标记和非标记多肽离子或者肽段离子分开,利用其检测信号的强度值进行定量计算[1]。合成稳定同位素标记多肽的主要方法有生物合成法和化学合成法,其中生物合成法是在动物、植物、酶或者微生物生理代谢过程中对目标位点进行标记;化学合成法根据常规的化学反应原理,通过使用稳定同位素标记的常规试剂代替非标记的基础试剂,利用化学合成的方法制备标记目标化合物[2]。
目前,随着质谱技术的不断发展,基于质谱技术的定量检测方法逐渐发展成为生物分子量化关系研究的主流,其中同位素稀释质谱法利用其定量的优势在生物分子定量检测中得到广泛应用[3]。同位素稀释质谱法通常采用富含某种重质同位素如2H、13C、15N和18O的试剂标记待测肽段内标物,由于内标肽段与待测肽段的质量数存在差异,因此在采用质谱进行测试时其谱图上显示为质荷比不同的两个峰,两个峰的间距由内标物被标记重质同位素的个数决定[4]。由于同位素稀释质谱法中使用的稳定同位素标记内标化合物与待检测的内源性生物分子结构、理化性质几乎完全相同,其色谱、质谱行为也相同,因此可以有效消除基质干扰及样品前处理过程对检测回收率的影响,是一种准确、可靠的定量方法。基于生物样品检测的同位素稀释质谱技术大多采用液相色谱-质谱联用的方法,该方法充分结合了高效液相色谱的高选择性和质谱的高灵敏度,在对稳定同位素标记多肽进行测定时无需衍生化,检测流程简单[5]。但稳定同位素标记的多肽类内标化合物合成困难,使其应用受到限制。本文结合近期国内外研究成果,对稳定同位素标记多肽的合成和应用进行综述。
1 稳定同位素标记多肽的合成
1.1 生物合成法
1.1.1细胞代谢标记法 Oda等[6]在1999年最早采用细胞代谢标记多肽的方法,在大于96%15N丰度的环境中,辅助以半乳糖,在30 ℃条件下采用摇床培养酵母菌,获得了15N标记的多肽,并且利用质谱中标记多肽和非标记多肽的质量比例准确测定了蛋白含量。此后,其他实验室也采用类似方法用其他的细胞进行标记多肽的制备及检测,如Conrads等[7]选择的耐辐射球菌和老鼠B16黑色素瘤细胞,Lanquar等[8]选择的阿拉伯芥细胞,Pan等[9]选择的沼泽红假单胞菌等。最为特别的是Ong等[10]采用13CD3-蛋氨酸为标记试剂,先转化为13CD3-S-腺苷基甲硫氨酸,将其作为同位素的提供者,定量鉴定了59种甲基化蛋白。Phillip等[11]采用13C标记的L-赖氨酸和L-精氨酸为碳源,喂养仓鼠卵巢细胞,获得13C 标记的人体免疫球蛋白(hIgG1),其中13C标记的L-赖氨酸和L-精氨酸片段的丰度高于99%。Zinn等[12]采用13C6-亮氨酸和13C6,15N4-精氨酸为原料,制备得到13C6,15N4标记的多肽。Vidovic等[13]采用15NH4Cl为碳源喂养埃希氏杆菌,制备得到标记15N多肽,该制备方法产率高、易纯化。Liang等[14]采用亮氨酸-D3为原料,培养HEK 293T细胞,获得标记多肽。Jia等[15]采用15N标记的Leu、Arg、Asp、Asn、Tyr和His等为原料,利用无细胞蛋白质生物合成法制备得到了15N标记多肽。李舒伟等[16]公布了一种通过、快速和可扩展的方式来产生用于定量的标记肽段的方法,将需要合成的肽段与strep-tag(WSHPQFEK)整合,利用无细胞的蛋白合成系统合成,经过strep-tag的亲和富集以及完全酶解后得到标记的目标肽段。
1.1.2高等真核生物标记法 2003年Albert Heck实验室[17]制备了两种15N标记的有机体,秀丽隐杆线虫和黑腹果蝇。线虫用15N标记的大肠杆菌喂养,果蝇幼虫用15N标记的酵母菌喂养。秀丽隐杆线虫和黑腹果蝇的15N同位素丰度≥95%,可以用于蛋白的定量研究。2004年John Yates 实验室[18]公布了一种获得15N标记的小鼠肝脏蛋白方法,通过给小鼠喂养辅以高丰度的15N藻类且无蛋白的食物,经代谢后获得标记肝脏蛋白,并将其作为内标使用。Mylne等[19]采用给白花蛇舌草喂养0.026% (15NH4)2SO4和0.026% K15NO3,得到15N 标记的环肽化合物。Foldynová-Trantírková等[20]采用99.8%丰度的15N标记缬氨酸喂养蜥蜴利什曼原虫,廉价高效地得到了15N标记多肽。
1.1.3酶催化标记法 利用酶解反应在多肽末端羧基上标记18O同位素是常用的方法。Desiderio等[21]采用蛋氨酸脑啡肽和亮氨酸脑啡肽的五肽原料,在甲醇氯化氢和18O的体系中,于37 ℃下反应一定时间得到18O标记的蛋氨酸脑啡肽、亮氨酸脑啡肽以及两者的酯化产物。Kristiansen等[22]采用胰蛋白酶在H218O条件下,水解膜组织获得赖氨酸和精氨酸末端羧基被18O取代的多肽,用于诊断胆管癌。Fenselau等[23]采用丝氨酸蛋白酶做催化剂在 H218O条件下水解,得到18O标记多肽。Bantscheff[24]和Miyagi[25]通过酶水解裂分也制备得到了18O标记的多肽。18O同位素不仅可以通过酶水解加入还可以通过裂解后掺入。因此,蛋白质可以在普通的环境中先消化,得到肽的干混合物后H218O才会被加入[26]。Carreira等[27]以H218O为原料,采用微波法制备18O标记的多肽,提高了反应效率,反应时间从12~48 h缩短为30 min。李楠楠等[28]利用酶切产生的肽段溶液经冷冻干燥后加入H218O复溶,同时加入质量是底物1%的胰蛋白酶(H218O溶解)及最终质量浓度为1 g/L的RapigestTM SF。于微波条件下反应5 min,冷却至室温,循环30 min,得到18O同位素标记定量肽段。钱小红等[29]采用18O化学标记与酶切入位点标记相结合的方法,发明了一种利用稳定同位素18O标记蛋白质组进行双重定量的新方法,该方法在N端肽段及C端肽段全部标记的基础上,实现采用两种18O稳定同位素标记同一样本。
1.2 化学合成法
1.2.1乙酰化标记 乙酰化作用或氨基的乙酰化反应标记方法简单、有效。例如Ji等[30]采用3倍量的N-乙酰氧基-D3-丁二酰亚胺和1 g/L多肽在pH=7.5的磷酸盐缓冲溶液中室温反应4~5 h,经反相色谱分离后,得到了乙酰化-D3标记的多肽。合成路线图示于图1。

图1 乙酰化标记氨基酸路线图Fig.1 The synthesis route of acetylation labeling peptides
Zhang等[31]采用固定化的糖肽和丁二酰酸酐-D4反应制备得到乙酰化糖肽-D4。Hsu等[32]利用还原胺化的原理,以裸露氨基的多肽为原料和氘代甲醛-D2反应后,再经氰基硼氢化钠还原得到二甲基-D4标记的多肽,合成路线图示于图2。
Boersema等[33]采用CD2O ,13CD2O为原料,二甲基化反应标记多肽,用于细胞和组织裂解物的研究。Raijmakers等[34]采用氘代甲醛为氘源,磷酸盐为缓冲溶液,自动连续地制备标记多肽。
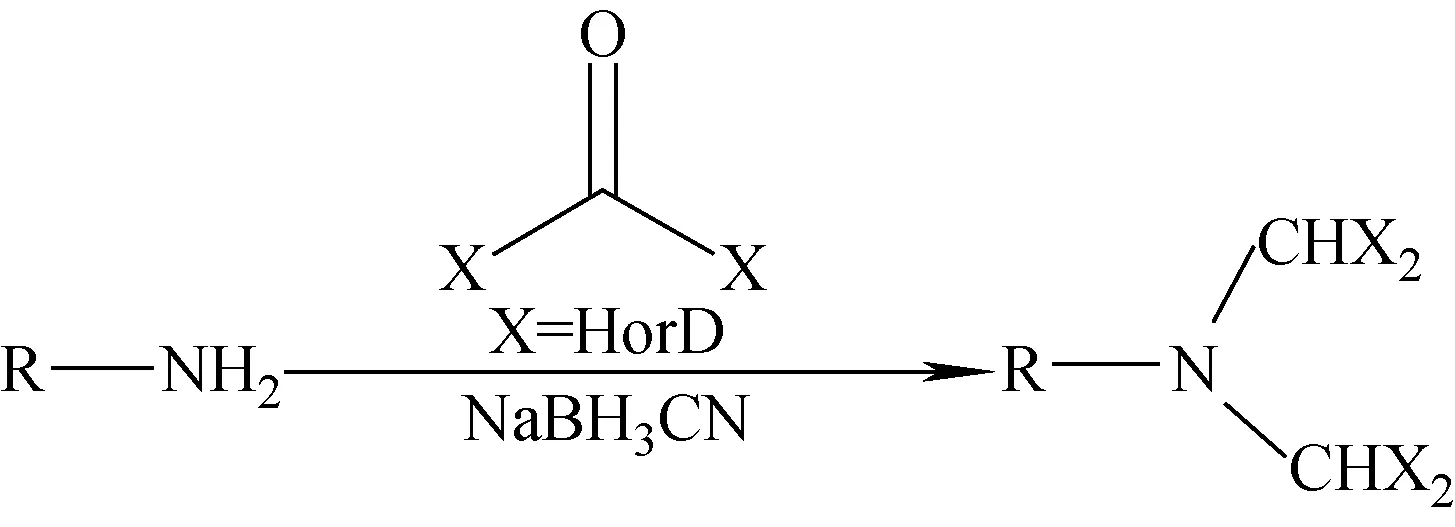
图2 二甲基-D4标记多肽合成路线图Fig.2 The synthesis route of dimethylation labeling peptides
1.2.2标记氨基酸缩合法 标记氨基酸缩合法采用稳定同位素D、13C、18O或15N标记的氨基酸为基础原料,使用高效缩合剂与其他标记或非标记的氨基酸通过化学反应的方法合成稳定同位素标记多肽。
Breitung等[35]以13C/15N标记的Fmoc-苯丙氨酸为原料,以wang树脂为基体,羧基以苯甲基-2-磺酰三硝基三氮唑(MSNT)为活化试剂,利用二异丙基碳二亚胺/1-羟基苯并三唑(DIC/HOBt)作为缩合剂,采用固态合成的方法[36-38],逐步和13C/15N标记的Fmoc-Leu-OH、Fmoc-Met-OH反应后制备得到标记的NH2-Met-Leu-Phe-OH;还可以进一步与甲酸乙酯反应得到13C/15N标记的甲酰基-Met-Leu-Phe-OH[39],反应过程中可以采用克莱恩氏试验法保证产物的转化率[40-41]。Dietz等[42]报道了一种简便的氘标记丝氨酸二肽油脂合成方法,采用1-溴丁烷-D9为起始原料,经过格氏反应、烷基化、水解等10步反应制备得到丝氨酸二肽油脂-D9。Pedersen等[43]采用氘代三乙胺和Pd(0)为氘源,得到酪氨酸-D4,进而得到碘代-酪氨酸-D4-血管紧张肽(十肽)。Harris等[44]采用易于得到的二苄基保护[1,2,3,4,5-13C5, 2-15N1]-L-谷氨酸为起始原料,采用HBTU作为缩合剂,经过三步反应,高效地制备得到稳定同位素标记甘-脯-谷(GPE)三肽。Ghomashchi等[45]采用[1-13C, 2-13C, 3-13C,15N]-半胱氨酸、Fmoc-甘氨酸、wang树脂等为原料,1-羟基苯并三唑(HOBt)、O-苯并三氮唑-N,N,N′,N′-四甲基脲四氟硼酸(TBTU)为缩合剂,室温固相合成了[1-13C, 2-13C, 3-13C,15N]-半胱氨酸-谷胱甘肽。Voronin等[46]采用13C6,15N标记的亮氨酸为标记原料,采用CEM多肽合成仪,微波条件下高效合成了VVSV{L}TVLHQDWLNGK十六肽,具体结构示于图3。
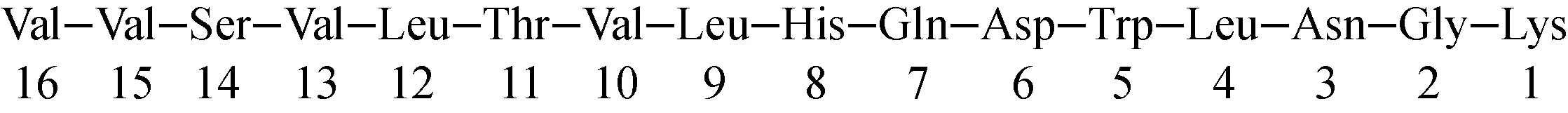
图3 标记合成16肽结构图
Fig.3 The chemical structure of labeling peptides
张亮等[47]介绍了一种稳定同位素15N标记八肽的合成方法,该方法采用固相合成,以Wang树脂为载体、Fmoc保护的15N标记氨基酸为前体,逐步合成,粗品经剪切、纯化后制得稳定同位素15N标记八肽,化学纯度大于99%,同位素丰度大于97%;徐仲杰等[48]在专利中保护了一种稳定同位素标记α-乳白蛋白特征肽段(VGINYWLAHK)的合成方法,采用液相法进行合成,前体为标记缬氨酸,和经Fmoc保护的非标记或者标记甘氨酸、异亮氨酸、天冬酰胺等氨基酸进行缩合、脱保护等一系列反应,得到稳定同位素标记的目标肽段,产品化学纯度及同位素丰度均大于99%。在合成中不仅要考虑纯度和收率,还要考虑工艺过程对目标产物丰度的影响。
稳定同位素标记试剂的丰度是决定试剂合成成败的关键,要充分考虑合成试剂、反应条件、环境因素等的影响,根据目标产物的定位标记选择合适的同位素原料以及合成路线。生物合成法制备同位素标记多肽,纯度高,不存在旋光异构体,但菌种的专有性强,很难适合不同多肽的合成,菌种的选育周期长;有机合成法制备稳定同位素标记多肽,方法灵活,标记的位置多样,丰度容易控制,但容易产生消旋化合物,需要进行拆分提纯。在同位素标记多肽的制备中要充分考虑应用的需要,选择合适的合成方法。
2 稳定同位素标记多肽的应用
2.1 蛋白质组学定量
2.1.1乳制品检测 稳定同位素标记肽段是同位素稀释质谱法的常用内标试剂,在乳制品的质量控制中发挥了重要作用,如Ke等[49]采用CEV*F*R、NI*CNI*SCDK、LSFNPTQL*EEQCHI*(V*Val-OH-13C5,15N,F*Phe-OH-13C9,15N,I*Ile-OH-13C6,15N,L*Leu-OH-13C6,15N)等12种同位素标记多肽做内标,建立了一种同时量化四种酪蛋白和两种主要乳清蛋白的超高效液相色谱-串联三重四极杆质谱分析方法,定量分析了山羊和绵羊奶产品中牛奶和牛乳清粉的掺杂比例,并将该方法成功应用于不同商业品牌的羊乳配方奶粉的测试,结果表明该方法表现出高的专一性和准确性。黄棣华[50]发明公开了一种氨基酸序列为LSQSKVL*PV*PQK的酪蛋白磷酸肽的内标肽,其中L*和V*为碳氮全同位素标记的氨基酸残基。选择酪蛋白磷酸肽中的一种特征肽作为检查目标,对奶制品中酪蛋白磷酸肽进行定量检测,该特征肽在酪蛋白磷酸肽中最具代表性,含量相对稳定,再加入内标肽对结果进行校正,该方法的线性好、回收率高、准确性好。张京顺[51]采用同位素稀释质谱法,同时利用牛胰蛋白酶对总α-乳白蛋白、总牛乳铁蛋白和总β-乳球蛋白进行酶解,并对其特异标签肽进行优化,使其成为具有与待测蛋白本身相近酶解效率、色谱和质谱行为的内标物;通过蛋白与内标肽之间摩尔关系,实现对三种蛋白的准确定量,该方法测试条件下三种蛋白的平均回收率分别为95.8%~100.6%、92.04%~100.67%和92.04%~109.91%;结果表明,建立的方法操作简便、准确度高、重现性及灵敏度好,适用于婴幼儿食品以及乳制品中的总α-乳白蛋白、牛乳铁蛋白和β-乳球蛋白含量的测试。
2.1.2生物蛋白定量 李楠楠等[28]建立了定量肽段串联体蛋白质结合18O标记-多反应监测质谱对蛋白质进行绝对定量的新方法,该方法采用酶促18O同位素标记轻标表达的Qcon CAT蛋白质作为内标,通过对腾冲嗜热厌氧菌中选定的蛋白肽段进行绝对含量测定,发现方法的相对标准偏差<20%,解决了稳定同位素标记细胞培养氨基酸(SILAC)技术中标记试剂价格昂贵的问题,同时也对蛋白质组学绝对定量方法的发展起了推动作用。Kilpatrick等[52]采用同位素稀释质谱建立了准确定量人体血清中C反应蛋白的方法,该方法以15N标记人体C反应蛋白为内标,与商品化的C反应蛋白检测方法相比,更准确地监测人体健康状况。Konopka等[53]基于定量蛋白质组学同位素稀释质谱法以完整的标记蛋白做内标,对16对同位素标记和非标记的肽段进行准确定量,在常用的非标记与标记肽段质量比例计算的基础上,探讨蛋白摩尔比计算方法。Burkitt等[54]将基于肽段的同位素稀释质谱法应用到蛋白质绝对定量研究中,通过使用已知纯度的氨基酸标准物质对肽段的绝对含量进行测定,使蛋白质的测定结果可溯源至国际单位制(SI)。李舒伟等[16]发明了一种应用于蛋白质多反应监测的稳定同位素标记肽段合成及定量方法,通过对已知蛋白的代表性的肽段进行母离子/子离子的选择,在待分析物中加入已知量的同位素标记内标肽段并结合其标准曲线,实现对某个或某些目标蛋白的绝对定量。
2.1.3蛋白测序及药物代谢 Kaiser等[55]采用D7-VHLTPE和 D7-1-deoxyfructosyl-VHLTPE做内标,建立了血红蛋白A1c测序的基础方法,通过与国际临床化学联合会(IFCC)指定方法对比,相对偏差为3.4%,相对扩展不确定度为4.9%,绝对偏差为(0.5~3.9) mmol/mol(0.05%~0.35%)。张丽华等[56]发明了一种基于多肽两端非等重稳定同位素标记的蛋白质氨基酸序列从头测序方法,使用含有同位素标记赖氨酸的培养液实现对蛋白质中赖氨酸的标记,利用高效液相色谱-质谱进行分离和鉴定。刘喜东等[57]采用质谱法以酶切型稳定同位素标记肽段做内标,分别采用在酶解前加入带酶切位点的标记肽段、不带酶切位点的标记肽段及在酶解过程后、质谱检测前加入不带酶切位点的标记肽段进行样品前处理;结果表明,采取第一种方式处理样品可减小蛋白质绝对定量分析的误差,使测定结果更接近真实值,提高了分析结果的重现性。Ong等[58]研究了采用稳定同位素标记细胞培养氨基酸法完全取代13C标记精氨酸,用氘代亮氨酸作为标记物对肌肉组织蛋白质进行代谢标记,对肌肉分化过程中蛋白质的变化进行定量。
2.2 食品过敏原检测
当前,过敏性疾病已成为全球新的问题,据统计,90%左右的食品过敏反应是由花生、乳制品、小麦、海鲜、大豆等8类食物引起,其中花生引起的过敏反应居多,因此对食品过敏原进行筛选并准确定量意义重大。Seppälä等[59]将同位素稀释质谱法应用到梯牧草花粉过敏原的绝对定量中,该研究使用高分辨、高精确质谱,使测定结果的日间变异系数小于5%。Careri等[60]采用液相色谱串联质谱法,以生物标记肽段做内标,用于确定和量化食品中的花生蛋白过敏原Arah2和Arah3/4,在对四种生物标记多肽的选择性进行考察的基础上,优化了花生蛋白过敏原Arah2及Arah3/4色谱、质谱测试条件。同时采用液相色谱-串联三重四极杆质谱法对食品基质米脆和巧克力中的Arah2与Arah3/4进行检测,获得良好的检测限。Newsome等[61]以完整的牛15N-α-S1-casein做内标,在质谱选择反应监测(SRM)模式下对烘焙用材料(包括动植物油、糖、食用胶)中牛奶蛋白进行测试。Weber等[62]利用液相色谱-串联四极杆质谱建立了测定食品基质中酪蛋白的方法,该方法采用同位素标记酪蛋白做内标,以胰蛋白酶消化食品基质提取液,用于检测牛奶过敏原。Shefcheck等[63-64]采用液相色谱串联四级杆质谱,建立了冰淇淋基质中生物标记肽过敏原的检测方法;并将该方法应用于含有不同水平花生蛋白的冰淇淋样品检测中,实验表明,该方法对花生过敏原蛋白Arah1的定量检测限为10 μg/g。同时使用相似方法,通过对巧克力样品前处理技术的改进和样品量的增加使花生蛋白的检出限降低到2 ppm。王洋[65]采用同位素稀释质谱法,以13C5-脯氨酸、13C5-缬氨酸及13C5-苯丙氨酸做内标,对蛋白质过敏原纯品的含量测定方法进行研究,同时验证了采用同位素稀释质谱法测定β-乳球蛋白、β-酪蛋白、乳铁蛋白及溶菌酶纯品蛋白含量的准确性,且其测定结果可溯源到SI。
3 小结
随着同位素稀释质谱技术的不断发展及在蛋白质检测中的广泛应用,稳定同位素标记多肽和蛋白质的研制,将进一步推动多肽的精准定量,同时降低分离难度,有效消除基质干扰,提高测定结果的准确性,该检测方法将有望纳入法规和标准。标记多肽及蛋白质作为内标物质在食品检测、生物蛋白定量、蛋白测序、药物代谢、过敏原检测等领域的广泛应用,将会进一步推动稳定同位素标签技术在新药研发、临床病理、蛋白质组学、食品安全等领域的快速发展。例如在食品过敏原的检测中,基于同位素稀释技术的蛋白质组学方法正被用于广泛替代传统的免疫化学法;而在代谢组学中由于稳定同位素标记示踪技术,能够随时追踪含有同位素标记的多肽在体内或体外位置及数量的变化情况,被广泛应用于临床医学中。因此,针对不同领域的需求开展稳定同位素标记多肽合成技术的研究在未来将大有可为。
