三叶青种质资源遗传多样性的随机扩增多态性DNA分析
2018-12-04尹明华占学林徐文慧谢妮妮陈荣华
尹明华,占学林,徐文慧,谢妮妮,蔡 红,陈荣华
(1.上饶师范学院生命科学学院,江西上饶334001;2.上饶市红日农业开发有限公司,江西上饶334700)
三叶青(Tetrastigma hemsleyanum Diels et Gilg)是中国特有的珍稀药用植物,为葡萄科崖爬藤属植物三叶崖爬藤,分布于中国长江中下游及南方地区海拔300~1 000 m的阴湿地区[1]。《中国植物志》记载三叶崖爬藤全株可供药用,有清热解毒、祛风化痰、活血止痛等功效,可用于治疗毒蛇咬伤、扁桃体炎、淋巴结结核、跌打损伤、小儿高热惊厥等[2]。现代药理研究表明,三叶青具有抗炎、抗氧化、抗肿瘤、抗病毒、镇痛解热、调节免疫等作用,并广泛用于多种中成药或保健品[3]。目前,三叶青的研究报道主要集中于植物学、化学成分、毒理药理学、临床应用、人工栽培、生物技术等方面[4],而三叶青种质资源遗传多样性研究少有报道。袁带秀等[5-6]首次对湘南湘西3个不同产地的三叶青种质资源亲缘关系进行了过氧化酶(POD)和酯酶同工酶检测,结果显示它们是3个独立的物种;朱波等[7]利用 inter-simple sequence repeat(ISSR)分子标记技术对24份种质资源的遗传多样性进行了研究,并将浙江种质全部聚为第Ⅰ类,江西、广西、湖北、湖南等种质聚为第Ⅱ类,湖南怀化与广西钟山种质聚为第Ⅲ类,贵州种质单独聚为第Ⅳ类。该研究样本数量和样本选取地偏少,且分子生物学技术在三叶青遗传多样性中的应用研究还处于起步阶段,应在加强三叶青种质资源收集的基础上继续采用其他DNA分子标记来进行深入研究,以保护我国特有的珍稀药用植物资源。随机扩增多态DNA(random amplified polymorphic DNA,RAPD)技术是由美国科学家 Wiliams和Welsh于1990年分别研究提出的一种基于PCR的分子标记技术[8],可在没有基因组信息且特异性标记较少条件下进行,具有DNA样品用量少、操作简单易行、分析速度快、易检测、实验成本低等优点,目前已在国内外很多物种的分类及遗传多样性分析中被广为应用[9]。三叶青基因组还没有测序,仅有极少数基因克隆,无法大量开发简单重复序列(simple sequence repeats,SSR)、单核苷酸多态性(single nucleotide polymorphism,SNP)和表达序列标签(expressed sequence tags,ESTs)标记,研究起来进展缓慢,而RAPD标记能够在未知序列的情况下快速方便找到差异。目前,我国三叶青种质资源的遗传多样性及亲缘关系的分子标记研究仍不全面,可通过扩大群体数量,增加近缘种和野生种数量来探讨遗传多样性和亲缘关系,以便在品种选育中更好地选择中间材料,减少盲目性。虽然RAPD会产生假阳性,但可通过提高退火温度来保证实验的准确性[10-13]。另外,本课题组的预实验表明,RAPD分子标记在不同三叶青种质中均能获得较高的多态性比率,是理想的多态性筛选、种质资源鉴定的分子标记类型,可以用于三叶青种质资源遗传多样性的分析。因此,本研究拟采用RAPD技术对64份三叶青种质的遗传多样性进行检测,旨在探明三叶青种群的遗传多样性水平,为合理保护三叶青的基因资源及其遗传改良提供科学依据。
1 材料与方法
1.1 材料
64个三叶青样本(表1)采自上饶市红日农业开发有限公司位于怀玉山的三叶青种质资源库和三叶青品种园。
1.2 方法
1.2.1 基因组DNA的提取
采用CTAB法提取样品基因组DNA[14]。
1.2.2 引物筛选与RAPD分析
用40对引物(表2)对4个样品(随机选择样本1、样本24、样本33和样本62)进行PCR扩增,筛选出10对引物进行批量实验[15]。PCR扩增体系(20 μL):2 μL DNA 模板,1 μL 引物,10 μL 2×Taq PCR Mastermix buffer(北京博友顺生物技术有限公司),7 μL去离子水。PCR扩增程序为:94℃ 3 min;94℃ 30 s,36℃ 50 s,72℃ 1.5 min,40个循环;72℃ 10 min,4℃保存。
1.2.3 数据分析
PCR产物用1.0%的琼脂糖凝胶电泳检测。RAPD扩增产物电泳图谱中的每1条带均视为1个分子标记(DL 2 000 DNA marker),代表一个引物的结合位点。按凝胶同一位置上DNA带的有无进行统计,有带(包括弱带)的记为“1”,无带的记为“0”,构成RAPD表型数据矩阵用于分析。采用POPGENE 1.31软件对全部种群和各个单种群分别进行遗传参数分析[16],分别计算观测等位基因数(Na)、有效等位基因数(Ne)、Nei's基因多样性指数(H)、Shannon多样性指数(I)、多态位点和多态百分数(%);利用NTSYS软件计算相似系数(DICE系数),并且按照遗传距离进行UPGMA聚类分析。

表1 三叶青64个样本信息Table 1 Information of 64 Tetrastigma hemsleyanum samples
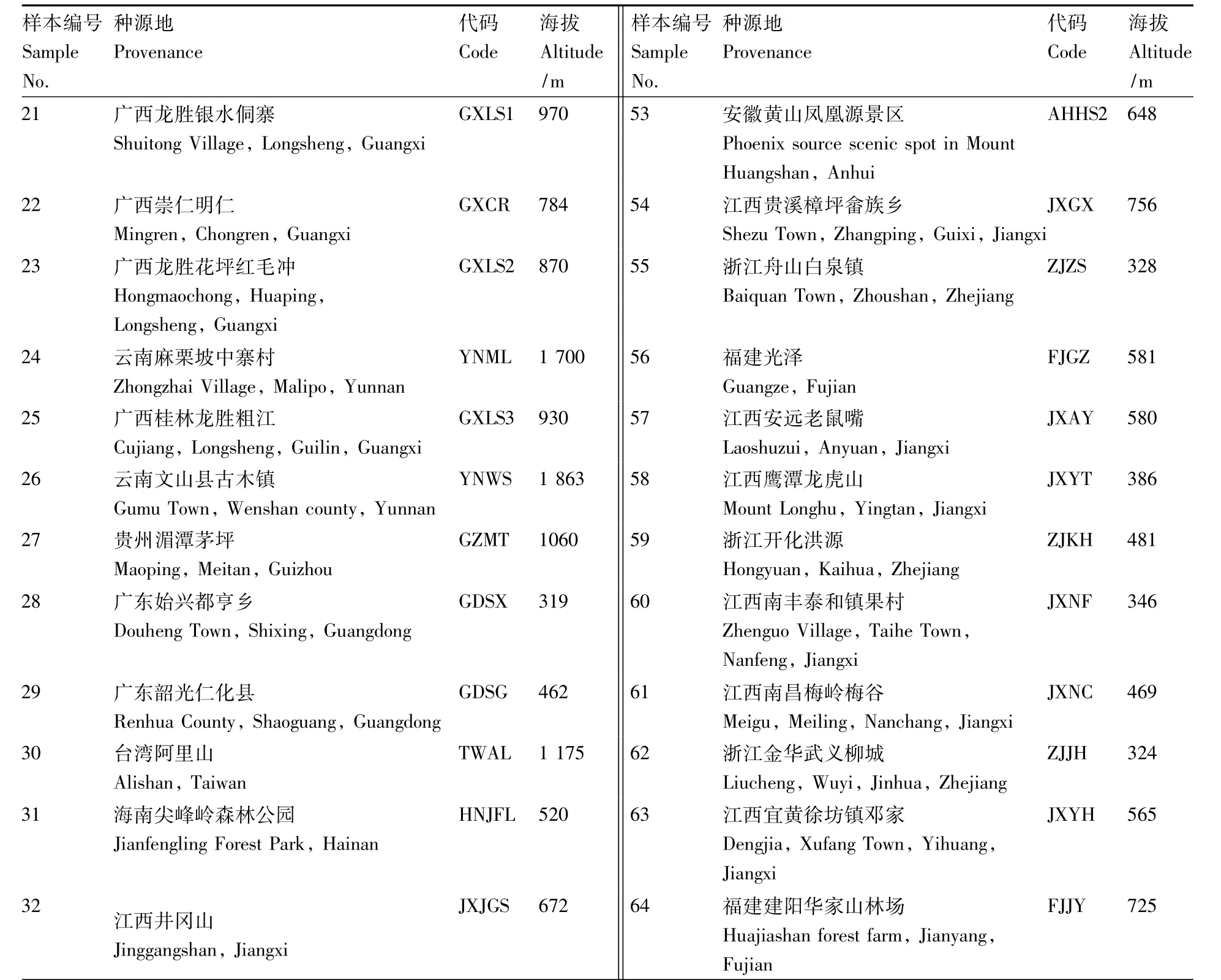
续表1
2 结果与分析
2.1 引物筛选结果
40对RAPD引物的筛选结果见图1,筛选出至少能扩增出2条及以上多态性条带的10对引物进行批量实验。10对引物分别是 HSD1、HSD3、HSD6、HDS9、HSD14、HSD16、S10、S12、S19、S20。
2.2 RAPD引物扩增多态性
利用筛选出的10条引物对64个三叶青DNA样本进行PCR扩增,其中引物P1(HSD1)对64个三叶青样本的PCR扩增产物检测结果见图2,10条引物PCR扩增结果见表3。在64个三叶青样本中共检测到80个DNA位点,平均每条引物扩增出8个DNA位点,有75个多态性位点,多态性位点比率(PPB)为93.75%。10条RAPD引物扩增的DNA位点数为4~11个,多态性位点比率为66.67% ~100%;其中,多态性比率最低的为引物 P3(HSD3),为 66.67%,而引物 P30(S10)扩增出的DNA位点为4,位点数最少,但多态性位点比率最高,达100%。表明10条RAPD引物具有较好的多态性,64个三叶青样本的遗传多样性比较丰富。每条引物平均扩增出8个DNA位点和7.5个多态性位点,扩增产生的DNA片段长度为100~2 000 bp。结果表明,采用不同的RAPD引物对64个三叶青样本进行PCR扩增,扩增出的位点数差异较大,多态性位点的比例差异也较大。
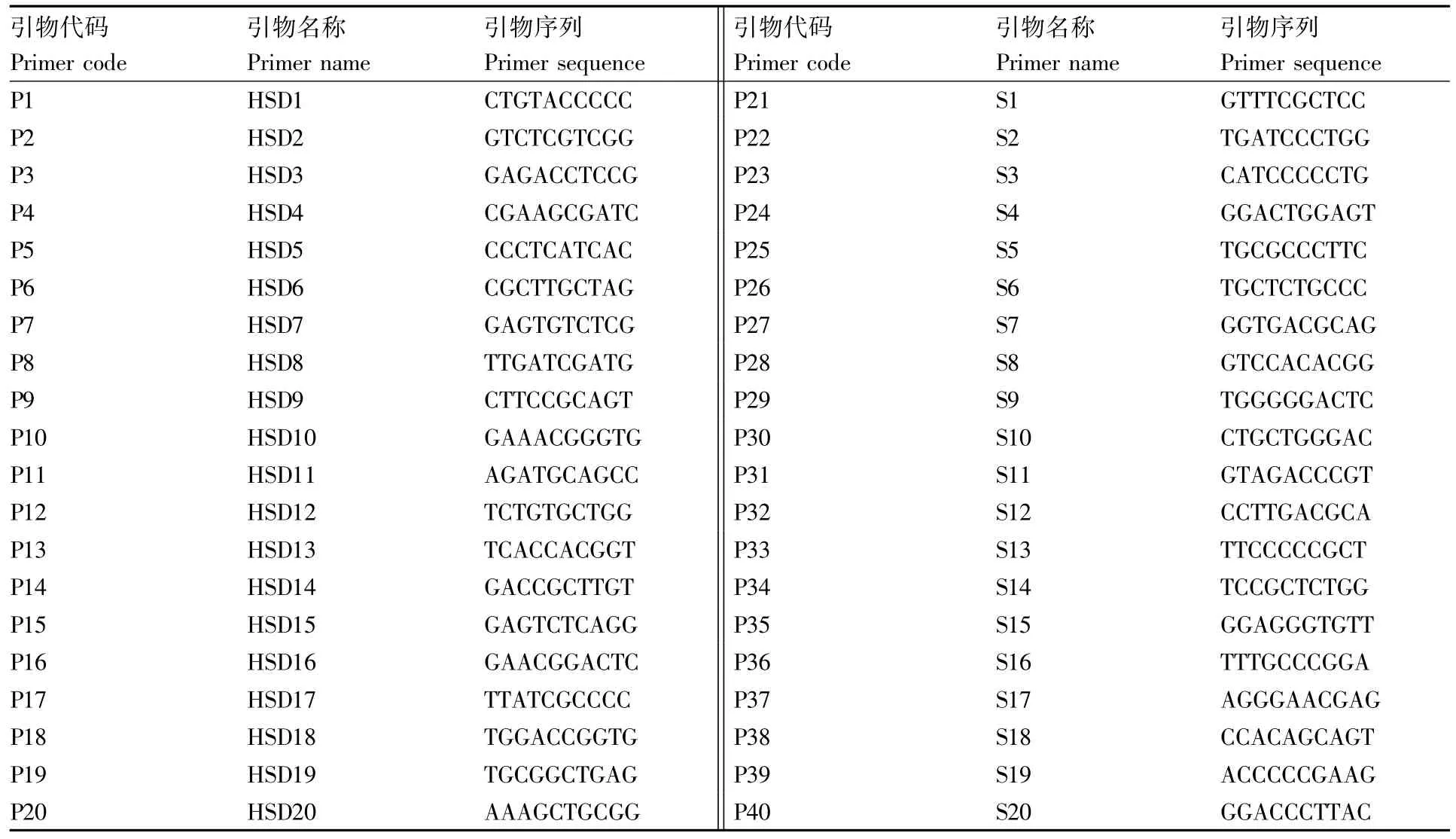
表2 RAPD引物信息Table 2 Information of RAPD primers
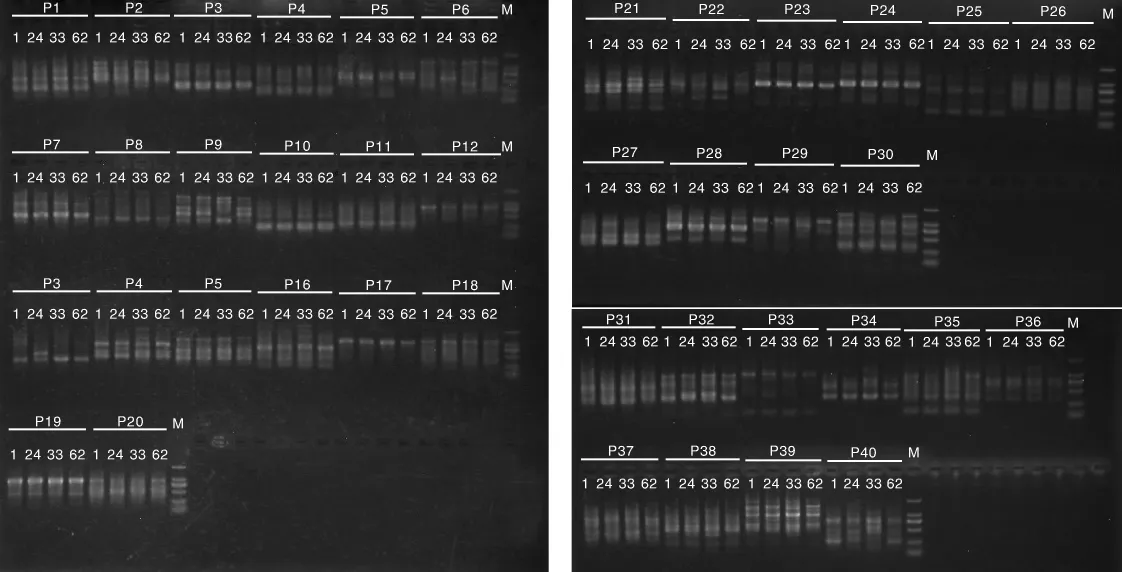
图1 40对RAPD引物的PCR电泳图Fig.1 PCR electrophoresis of 40 RAPD primers
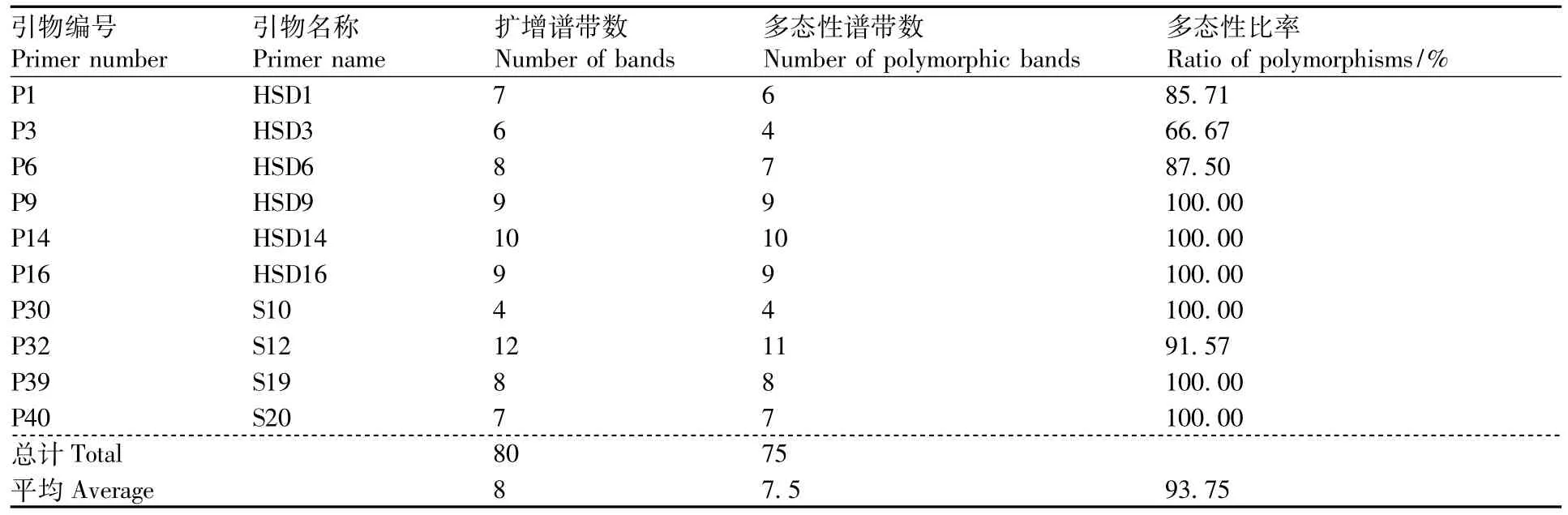
表3 RAPD-PCR扩增的引物及扩增结果Table 3 RAPD primers used for RAPD-PCR amplification and their amplification results
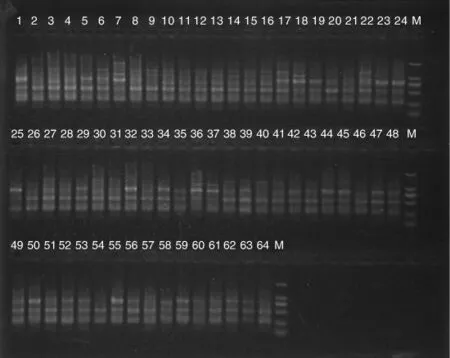
图2 引物P1(HSD1)对64个三叶青样本的PCR扩增产物检测结果Fig.2 Detection results of PCR amplification products of 64 Tetrastigma hemsleyanum samples using P1(HSD1)primer
2.3 三叶青的遗传多样性分析
遗传多样性分析(表4)表明,64个三叶青样本的观测等位基因数(Na)为1.666 7~2.000 0,有效等位基因数(Ne)为1.247 9~1.701 3,Nei's基因多样性指数为0.167 0~0.398 4,Shannon多样性指数(I)为0.262 8~0.583 0,平均多态位点为7.5,平均多态百分数为93.15%。
2.4 三叶青的遗传关系聚类分析
10对引物在64个样品中共获得80条扩增片段。利用NTSYS软件计算样品间的遗传相似系数(GS值),得到供试材料遗传相似矩阵。遗传相似系数越大,表明亲缘关系越近,遗传相似系数越小,亲缘关系越远。根据遗传相似系数矩阵,利用UPGMA法进行聚类分析,得到UPGMA聚类分析图(图3)。
在遗传相似系数0.720 56处,可以将64个三叶青样本分成11大类:第Ⅰ类包括样本1(JXHY1)、29(GDSG)、60(JXNF)、33(JXDX)、52(JXWY)、42(AHHS1)、53(AHHS2)、34(ZJNN)、39(JXYY)、56(FJGZ)、28(GDSX)、51(JXFC);第Ⅱ类包括样本47(FJWYS)、61(JXNC)、54(JXGX)、46(ZJFY)、48(ZJTZ)、49(FJSM)、62(ZJJH)、64(FJJY);第Ⅲ类包括样本 26(YNWS)、27(GZMT)、30(TWAL)、31(HNJFL)、41(JXYS1);第Ⅳ类包括样本 2(HBYZ)、57(JXAY)、35(FJPC)、20(GZHGS)、21(GXLS1)、22(GXCR)、40(JXHY2)、38(ZJNB 1);第Ⅴ类包括样本37(ZJCA)、43(JXYS2);第Ⅵ类包括样本 3(CQZWY)、4(HNJS)、5(HNZJJ1)、6(CQCN)、8(HNYL)、9(CQPS)、13(HBXDS)、14(ZJWZYJ)、10(CQJFS)、15(HNZJJ2)、16(GXLY1)、11(HNFH)、12(SCEMS);第Ⅶ类包括样本19(GXGL)、59(ZJKH)、32(JXJGS)、55(ZJZS)、44(ZJNB2)、45(ZJLIS)、50(ZJNB3)、58(JXYT)、23(GXLS2)、24(YNML);第Ⅷ类包括样本7(HNHH)、18(GXLY2)、25(GXLS3);第Ⅸ类包括样本36(ZJSC);第Ⅹ类包括样本17(GXBS);第Ⅺ类包括样本63(JXYH)。
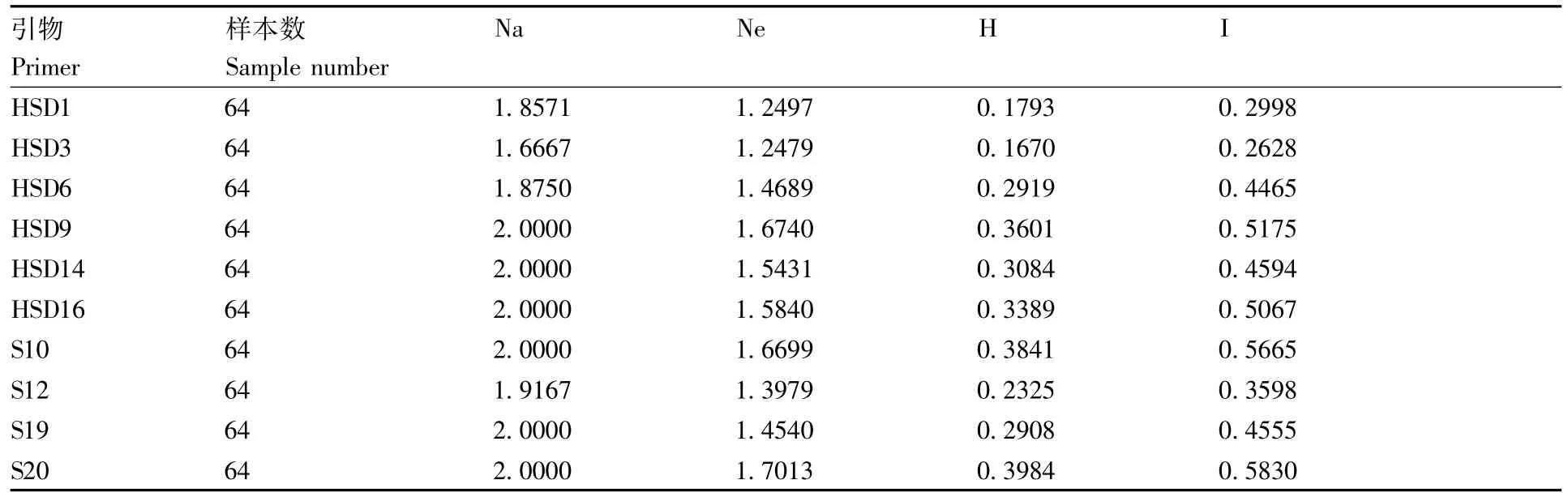
表4 引物的多态性数据统计Table 4 Polymorphic data statistics of primers
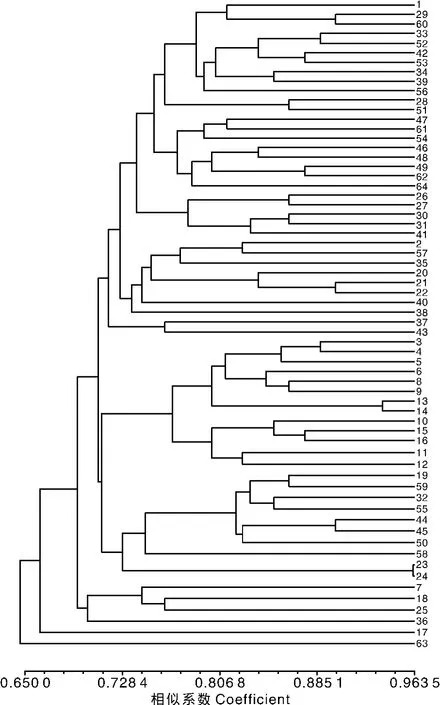
图3 基于RAPD标记的64个三叶青的UPGMA亲缘关系聚类图Fig.3 The UPGMA genetic relationship clustering map of 64 Tetrastigma hemsleyanum samples based on RAPD molecular markers
在遗传相似系数0.697 04处,则可将64个三叶青样本分成4大类:第Ⅰ类包括样本63(JXYH);第Ⅱ类包括样本17(GXBS);第Ⅲ类包括样本7(HNHH)、18(GXLY2)、25(GXLS3)、36(ZJSC);剩下58个样本均属于第Ⅳ类。
3 讨论
三叶青是我国特有的濒危珍稀药用植物,已有多年药用历史,主产于浙江、湖南、江西、福建、广西、重庆、湖北、四川、广东、贵州等地[17]。我国三叶青主要有2个品种:青色藤三叶青(主产于福建、湖南、四川、广东、广西和云南的部分地区,27.3°N以南)和褐紫藤三叶青(主产于江西和浙江山区,27.3°N 以北)[18]。随着越来越多种类和数量的分子标记被开发,分子标记技术在各种植物的分子遗传图谱构建、品种鉴定与纯度分析、重要经济性状相关基因定位以及种质资源多样性分析等领域中应用已十分广泛[19]。王一涵[20]基于双重抑制法开发了8对有多态性的三叶青特异性微卫星引物,基于微卫星数据的STRUCTURE聚类分析结果表明,三叶青群体可划分为4个地理分组,分别对应于中国西南部、中部、东部和南部地区(包括海南)。朱波等[7]利用ISSR分子标记技术对三叶青全国主分布区24份种质资源的遗传多样性进行了研究,也发现种质聚类分析结果与地理分布密切相关。Peng等[21]采用SRAP和ISSR标记对27个三叶青野生或栽培居群的遗传多样性进行分析,发现树状图显示了三叶青的地理分布集群模式。
RAPD具有操作简便、不需提前知道材料基因信息、检测灵敏、多态性强等特点,是目前研究植物遗传变异、植物遗传多样性、植物品种鉴定等方面广泛采用的一种分子标记法[22]。在实际应用中,RAPD技术可以在物种没有任何分子生物学研究水平的背景下,对其基因组进行多态性分析[23],而且成本较低,操作简单,引物来源广泛,这对于遗传背景研究相对较少的三叶青来说较为适宜。
在本实验中,来源于江西怀玉山太阳坑、江西南丰泰和镇果村、江西德兴暖水、江西婺源段莘乡五龙山、江西丰城市玉华山、江西弋阳三县岭的三叶青与来源于安徽黄山玉屏景区、安徽黄山凤凰源景区、浙江景宁大漈、广东韶光仁化县、广东始兴都亨乡、福建光泽的三叶青聚为第Ⅰ类;来源于江西南昌梅岭梅谷、江西贵溪樟坪畲族乡、江西贵溪樟坪畲族乡的三叶青与来源于福建武夷山天心永乐寺、浙江富阳新登外官、浙江台州三门县花桥、福建三明三元吉口、浙江金华武义柳城、福建建阳华家山林场的三叶青聚为第Ⅱ类;来源于江西玉山横街清溪的三叶青与来源于云南文山县古木镇、贵州湄潭茅坪、台湾阿里山、海南尖峰岭森林公园的三叶青聚为第Ⅲ类;来源于江西安远老鼠嘴、江西怀玉山金刚峰的三叶青与来源于湖北永州黄田铺、福建蒲城县筊杯岩、贵州黄果树景区、广西龙胜银水侗寨、广西崇仁明仁、浙江宁波天童寺南山的三叶青聚为第Ⅳ类;来源于江西玉山必姆坳村的三叶青与来源于浙江淳安大市花石源的三叶青聚为第Ⅴ类;来源于重庆药用植物园、湖南吉首德夯、湖南张家界森林公园、重庆潼南县上和镇、湖南沅陵清水坪、重庆彭水、湖北星斗山、重庆金佛山山泉镇、湖南张家界金鞭溪、广西乐业龙角山、湖南凤凰南华植物园、四川峨眉山清音阁却与来源于浙江温州永嘉四海山的三叶青聚为第Ⅵ类;来源于江西井冈山、江西鹰潭龙虎山的三叶青与来源于广西桂林植物研究所、浙江开化洪源、浙江舟山白泉镇、浙江宁波天童寺钟乐海、浙江丽水莲都东西岩、宁波市天童寺小天童、广西龙胜花坪红毛冲、云南麻栗坡中寨村的三叶青聚为第Ⅶ类;来源于湖南怀化绥宁县党坪、广西乐业龙角山、广西桂林龙胜粗江的三叶青则聚为第Ⅷ类;来源于浙江遂昌白马山的三叶青单独成为第Ⅸ类;来源于广西百色富宁的三叶青单独成为第Ⅹ类;来源于江西宜黄徐坊镇邓家的三叶青单独成为第Ⅺ类。以上分类结果表明,三叶青种质资源的遗传多样性较高,与群体的地理分布并没有显著的相关性,与前人研究结果不同。究其原因,朱波等[7]指出,可能是所取材料均为一个种,属于种内变异,相比种间或居群间变异小,其次,可能是种源地组成较为单一;Peng等[13]也认为,群体内遗传相似性高于群体间,栽培群体间的遗传相似性远高于野生群体,可能是基因流水平低、距离隔离和无性繁殖所致。袁带秀等[5-6]对3个不同种源地三叶青酯酶同工酶和POD同工酶进行比较研究,发现小猫儿村三叶青与州党校三叶青的亲缘关系较近,与永顺三叶青的亲缘关系较远。这也为三叶青遗传多样性不一定与地理分布相关提供了一些依据。在本实验中,聚类分析的结果与种源的地理距离也存在不一致性,这可能与种源地的地形、气候等自然因素有关。而且这些种源都采集于怀玉山种质资源库,三叶青对种质资源库的气候、地形、土壤等条件的适应可能也会导致个体遗传性状的改变,从而导致聚类分析的结果错综复杂。
多态性位点的丰富程度间接反映了种群遗传多样性的丰富程度[24]。种群中的多态性位点多,表明群内物种间遗传变异的水平较高,种群遗传多样性丰富,对环境有较强的适应能力;反之,如果其多态性位点较少,则表明该物种的遗传多样性较差,对环境没有较好的适应能力,在自然选择的过程中处于劣势[25]。在本研究验中,64个三叶青样本的观测等位基因数(Na)为1.666 7~2.000 0,有效等位基因数(Ne)为1.247 9~1.701 3,Nei's基因多样性指数为0.167 0~0.398 4,Shannon多样性指数(I)为0.262 8~0.583 0,平均多态位点为7.5,平均多态百分数为93.75%,说明64个三叶青样本的遗传多样性较为丰富,对高山环境有较强适应力。
