宁夏地区慢性乙型肝炎患者乙肝病毒基因分型与耐药突变分析
2018-12-03赵志军刘红玲赵倩颖苏雅静
赵志军 刘红玲 钟 利 赵倩颖 董 洁 苏雅静
乙型肝炎病毒(Hepatitis B Virus,HBV)属嗜肝DNA病毒科正嗜肝DNA病毒属,是引起乙型肝炎(简称乙肝)的病原体,全世界每年大约有超过70万人死于乙肝的并发症(如肝硬化和原发性肝细胞癌)[1]。中国HBV携带者约有7800万,慢性乙肝(Chronic Hepatitis B,CHB)患者占全球患病人数的十分之一,约2000万人。每年有30万人死于HBV相关的肝硬化和肝细胞癌,占全球死亡率的37%—50%[2]。近几十年来,HBV感染的治疗药物主要依赖于干扰素(IFN)和核苷(酸)类似物 (Nucleoside/Nudeotide Analogues,NAs)这两大类。IFN具有调节免疫、抗病毒、抗纤维化的优点,但由于副作用严重、使用不便利、禁忌症较多等因素,临床应用相对较少。而核苷类药物具有更强的抑制病毒复制的能力,故而更受临床青睐。然而在长期治疗过程中,拉米夫定(Lamivudine,LAM)和阿德福韦(Adefovir,ADV)出现了严重的病毒反弹及血清学突破现象,因此临床开始关注耐药突变和HBV基因分型的情况。本课题拟使用直接测序法对宁夏地区226例样本的逆转录区(RT区)进行耐药位点突变检测,并进行基因分型,明确该地区CHB患者的优势基因型及耐药情况,为CHB患者个体化医疗提供理论依据。
1 资料与方法
1.1 研究对象
选取2016-08-2017-12宁夏医科大学总医院住院及门诊的CHB患者226例,纳入标准为HBsAg阳性(持续≥6个月),且HBV-DNA阳性(拷贝数>1.0×103)。其中男150例,女76例,年龄4-73岁,平均年龄39.06±14.26岁。患者均来自宁夏本地区、县,均符合2015年中华医学会全国CHB诊断标准[3]。
1.2 纳入与排除标准
纳入标准:患者就诊信息在医院系统均有完整的登记,包括姓名、年龄、电话、民族、临床诊断、诊断时间、是否接受药物治疗、治疗时间以及常见血清标志物等信息。排除合并或重叠其它类型肝炎病毒感染、HIV、自身免疫性肝炎其它病毒感染或其它原因所致活动性肝病及合并酒精性肝病、脂肪肝等。是否应用抗病毒药物不作为排除标准。
1.3 主要试剂与仪器
主要试剂:QIAamp MinElute Virus Spin Kit(德国QIAGEN公司,批号:154021378);2000 DNA marker[天根生化科技(北京)有限公司,批号:Q5725];2×Taq plus Master Mix(南京诺唯赞生物科技有限公司,批号:A2701-1)。HBV核酸荧光检测试剂盒(中山大学达安基因试剂公司,批号:2017008)。仪器:全自动免疫发光仪(E-170/E-601,瑞士ROCHE公司);全自动生化分析仪(ADVIA 2400,德国SIEMENS公司);荧光定量PCR仪(Prism 7300,美国ABI公司);梯度PCR仪(AG 22331 Hamburg,德国EPPENDORF公司);凝胶自动分析和成像仪(ChemiDocTM MP Imaging System,美国Bio-Rad公司)。
1.4 检测指标和方法
1.4.1 血清学标志物、生化相关项目检测:乙肝表面抗原(HBsAg)、乙肝表面抗体(HBsAb)、乙肝核心抗体(HBcAb)、乙肝e抗原(HBeAg)、乙肝e抗体(HBeAb)均采用ROCHE公司生产的 Cobas E-170/E-601全自动免疫发光仪及配套试剂盒进行定量分析,检测方法为化学发光微粒子免疫分析法。生化相关项目检测:采用德国西门子公司ADVIA 2400型血液生化分析仪及原厂配套试剂盒检测。所有标本留取清晨空腹静脉血5ml,2h内分离血浆,-20℃冷藏保存批检。
1.4.2 HBV-DNA检测:所有标本留取清晨空腹静脉血2ml,2h分离血浆,-20℃冷藏保存批检。采用美国生物系统公司生产的ABI Prism7 300荧光定量 PCR仪进行定量分析,使用HBV核酸荧光检测试剂盒,检测下限为 100IU/ml。每批PCR试验均设阳性、临界阳性和阴性对照,并严格按照说明书操作。
1.4.3 HBV耐药基因突变检测及分型分析:所有患者留取清晨空腹静脉血5ml,立即分离血浆,-20℃冷藏保存。按照Qiagen(凯杰)全基因组提取试剂盒说明书进行血浆样本的HBV- DNA基因组提取,采用普通PCR扩增HBV P区序列(Genbank ID:AY123041.1),PCR反应条件为50μl反应体系,95℃预变性3min;94℃ 30s,57℃ 30s,72℃ 40s,35个循环。引物使用Primer 3在线设计,序列为:5’-GAC AGT CAT CCT CAG GCC AT-3’、5’-TAT GGA TCG GCA GAG GAA CC-3’,扩增产物为1 299bp。引物合成、双向测序均由生工生物工程(上海)股份有限公司完成。测序结果应用NCBI BLAST及DNAMAN等软件进行分析,确定突变位点和基因型别。
1.5 统计学处理
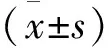
2 结果
2.1 226例CHB患者HBV基因型分布
根据测序结果,在NCBI上与标准序列进行比对,本研究226例样本中,其中B基因型22例占9.74%,C基因型168例占74.34 %,D基因型18例占7.96%例,混合型18例占7.96%。
2.2 C基因型与非C基因型CHB患者血清学标志物、HBV-DNA水平比较
根据非参数秩和检验结果,C型ALT水平高于非C型患者,差异有统计学意义(P<0.05),C型与非C型间HBsAg、 HBeAg 及HBV-DNA差异无统计学意义(P>0.05)。见表1。
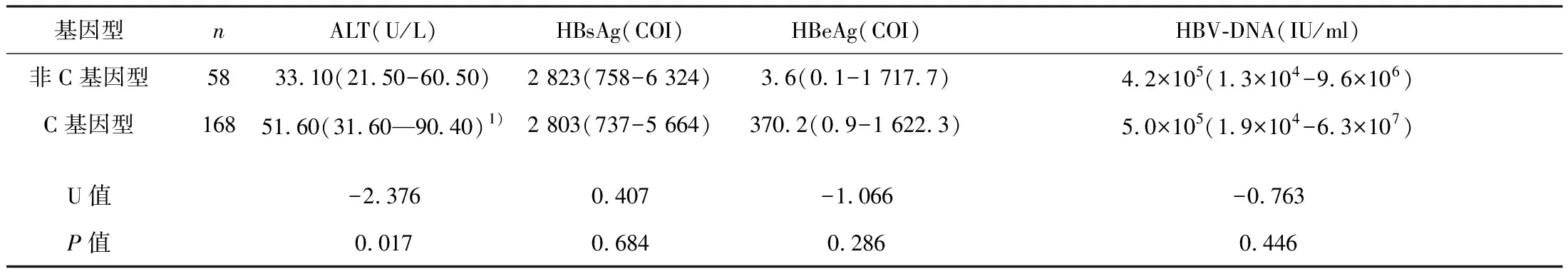
表1 C基因型与非C基因型CHB患者血清学标志物、HBV-DNA水平比较[M(QL,QV)]
注:与非C型比较,1)P<0.05
2.3 41例CHB患者RT区变异位点及耐药情况
226例样本中,检测到41例发生耐药变异,变异率为18.1%。以单点突变rtM204I/V为主,单点突变7例,突变率为11.86%;混合突变及单点突变包含rtM204突变共18例,突变率为30.5%。其余还检测到rtL180M、rtV214A、rtA181T/V、rtS213T等位点的变异。检测到多位点变异rtS213T +rtA181S+rtN236T+rtS202I、rtM204V+rtL180M+rtT184A等13例,主要耐药药物为拉米夫定。其中2例特殊耐药rt204+rt180+rt184 和rt204+rt180+rt202对拉米夫定、替比夫定和恩替卡韦均耐药。见表2。
2.4 41例耐药患者耐药位点突变率统计
如图1所示,本地区耐药突变主要发生在与拉米夫定耐药相关的位置,主要集中在rt204、rt180位点,突变率分别为30.51%和20.34%,在rt173和rt213位点突变率也分别为5.08%和8.47%。其次为耐阿德福韦的rt181位点,突变率为13.56%。

图1 HBV-DNA RT区常见耐药相关位点突变率
2.5 不同基因型在某个位点突变率的比较
B基因型rt184和rt204位点突变率均高于C基因型(P<0.01)。B基因型rt204位点突变率高于D基因型,rt213位点突变率低于D基因型(P<0.05)。D基因型rt214位点突变率高于C基因型(P<0.01)。其它基因型各位点突变率差异均无统计学意义(P>0.05)结果见表3。

表2 41例慢性乙型肝炎患者P(RT)区变异位点及耐药情况

表3 不同基因型在不同位点突变率的比较(n,%)
3 讨论
HBV感染一直是全世界健康安全面临的巨大挑战。虽然乙肝的第一步预防已经取得明显成效,但是由于我国人口基数大,感染率高等因素,HBV感染形势依然严峻。
药物治疗依然是目前针对HBV的最佳选择,在药物和人体免疫环境双重引导下,逆转录区(HBV基因组的rt区)开始出现氨基酸替换[4],不仅会出现单点突变,还可能在同一段序列中出现多处碱基改变,赋予了病毒对多种药物耐药的可能。在rt区,最常见突变的是M204I/V(又被称为YMDD变异),通常与拉米夫定和其他L-嘧啶类药物密切相关。其次常发生于使用了阿德福韦后,在N236T突变的基础上出现A181T/V/S突变模式。第三种是已发生M204V突变后,进一步出现L180M和T184A/G/I/L/S或S202C/G/I或M250V等位点的突变,这些突变足以导致对恩替卡韦的耐药。虽然至今为止仍没有明确替诺福韦耐药模式,但与其相关的rtA194T突变依然需要持续关注,因此,该药物被指定用于治疗对其它药物均有耐药性的患者。已有研究表明替诺福韦与阿德福韦存在交叉耐药的可能性,对阿德福韦耐药的A181V/T和N236T型的病毒株对替诺福韦只能产生微弱应答[5]。
本研究中共226例样本,检测到41例发生耐药变异,变异率为18.1%。其中以单点突变rtM204I/V为主,此位点的总突变率高达30.5%。还检测到13例多位点变异,其中1例样本同时存在四个突变位点。有2例M204V突变的基础上,进一步出现L180M和T184A/G/I/L/S或S202C/G/I突变的样本,正如Keskin等[5]的研究所示,患者均已出现恩替卡韦的耐药情况。在宁夏地区耐药仍然是一个大问题,由于经济原因,大量患者仍在使用第一代NAs,积累了大量的拉米夫定耐药患者,这也为恩替卡韦耐药株的出现提供了基础。对于已发生M204V变异的患者,更应该慎重合理的选择用药,及时监测耐药突变位点的情况,避免出现多重耐药而增加治疗难度。若已出现多重耐药,则更应该监测其耐药突变位点,合理优化治疗方案,避免病情失去控制而进一步加重。
在本研究中,C基因型168例,占74.34%,依然是宁夏地区的优势基因型。另外还发现了B基因型22例,D基因型以及混合型均为18例。基因型分布与Chen等人[6]的研究结果相符。与之前宁夏地区相关的研究相比,新发现了18例D型基因。这可能由于过去的研究中样本量过少所导致,还有可能是自然选择的结果。在混合型中均有C型的一部分,这证明C基因型在本地区有着绝对的优势。多位研究者相关研究结果曾表明,C基因型患者肝脏炎症与纤维化程度较B基因型严重,并且与重症肝炎相关,是乙肝病毒感染向肝硬化肝癌进展的高风险因子[7]。在本研究中C基因型的患者HBV-DNA水平均值稍高于非C基因型组,并且ALT水平显著高于非C组。说明宁夏地区C基因型患者的肝脏炎症程度相较于其他基因型更重且病毒复制更为活跃。与上述观点完全相符,与曹军皓等人[8]的研究结果也相同。
本研究结果表明B基因型rt184和rt204两个位点的突变率均高于C基因型,与Mirandola等[9]、杨梦媛等[10]的研究结果一致。有研究显示C基因型多药耐药的发生率较B基因型高。且更倾向发生rtT184/rtS202的突变模式,而B基因型更倾向于发展为rtM250的突变模式[11]。在本课题中,宁夏地区C基因型更倾向发生rtM204的突变模式,且较其它基因型更容易发生拉米夫定耐药。
综上,CHB的治疗虽然已取得显著成果,但是NAs相关的耐药问题是必须要面对的挑战。不同基因型不仅在临床表现不一致,还在对药物治疗的反应以及治疗的效果上都有所不同,因此临床上检测CHB患者的HBV基因型,及时调整治疗方案,实现个体化诊治,将CHB带来的损失和伤害控制在最低水平。及时了解基因型耐药突变体的流行信息,也为减少HBV耐药株的传播,制订预防耐药发生措施提供依据。
