利用CRISPR/Cas9技术定点敲除烟草多酚氧化酶基因NtPPO1
2018-11-30姚恒杨大海白戈谢贺
姚恒 杨大海 白戈 谢贺
(云南省烟草农业科学研究院,昆明 650021)
在植物中,多酚氧化酶(Polyphenol oxidase,PPO)能将酚类物质催化反应出能直接杀灭病原菌的醌类物质,被认为对植物抗虫、病菌等生物因素性胁迫是有益的。然而,因为PPO催化产生深褐色的醌类物质又直接危害果蔬、水稻及小麦等农产品的外观品质,因此,过强的PPO酶活性对作物的品质有害。植物中的PPO的功能具有多样性,在豆类[1]、番茄[2-3]、马铃薯[4]、红三叶草[5-6]、苹果[7]、水稻[8]和小麦[9-10]等植物中已有大量的报道。育种学家在研究PPO基因功能的基础上,根据需求选育出PPO酶活性强或者弱的品种,创制出抗病虫害或者不易褐化的产品。烟草也存在抗病虫害与低褐变烟叶品种的需求,利用现代分子标记手段揭示烟草品种耐烤性的分子基础,提出决定烟草品种耐烤性的候选基因[11-12]。但烟草PPO基因的功能研究主要集中在烟草调制过程中褐变与PPO酶活力相关性的研究[13-16]。针对烟草PPO基因功能的研究相对较少[17-23]。研究烟草PPO基因功能,需要创制突变体材料。CRISPR/Cas9技术于2015年成功应用于烟草[24]基因功能研究,目前,国内关于烟草中CRISPR/Cas9技术的应用正在普及。为了获得NtPPO1的定点突变体,本研究利用CRISPR/Cas9技术构建烟草多酚氧化酶NtPPO1的编辑载体,筛选NtPPO1被定点编辑敲除的纯合突变体。通过实时定量PCR技术检测到突变体中NtPPO1的相对表达量,突变体的创制为研究其基因功能奠定了材料基础。
1 材料与方法
1.1 材料
栽 培 烟 草 品 种(Nicotiana tabacum)K326、DH5α大肠杆菌与LBA4404农杆菌感受态为云南省烟草农业科学研究院实验室保存。pORE-CRISPR/Cas9植物表达载体由西南大学惠赠。引物合成和测序均由上海英潍捷基贸易有限公司(Invitrogen)完成。
1.2 方法
1.2.1 引物设计和基因克隆 以烟草叶片cDNA为模板,根据NtPPO1序列设计引物(F:5'-ATGGC TTCTTCATTTGTTCTTCAAGC-3';R :5'-TTAACAA GGGACCAACTGGATCTCAAC-3'),利用 Q5 超保真DNA聚合酶进行扩增,扩增产物经过琼脂糖凝胶电泳进行检测。回收、纯化、连接和转化,经抗性筛选,PCR鉴定后挑选阳性单克隆菌落测序验证。
1.2.2 sgRNA表达载体的构建 根据测序正确的NtPPO1序列,设计靶位点sgRNA序列:5'-CATTTGTTCTTCAAGCTCCA-TGG-3'作 为CRISPR/Cas9敲除NtPPO1的靶位点序列。
根据pORE-CRISPR/Cas9植物表达载体构建方法,需要在sgRNA靶序列添加核苷酸G与BsaⅠ的酶切接头(F:5'-GATTGCATTTGTTCTTCAAGCTCCA-3';R :5'-AAACTGGAGCTTGAAGAACAAAT GC-3')。sgRNA退火反应:在PCR仪器中设定程序每8 s降低0.1℃,将混合单链引物从95℃降至4℃以形成引物DNA双链。
利用BsaⅠ酶切pORE-CRISPR/Cas9植物表达载体,将其与已退火好的靶位点DNA引物进行连接,构建成NtPPO1的CRISPR/Cas9载体。将目的载体直接转化大肠杆菌DH5α感受态细胞,利用含卡那霉素的抗性培养基筛选阳性克隆。利用上游引物:5'-TTAGGTTTACCCGCCAATA-3', 与 sgRNA 反向引物配合PCR筛选阳性菌落。
1.2.3 农杆菌转化载体构建与烟草遗传转化 提取克隆载体中的质粒转化农杆菌LBA4404。利用含载体农杆菌浸染烟草叶盘8-10 min。然后经过2 d共培养,转移至含有NAA、6-BA和卡那霉素(50mg/L)以及头孢噻肟钠(500 mg/L)的MS固体培养基中进行组培再生,获得转基因烟草植株。
1.2.4 烟草NtPPO1突变体的筛选 提取转基因烟草植株DNA。利用Kana引物(F:5'-CAGGTTCTCC G G C C G C T T G G-3',R :5'-GGAGATCCTGCCCCGG-CACT-3') 进 行PCR,检测阳性植株。利用Cas9引物(F:5'-TGTCGGGACAGGGCGACAGT-3',R:5'-CGCCGCGTTCAGCCTTTGTG-3')进行 PCR,检测阳性植株。
挑取经PCR检测阳性的烟草小苗,设计包含靶位点区域的长度为770 bp的片段引物(F:5'-TTCACGCACTAATTCGTCTCATTGGA-3',R:5'-TCTGTCGGCAACGCCTTCA-3')进行检测。
PCR扩增NtPPO1片段,扩增产物经测序、比对后,分析转基因后代植株中NtPPO1在靶位点处核苷酸序列变化。
基因编辑成功的转基因阳性T1植株,分单株套袋自交收获T2种子。播种萌发T2种子获得T2小苗100株,提取T2植株DNA,利用上述方法检测NtPPO1突变情况,并分析T2纯合突变烟草中NtPPO1序列在靶位点处突变类型。
1.2.5 烟草NtPPO1的Real time-PCR检测 按照Quant qRT-PCR kit(SYBR Green)(TIANGEN 公司)使用说明在QuantStudioTM6 Flex荧光定量PCR仪器(ABI公司)上进行qRT-PCR检测。3个生物学重复,3个技术重复,利用Excel进行统计分析,以sigmplot软件绘制qRT-PCR分析图。分析NtPPO1的相对表达量,内参基因为26S。所需引物为NtPPO1_qRT_F:5'-AGCACTGCCTTTATTGATGATGG-3',NtPPO1_qRT_R:5'-ACTTAGCTATGTATTCGTCATCTACAGTT-3'。26S_F:5'-GAAGAAGGTC C C A A G G G T T C-3',2 6 S_R :5'-TCTCCCTTTAACAC-CAACGG-3'。
2 结果
2.1 NtPPO1全长cDNA序列验证
如图1所示,利用设计的克隆引物以烟草cDNA为模板,特异性扩增出一条约1.8 kb的片段,经测序比对分析NtPPO1的基因座(图2-A),NtPPO1编码序列为1 746 bp,其外显子有3个,其中第2外显子可以选择性拼接。测序发现5个克隆中有4个克隆的NtPPO1编码序列为1、2、3外显子拼接而成(图2-B),另外1个克隆的NtPPO1编码序列为1、3外显子拼接而成(图2-C)。NtPPO1可变剪切形式为外显子跳过,在不改变起始位点的情况下,NtPPO1转录后的mRNA会提前出现终止密码子。跳过的第2外显子序列为5'-GTACTTATA CTTCCATGAGAGAATCTTGGCTTCCCTAATTGG TGACCCTACATTTGCTTTGCCATATTGGAATTGG GACCATCCTAAAGGCATGCATTTGCCTGACATG TTTGATGTCGAAG-3'。
在野生型的烟草植株中,NtPPO1就存在2种不同的转录形式,虽然转录本会提前出现终止子(图2-C),但是烟草中保存这种转录剪切方式应该有其重要的生理功能,推测这种无义介导的mRNA降解(Nonsense-mediated mRNAdecay,NMD)可以监控细胞中的mRNA水平以便烟草能够快速的响应外界刺激。
图1 NtPPO1的cDNA扩增产物
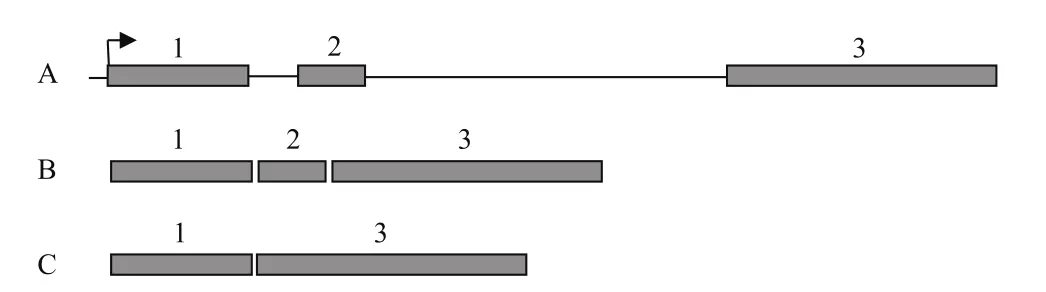
图2 NtPPO1基因座图
2.2 NtPPO1突变靶位点的选择与载体构建
NtPPO1的CDS序列经过测序验证后,选取翻译起始密码子ATG后第11-30的20 bp核苷酸序列作为敲除基因的靶位点序列,构建CRISPR/Cas9植物表达载体,目标载体转入农杆菌后,图3显示,通过测序验证筛选出含sgRNA序列正确插入到CRISPR/Cas9表达载体的农杆菌菌株。
含正确插入sgRNA的基因编辑载体,利用农杆菌叶盘法转化烟草,经过组培再生成转基因T1代植株。

图3 pORE-CRISPR/Cas9∷sgRNA基因编辑载体
2.3 NtPPO1敲除阳性T1植株筛选
通过测序方法筛选NtPPO1被编辑的转基因植株T1(图4),编辑成功的T1植株在sgRNA-PAM位点后序列经测序出现双峰,并且测序峰图紊乱的情况明显不一致,说明Cas9蛋白在切断目标序列后,DNA修复的情况有差异。将此三类转基因T1杂合突变植株盆栽后自交收种。经过自交分离后产生的T2代植株中,会得到三类NtPPO1纯合突变的T2植株。

图4 NtPPO1定点敲除转基因T1植株筛选
2.4 NtPPO1突变体的检测
经测序分析T2植株NtPPO1在目标敲除序列后(图5),突变体M1植株的NtPPO1缺失了1个G碱基,M2植株的NtPPO1缺失了2个G碱基,M3植株的NtPPO1突变是插入了1个A碱基,此3类突变都会造成NtPPO1编码序列的移码突变,如果转录出mRNA,在起始阅读框不变的情况下会提前出现终止密码子。
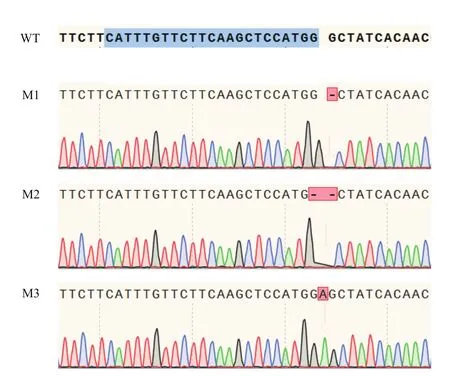
图5 T2代转基因植株NtPPO1的突变类型
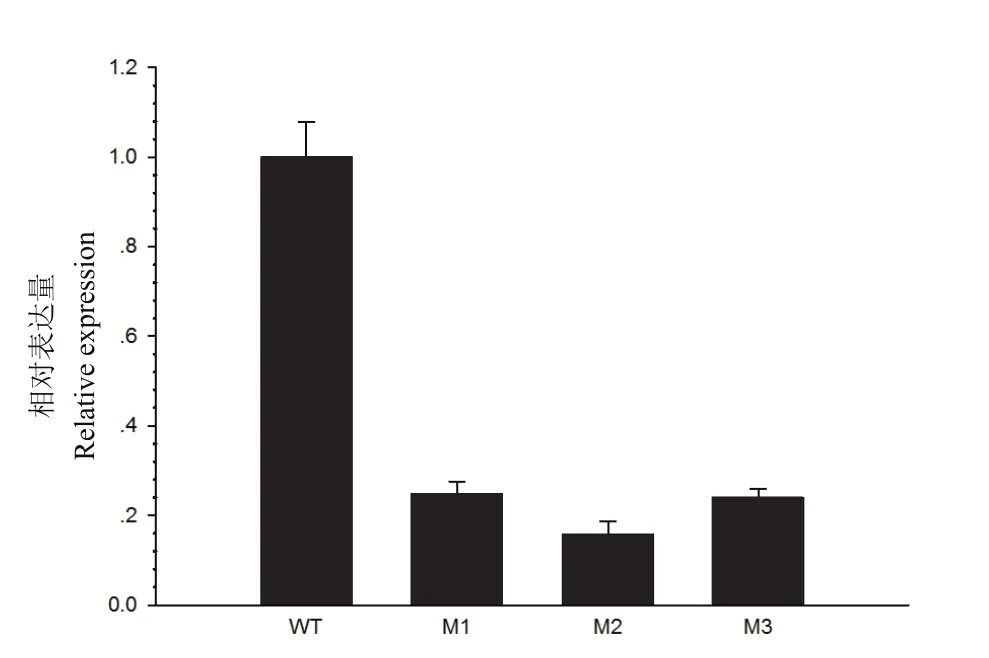
图6 T2转基因植株中NtPPO1的相对表达量分析
2.5 突变体内NtPPO1相对表达量的检测
测定NtPPO1纯合突变植株M1、M2、M3的基因表达量如图6所示,相对于野生型对照,M1、M2、M3突变体NtPPO1的表达量分别下降了75%、84%和76%。结果表明,利用CRISPR/Cas9技术创制的NtPPO1的突变体也影响了此基因的转录。在DNA水平上的点突变,造成了基因转录水平的改变。NtPPO1的突变是位于第1外显子区域,而不是位于启动子区域。理论上,造成NtPPO1表达量降低就应该发生在转录后的水平调控,具体是发生在转录后的哪个时期还有待进一步的研究。

图7 NtPPO1纯合突变体植株表型
2.6 转基因烟株表型
如图7所示,利用CRISPR/Cas9技术创制的NtPPO1突变体与对照野生型烟草之间的田间外观表型无明显差异。
3 讨论
本研究选取了一个烟草多酚氧化酶NtPPO1进行基因序列克隆验证,结果表明,NtPPO1存在一种可变剪切形式。在验证了NtPPO1序列的基础上,采用CRISPR/Cas9技术,创制1、2 bp碱基缺失和1 bp碱基插入的NtPPO1定点纯合突变体M1、M2和M3。通过基因表达发现,突变体中NtPPO1表达水平有显著的下降。
植物中的PPO功能具有多样性。根据前人的研究结果,PPO与植物抗虫、抗细菌性病害的能力相关。但是,在一些作物中通过降低作物中的PPO酶活,会减轻农作物发生褐变的程度,如在葡萄[25]、小麦[26]、水稻[27]等作物中的结果显示,低的PPO活力能不同程度的显示出不易褐变、耐贮藏的特性。根据本实验基因测序的结果显示,NtPPO1已经被成功敲除,并且基因的表达量也发生了显著的下降。王曼玲等[28]报道植物的PPO一般存在多个基因编码,而本研究普通栽培烟草中的PPO基因至少有15个(研究未发表),单独敲除某一个PPO基因,可能会由于另外一个PPO基因在功能上互补,造成植株整体上的PPO活力下降并不显著。所以需要研究烟草中的PPO基因的功能,还需要进一步的创制出各PPO基因的突变体,甚至是烟草PPO双、三基因突变体,才能更全面的研究PPO基因功能。
根据qPCR测定结果显示CRISPR/Cas9创制的NtPPO1的纯合突变体其NtPPO1的表达水平显著降低。说明利用CRISPR/Cas9在烟草中创制某个基因的定点突变时,也可能会影响此基因转录。这个结果和Cai等[29]在大豆中的研究结果类似,Cai等在大豆中靶向敲除控制开花的基因GmFT2a,在长日照和短日照的条件下,GmFT2a的相对表达量下降。根据Wu等[30]的研究表明,真核生物中,如果基因序列存在早期终止子(Premature termination codons,PTCs),相对于没有PTCs的mRNA,携带PTCs的mRNA会通过无义mRNA降解途径(Nonsensemediated mRNA decay pathway)快速降解,防止因翻译出无意蛋白的积累才启动降解蛋白调控。本研究利用CRISPR/Cas9在NtPPO1靠近起始密码子的核苷酸序列上引入了移码突变,结果提前出现了终止密码子,可能启动了烟草本身的NMD调控途径,进而造成了NtPPO1的转录下降。当然,这只是一个推论。本研究利用CRISPR/Cas9基因编辑技术创制NtPPO1突变体,其NtPPO1表达水平发生下降的机理还有待于进一步的研究。
本研究利用CRISPR/Cas9基因组编辑技术获得了烟草PPO基因NtPPO1的编辑敲除突变体,对NtPPO1的功能进行了初步研究,为烟草PPO基因功能研究和烟草育种奠定了材料基础。
4 结论
本研究克隆验证了烟草多酚氧化酶NtPPO1编码序列,并利用CRISPR/Cas9技术成功创制了3个NtPPO1定点突变体材料,NtPPO1在突变体中的表达量显著降低,而突变材料与对照烟草表型上无显著差异。
