植物亚硝基谷胱甘肽还原酶在胁迫反应中的作用研究
2018-11-30夏金婵
夏金婵
(河南中医药大学基础医学院,郑州 450046)
一氧化氮(Nitric oxide,NO)参与植物的许多胁迫反应过程,是一个重要的信号分子,NO可通过翻译后修饰改变蛋白或酶的活性及功能,主要的调控形式是NO与半胱氨酸上的硫基发生可逆的S-亚硝基化作用,NO还可对金属蛋白的金属中心进行亚硝基化,或者与蛋白的酪氨酸残基结合发生不可逆的硝化作用。NO属于活性氮分子(Reactive nitrogen species,RNS),其半衰期很短,这限制了它在细胞中的生理功能。胞内含硫基的分子能够与NO相互作用,形成S-亚硝基硫醇(S-nitrosothiols,SNO),其也属于RNS,但是比NO的化学性质稳定,在植物的生长发育及抗逆过程中SNOs参与NO的运输、扩散、储存以及蛋白的翻译后修饰过程[1]。NO及RNS能够与谷胱甘肽(Glutathione,GSH)在有氧条件下发生S-亚硝基化作用形成S-亚硝基谷胱甘肽(S-nitrosoglutathione,GSNO),GSNO是一个稳定的NO储存库和转运形式[2]。
乙醇脱氢酶Ⅲ(Alcohol dehydrogenase Ⅲ,ADH3)普遍存在于真核与原核生物,而且高度保守,参与甲醛的解毒过程(甲醛+谷胱甘肽+NAD+S-甲酰谷胱甘肽+NADH+H+),而且该酶还催化依赖NADH的S-亚硝基谷胱甘肽还原成氧化型的谷胱甘肽(Oxidized glutathione,GSSG)和NH3的过程[3],该过程也可被看作是一个亚硝基化作用,影响GSNO的水平,进而影响细胞内NO的含量。在植物和其他生物中亚硝基谷胱甘肽还原酶(S-nitrosoglutathione reductase,GSNOR)最初被认定为是一个依赖谷胱甘肽的甲醛脱氢酶,后来发现催化反应过程包含S-亚硝基谷胱甘肽羟基的氧化,以及谷胱甘肽与甲醛形成S-甲酰基谷胱甘肽。因此,重新命名为S-亚硝基谷胱甘肽还原酶,该酶参与S-亚硝基硫醇的代谢过程。GSNOR在进化过程中相当保守,在保护细胞免受硝化胁迫中起作用,GSNOR属于乙醇脱氢酶Ⅲ家族,同源二聚体,每个亚单位含有两个锌原子,NH3和GSSG是GSNOR催化的产物[4],GSNOR以把NO转移到特定的蛋白上,使蛋白发生亚硝基化,调控GSNO与蛋白亚硝基化之间的平衡,稳定胞内NO的含量,而且该过程影响胞内GSH与NADH的含量,间接的调控细胞的氧化状态[5]。本文主要就植物中GSNOR的结构特点、表达部位以及参与植物生长发育、生物与非生物胁迫等过程进行了概述,探讨其在植物生长发育及胁迫反应中的作用机制,旨为以后对GSNOR功能的深入研究奠定基础。
1 植物中的GSNOR
在高等植物中首先在拟南芥中检测到了GSNOR的活性,把拟南芥中一个推测的依赖谷胱甘肽的甲醛脱氢酶的cDNA(AT5G43940)在酵母中表达,能够恢复GSNO代谢缺陷的酵母对GSNO敏感的表型[6],过表达或敲除GSNOR基因的植株都表现出短根的表型[7]。还有研究表明GSNOR通过蛋白的亚硝基化参与细胞死亡过程[8]。拟南芥GSNOR cDNA编码一个由379个氨基酸(42.5 kD)组成的蛋白,该蛋白高度保守,与番茄中GSNOR的序列相似度达90%。半胱氨酸残基(Cys)是氧化胁迫的重要修饰位点,参与氧化信号的传导过程。植物的GSNOR含有14-16个Cys,其中的13个在植物中保守,Cys10、Cys271和Cys370位于蛋白的表面为进行翻译后修饰提供条件。
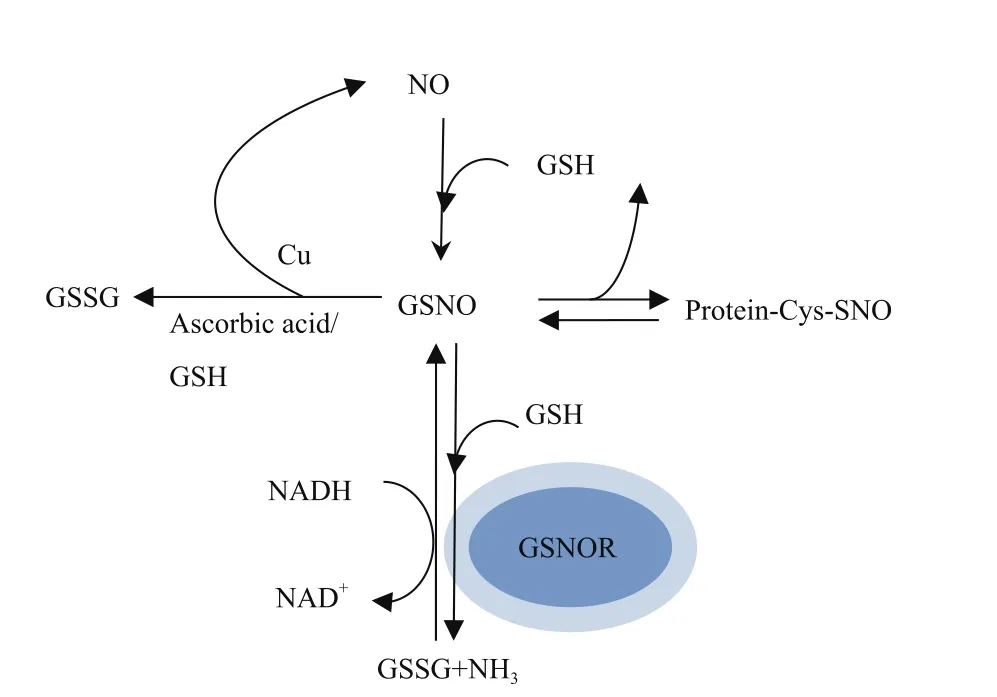
图1 GSNOR调节植物细胞亚硝基化水平图解
植物GSNOR缺失突变体中S-亚硝基硫醇(S-nitrosothiols,SNO)的含量升高,包括大分子量与小分子量的SNO,这暗示GSNOR的活性不仅调控植物中GSNO的含量,而且间接影响蛋白的亚硝基化水平,GSNOR缺失影响植物的正常生长发育,抗病性降低,对高温敏感,对胁迫诱导的细胞死亡不敏感[9-10](图1)。目前,有许多GSNOR的相关突变体,拟南芥中有GSNOR缺失突变体(hot5-2/gsnor1-3)、过表达突变体和启动子区的插入缺失突变体(GSNOR的表达量却上调),番茄中也有GSNOR的缺失或过表达突变体,这些为研究GSNOR的功能提供了条件。在过去20年中,GSNOR的功能被在多个物种中进行了研究,如拟南芥、辣椒、番茄、向日葵、烟草、豌豆、花椰菜和莴苣等。
2 GSNOR的亚细胞定位
在拟南芥中利用GSNOR-GFP融合蛋白的方法分析了GSNOR的亚细胞定位,发现GSNOR在根、叶、种子和花(花药、花丝、子房、柱头、花瓣和花粉)中都有表达,特别是根尖和茎尖分生组织[11]。亚细胞定位研究证明GSNOR定位在细胞质,但也有研究表明其定位在过氧化物酶体,还需要进一步探讨[12]。利用GSNOR的抗体发现在叶片横切面上的微管组织及表皮细胞中也有表达[13]。在向日葵中发现GSNOR在下胚轴的皮层细胞与微管组织中表达[14]。在豌豆的叶片细胞中GSNOR亚细胞定位在叶绿体、胞质、线粒体与过氧化物酶体,GSNOR的亚细胞定位与ROS和NO在细胞中的定位(过氧化物酶体、线粒体、叶绿体)重合,为细胞氧化状态对GSNOR进行调节提供了可能性[15]。
3 GSNOR参与植物对生物胁迫的反应过程
GSNOR参与植物正常的生长发育过程,在拟南芥中除了成熟的花粉外其他组织中都有表达,但是在根和叶片中的表达量比较高[7]。在拟南芥中GSNOR参与胞内SNO的形成,调控SNO的含量,参与植物的抗病反应过程[16]。拟南芥中GSNOR缺失突变体的基因芯片结果表明,在170个下调的基因中1/3的基因是参与真菌感染胁迫反应过程的[11]。在拟南芥中通过反义RNA干扰获得的GSNOR低表达的转基因植株表现出对寄生霜霉(Peronospora parasitica)感染的抗性,可能与胞内高含量的SNOs及抗病基因PR-1的高表达相关,GSNOR过表达植株中系统获得性抗病能力下降,而且韧皮部有GSNOR的表达,有利于系统获得性抗病信号通过韧皮部的传导[17]。当霍尔斯单轴霉(Plasmopara halstedii)感染向日葵下胚轴时,GSNOR的活性与GSNO的分布与含量负相关,GSNO原本在皮层中积累,当感染霍尔斯单轴霉时GSNO则在表皮中积累,此处正是向日葵感染的部位,因此在感染前后从GSNO的分布位置改变来看GSNO可能与向日葵的抗性有关[18]。GSNOR参与了莴苣对生物营养霉菌的胁迫反应过程,霉菌的感染能够提高莴苣GSNOR基因及蛋白的表达量[19]。
4 GSNOR参与植物对非生物胁迫的反应过程
人们分析了不同胁迫条件下GSNOR的活性与表达情况,当豌豆生长在50 µmol/L镉的胁迫下,GSNOR的活性与转录水平下降了31%,并伴随着NO、GSH及GSNO含量的减少[20]。在镉的胁迫下三叶草中的GSNOR活性提高[21]。但是,在拟南芥中的研究结果却相反,0.5 mmol/L的砷能抑制根的生长,并能造成氧化胁迫,当拟南芥在0.5 mmol/L砷胁迫下,GSNOR的活性的活性显著增加,并伴随着NO的含量增加[22]。
在拟南芥中筛选得到一个对高温敏感的突变体hot5-2,突变位点在GSNOR基因,暗示该酶可能与植物对温度的抗性有关,然而,当野生型的拟南芥遭受高温胁迫条件时,GSNOR蛋白的表达量并没有发生变化,也不影响Hsp101、sHspI 和sHspII等热休克相关蛋白质的表达量,这说明在拟南芥中GSNOR对耐热性的影响不是通过热休克蛋白通路来作用的。研究发现,突变hot5-2突变体中亚硝基化水平几乎是野生型的2倍,细胞中的亚硝基化成分可导致亚硝基化胁迫,增加细胞中NO的含量。利用4-氨基-5-甲氨基-2',7'-(4-amino-5-methylamino-2',7'-di fl uorescein diacetate)(DAF-FM DA)对拟南芥的原生质体进行染色发现,热处理能够引起野生型拟南芥中NO含量的轻微增加,而突变体中NO的含量本来就高,热处理前后变化不明显,外源NO的供体SNP能够引起叶片黄化及死亡,突变hot5-2更严重,NO 清除剂cPTIO能提高拟南芥对热的耐受性,内源NO含量升高的突变体nox1也表现出热敏感植物表型,因此,GSNOR可能够通过调控内源NO水平,从而影响植物热敏感性[23]。向日葵幼苗在38℃下处理4 h,下胚轴中GSNOR的活性、蛋白及基因表达量都下调,同时SNOs的含量升高,推测GSNOR调节胞内SNOs的含量,SNOs能够释放NO,参与蛋白的硝基化过程[24],然而,将豌豆幼苗进行相同处理,GSNOR的活性与SNOs的含量都是增加的[25]。将辣椒植株放在8℃下处理24 h,GSNO还原酶的活性增高32%,NO的含量降低50%,伴随着GSH含量的升高[26]。烟草叶片在机械损伤2 h后GSNOR基因与蛋白的表达水平下调[27]。
高盐胁迫影响植物的生长、限制作物的产量,在拟南芥中钙调素4(CaM4)参与植物的非生物胁迫反应过程,其缺失突变体表现出对高盐胁迫敏感的表型。另外,NO也参与植物的高盐胁迫反应过程,GSNOR作为植物体内NO稳态的重要调控基因,研究表明CaM4通过与GSNOR结合,减低其活性,从而促进NO的积累,调控植物的反应过程[28]。向日葵幼苗根系对盐胁迫的敏感性较高,在盐胁迫下GSNOR活性显著降低。将向日葵幼苗放在120 mmol/L NaCl处理下,二硫代赤藓醇能够恢复GSNOR活性,表明该酶的活性改变是可逆的。盐胁迫增强了子叶中蛋白质的亚硝基化,而根则表现为蛋白质的脱氮化。61种发生亚硝基化的蛋白中,17种是子叶特有的,4种是根特有的,而40种是两者共同的。这些观察结果表明,向日葵幼苗在盐胁迫下,在NO的信号传递过程中通过S-亚硝基化和去硝基化作用调节各种酶活性[29]。
在碳酸氢钠处理0.5-2 d,番茄中GSNOR的表达受到明显的抑制,3 d后表达量开始上调,6 d达到最大,之后开始下调。过表达GSNOR基因的植株表现出对碱性钠盐胁迫的抗性,这与抗氧化基因APX、CAT、DHAR、GR的高表达有关;反义抑制GSNOR活性的植株则有敏感的表型,尽管SOS1、SOS2、SOS3、SOS4、H-ATPase、HKT1和HKT2基因表达量上调。但是,RNS和ROS的积累造成了非常严重的氧化胁迫,诱导细胞死亡[10]。
百草枯(1,1-二甲基-4,4'-联吡啶鎓盐二氯化物)是一种非选择性除草剂,能诱导植物中超氧化物与过氧化氢的产生。Chen等在拟南芥中通过筛选得到了一株对百草枯不敏感的突变株par2-1,图位克隆发现突变位点在GSNOR基因中224位氨基酸残基由甘氨酸变成了天冬氨酸,即HOT5基因,缺失突变体gsnor1/hot5/par2中NO的含量升高,过表达GSNOR/HOT5/PAR2基因能够植株中NO的含量,NO供体SNP处理能提高植物对百草枯的抗性,即突变体par2-1中高含量的NO能缓解百草枯引起的细胞死亡,从而提高拟南芥对百草枯的抗性,这些结果表明GSNOR调控胞内NO的稳态[7]。在拟南芥中GSNOR还参与对损伤和水杨酸的胁迫反应过程[27]。但是,向日葵下胚轴受到机械损伤时GSNOR的活性下调,伴随着SNO含量的增加[14]。烟草叶片在受到机械损伤2 h后,GSNOR的mRNA和蛋白的表达水平都下调[27]。
植物激素脱落酸(Abscisic acid,ABA)参与植物的抗逆反应过程,在保卫细胞中ABA能够诱导NO的产生,研究表明NO通过亚硝酸化open stomata 1(OST1)/SnRK2.6(Sucrose nonfermenting 1-related protein kinase2.6)蛋白第137位的半胱氨酸,抑制气孔开放,负调节保卫细胞中ABA的信号传递过程,GSNOR基因缺失突变体gsnor1-3植株保卫细胞中NO含量增加,由于SnRK2.6蛋白的亚硝基化,导致ABA不能诱导气孔关闭[30]。
5 GSNOR对细胞氧化水平的调节
生物与非生物胁迫都能造成植物体内ROS或者活性氮NO/SNO的积累,破坏细胞内的氧化平衡,通过氧化作用调控含硫蛋白的活性,实现信号的传导。一方面,GSNO能够储存和转运NO,对蛋白质(酶、受体、转录因子、离子通道等)进行转录后修饰,形成蛋白-Cys-SNO,即调控细胞内SNO的水平,对NO的信号传递过程进行微调;另一方面,GSNOR能够调控胞内GSNO/SNO的含量调控细胞的氧化状态。另外,H2O2和除草剂也能够抑制GSNOR的活性[31],即氧化胁迫能对GSNOR进行翻译后修饰,ROS对GSNOR活性的抑制可能是抵抗氧化胁迫的保护机制,这些表明GSNOR可能ROS与RNS的信号转导的交汇点。SNP(Sodium nitroprusside,NO)的供体和除草剂共同处理能够也提高野生型拟南芥对除草剂的抗性,可能是NO/SNO通过抑制GSNOR的活性抵抗氧化胁迫的一种机制,在马铃薯与水稻的研究中也得到了相同的结果[32]。NO与ROS的相互作用还表现在gsnor突变体在除草剂的处理下体内H2O2的含量下降,可能是NO直接清除ROS形成过氧亚硝基(ONOO-)的结果[32]。另外,ONOO-还可以通过抑制SOD降低H2O2的产生[33]。三叶草在镉的胁迫下,GSNOR活性提高,伴随着NO和GSNO含量的下降,改变植物体的氧化还原状态[21],诱导ROS、NO、过氧亚硝酸盐(ONOO-)和NADPH氧化酶、过氧化物酶和GSNOR的活性显著增加[34]。另外,在免疫反应过程中NO/SNO通过亚硝化抑制NADPH氧化酶的活性,降低ROS的产生[35]。最近的研究发现在拟南芥中抗坏血酸过氧化物酶1(APX1)的亚硝基化能增强其清除H2O2的能力,抵抗氧化胁迫[36]。豌豆在盐胁迫条件下亚硝基化也能增强APX1的活性[37]。
6 展望
S-亚硝基谷胱甘肽(GSNO)是一个天然的NO储存库,因此研究GSNOR在植物生长发育及胁迫反应中的作用机制,将有助于我们对NO生理功能的了解。最近的研究还证明GSNOR参与木质部微管细胞的分化过程[38-39],这表明我们对植物中GSNOR功能还知之甚少。在植物中GSNOR 基因的功能研究多局限于模式植物拟南芥中,且在多种胁迫条件下GSNOR的mRNA 和蛋白质表达水平相对稳定,因此蛋白质翻译后修饰水平是可能其酶活性调控的主要形式,进一步深入研究GSNOR影响的下游靶蛋白及靶蛋白亚硝基化修饰后功能的变化将是未来的一个研究方向。尽管大量的研究证明非生物胁迫调控GSNOR的表达,但还没有直接的证据证明活性氧(ROS)直接影响GSNOR的表达,更有可能是一个翻译后的修饰过程。GSNOR可能是ROS与RNS的信号转导的交汇点,尽管GSNOR参与调控细胞的氧化状态,但是细胞内各个部分的氧化状态不是完全一致的,因此,细胞器的氧化状态与GSNOR的关系将是未来的研究重点。
