补益心脾对产后抑郁症大鼠模型Th1/Th2平衡细胞免疫调节作用的影响
2018-11-29赵瑞珍李净娅杨歆科唐启盛
王 丹 赵瑞珍 曲 淼 李净娅 杨歆科 唐启盛
(北京中医药大学第三附属医院,北京,100029)
产后抑郁症(Postpartum Depression,PPD)是目前常见的继发性抑郁症之一。在国外发病率高[1-2],国内发病11.00%~23.25%[3]。由于患者产后处于哺乳期的特点,西药治疗有一定不良反应,而中医药疗法则具有独特的优势。本课题组前期研究发现[4-8],自拟参芪解郁方通过改善调节下丘脑-垂体-肾上腺轴和下丘脑-垂体-性腺轴、单胺类神经递质及其相关代谢产物的变化,达到治疗PPD的作用。近年来,随着抑郁症的免疫学病因的逐步揭示,T淋巴细胞介导的免疫平衡在妊娠期母体生殖免疫反应中发挥重要作用,而PPD发病与T细胞免疫调节的关系有待进一步研究。本研究拟采用激素注射后突然停撤法大鼠模型,进一步探讨PPD发病过程中机体免疫器官与免疫分子的改变,通过观察T细胞亚群及其表面分化抗原Th1、Th2的水平,阐释PPD发病过程中由T细胞免疫失衡介导免疫功能紊乱的机制;同时应用补益心脾中药参芪解郁方进行干预,明确该方剂对于PPD大鼠免疫系统T细胞亚群及其表面分化抗原的干预调节机制,近一步完善补益心脾法治疗PPD的中医药理论体系。
1 材料与方法
1.1 材料
1.1.1 动物 选取健康雌性SD大鼠90只,2月龄,SPF级,体重(200±10)g,购自北京维通利华实验动物技术有限公司(动物许可证号:SCXK(京)2012-0001),相对湿度:60%~70%,室温:20~22 ℃,光照周期:12 h(7:00-19:00),室内安静。
1.1.2 药物 参芪解郁方(党参12 g、郁金15 g、黄芪20 g等)配方颗粒来源北京康仁堂药业有限公司;盐酸氟西汀胶囊(礼来苏州制药有限公司,批号:2090A),20 mg;杭州动物药品厂苯甲酸雌二醇注射液(批号:140429),上海通用药业股份有限公司黄体酮注射液(批号:131014)。
1.1.3 试剂与仪器 北京博蕾德生物科技有限公司PBS稀释液,天津灏洋生物制品科技有限责任公司外周血淋巴细胞分离液,美国Biolegend公司的Cell Activation Cocktail(with Brefeldin A)、Alexa Fluor® 647 anti-rat CD3,FITC anti-rat CD4,PerCP anti-rat CD8a,PE anti-rat IFN-gamma,PE anti-rat IL-4,Cell staining Buffer,Fixation Buffer,Permeabilization Wash Buffer,杭州四季青生物工程材料有限公司胎牛血清;RPMI-1640培养基。
大鼠旷场测试箱:规格为80 cm×80 cm×40 cm,木质材料,底部及箱子内壁为黑色,底部分为25块等大方格(北京中医药大学中医学院中诊教研室)。OLYMPUS CKX41SF倒置式显微镜(日本OLYMPUS公司)、强迫游泳水缸:规格为高60 cm、直径25 cm的圆柱玻璃缸(自购)。流式细胞仪(美国BD公司,FACS Calibur Flow Cytometer System型);CO2恒温培养箱(美国Thermo公司)。
1.2 方法
1.2.1 分组与模型制备 购入大鼠进行适应性喂养1周后,对实验大鼠进行敞箱测试(Open-Field Test,OFT),根据评分结果筛选合格动物随机分正常组、模型组、中药组、西药组、假手术组,分别灌胃1、2、4周,每时间点每组6只。分组完成后,根据激素模拟妊娠状态突然停撤法[9](Hormone-simulated Pregnancy,HSP)制备模型。模型组、中药组、西药组(切除双侧卵巢),假手术组(只摘除大鼠卵巢周围少许脂肪),进行阴道涂片筛查挑选去势手术合格动物,前16 d对卵巢完全切除的大鼠皮下注射雌二醇注射液0.1 mL(2.5 μg)/d、黄体酮注射液0.2 mL(4 mg)/d,后7 d注射雌二醇注射液0.1 mL(50 μg)/d,于第24天停止注射;而假手术组在前16 d皮下注射芝麻油(0.3 mL/d),后7 d注射芝麻油(0.1 mL/d)。
1.2.2 干预药方法 在造模结束后对其进行药物干预,灌胃体积:1 mL/100 g。正常组、模型组及假手术组予以蒸馏水灌胃;西药组给予盐酸氟西汀胶囊(参照生药量0.25 mg/mL溶进蒸馏水,置于4 ℃冰箱备用,用前进行加热);中药组给予参芪解郁方(按成人用量的7倍估算大鼠用量,生药配比为1.25 g/mL);于1、2、4周分别进行行为学观察以及取材。
1.2.3 检测指标与方法 1)大鼠行为学评价:蔗糖水消耗实验:蔗糖水消耗量=测定前瓶质量-测定后瓶质量(g)。大鼠测试前均禁水24 h,再检测其1 h内蔗糖水(1%)的消耗量。
强迫游泳实验:强迫游泳桶内注水,保持水深35 cm左右,水温24~25 ℃。将大鼠放入水中,使其游泳15 min,结束后拭干。第2天在相同时间和相同条件下,再将大鼠放入注水的强迫游泳桶中游5 min,记录5 min中大鼠的静止状态的时间。
旷场实验:每次开始时将大鼠放至中心格,使其自由活动。记录5 min内大鼠的水平得分和垂直得分。其中水平得分为穿越的格数,以四肢都进入方格内为准;垂直得分为直立次数,以两前肢均需离地为准。为避免上次测试的大鼠残留信息如大小便、气味影响测试结果,大鼠检测完毕后使用70%乙醇清洗旷场箱的内壁及底面。
造模后1、2、4周观察模型组与正常组、假手术组行为学变化,明确造模成功;同时观察中药组、西药组对大鼠行为学变化的影响。
2)应用流式细胞术检测Th1、Th2的细胞比例:在麻醉的情况下,取4 mL新鲜大鼠腹主动脉血液,离心弃血浆后再加磷酸盐缓冲液(PBS)2 mL,混匀;取15 mL的离心管并加入5 mL淋巴细胞分离液,再以2 500 r/min速度离心20 min,吸取淋巴细胞层,使用RPMI-1640培养基洗涤2次,弃掉上清液;然后取外周血单个核细胞(Peripheral Blood Mononuclear Cells,PBMC)悬液100 μL;在每管加入Per CP抗大鼠CD4 2 μL,混匀后避光孵育30 min;把1×Cell Activation Cocktail(with Brefeldin A)4 μL和RPMI-1640培养基100 μL放入5%CO2,37 ℃的恒温箱中培养6 h;再入Cell Staining Buffer,2 mL;以2 000 r/min速度,离心5 min,4 ℃,去掉上清液,加Fixation Buffer0.5 mL后避光20 min并离心,2 000 r/min速度,持续5 min,4 ℃,去上清液;再加2次1×Permeabilization Wash Buffer1 mL;以2 000 r/min速度,离心5 min,4 ℃,弃上清液;加PE抗大鼠IL-4,2 μL和FITC抗大鼠IFN-γ,2 μL;避光静置,20 min并洗涤2次,Cell Staining Buffer2 mL;以2 000 r/min速度离心,持续5 min,4 ℃,去上清液再加1%多聚甲醛0.2 mL,固定,用锡纸包好待检测。

2 结果
2.1 行为学检测
2.1.1 蔗糖水消耗量测试 各时间点模型组大鼠蔗糖水消耗量均较正常组、假手术组降低,差异有统计学意义(P<0.05);各时间点中药组、西药组大鼠蔗糖水消耗量均较模型组有所升高,且2周、4周中药组、西药组较同时间点模型组升高明显,差异有统计学意义(P<0.05),而与正常组比较,差异无统计学意义(P>0.05),1周中药组大鼠蔗糖水消耗量较模型组虽有所升高,但差异无统计学意义(P>0.05),1周西药组大鼠蔗糖水消耗量较同时间点模型组升高,差异有统计学意义(P<0.05)。见表1。
2.1.2 强迫游泳不动时间比较 各个时间点模型组大鼠强迫游泳实验(Forced Swimming Test,FST)不动时间均较假手术组和正常组明显延长,差异有统计学意义(P<0.05);中药组、西药组大鼠FST不动时间各时间点均较模型组减少,2周、4周中药组、西药组较同时间点模型组减少明显,差异有统计学意义(P<0.05),虽然2周中药组、西药组的不动时间明显减少,与正常组比较,差异有统计学意义(P<0.05),但4周的中药组和西药组大鼠不动时间与正常组比较,差异无统计学意义(P>0.05),1周中药组和西药组大鼠FST不动时间较模型组虽有所减少,但差异无统计学意义(P>0.05),而与1周正常组、假手术组比较,差异有统计学意义(P<0.05)。见表2。

表1 5组蔗糖水消耗量比较
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
表2 5组强迫游泳不动时间比较
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
2.1.3 旷场测试结果比较 1)水平得分:各时间点模型组大鼠OFT的水平得分较同时间点假手术组和正常组比较均显著降低,差异有统计学意义(P<0.05);各时间点中药组和西药组大鼠的OFT水平得分较同时间点模型组明显升高,差异有统计学意义(P<0.05),但1周、2周中药组、西药组与同时间点正常组比较,差异有统计学意义(P<0.05),而4周中药组、西药组大鼠OFT的水平得分与正常组,差异无统计学意义(P>0.05)。见表3。

表3 各组大鼠不同时间点OFT水平得分比较分)
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
2)垂直得分:各时间点模型组大鼠OFT的垂直得分均较同时间点正常组、假手术组明显减少,差异有统计学意义(P<0.05);各时间点中药组、西药组大鼠OFT的垂直得分均较模型组增加,2周、4周中药组、西药组较同时间点模型组增加明显,差异有统计学意义(P<0.05),虽然2周中药组、西药组垂直得分明显增加,但与正常组比较,差异有统计学意义(P<0.05),而4周的中药组与西药组的垂直得分与正常组比较,差异无统计学意义(P>0.05),1周时中药组、西药组大鼠OFT的垂直得分较模型组虽有所增加,但差异无统计学意义(P>0.05),而与1周正常组、假手术组比较,差异有统计学意义(P<0.05)。见表4。

表4 5组大鼠OFT垂直得分比较分)
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
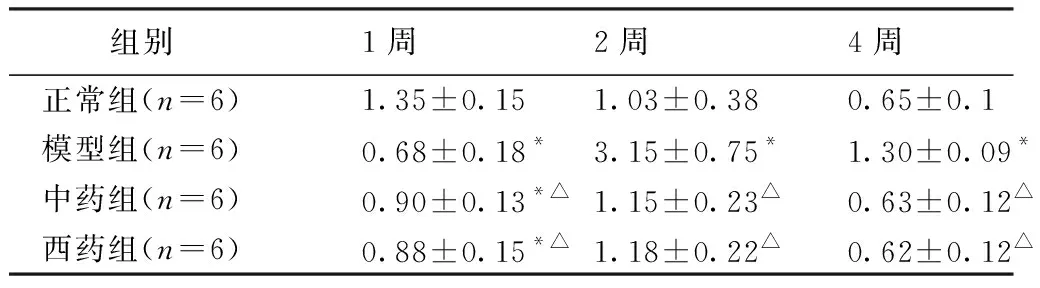
2.1.4 外周血Th1细胞和Th2细胞比例比较 1)外周血Th1细胞1周模型组大鼠外周血Th1细胞比例较正常组明显降低,差异有统计学意义(P<0.05),2周、4周模型组较同时间点正常组明显升高,差异有统计学意义(P<0.05);1周中药组、西药组大鼠外周血Th1细胞比例虽然较模型组升高,但1周西药组与模型组比较,差异有统计学意义(P<0.05),而1周中药组、西药组均与正常组比较,差异有统计学意义(P<0.05);2周、4周时中药组和西药组均与同时间点的模型组比较,差异有统计学意义(P<0.05),在2周时中药组和西药组与同时间点正常组比较,差异有统计学意义(P<0.05),而4周中药组、西药组与同时间点正常组比较,差异无统计学意义(P>0.05)。见表5。见图1。
表5 4组大鼠Th1比例比较
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
2)外周血Th2比例:1周模型组大鼠外周血Th2细胞比例较正常组明显降低,差异有统计学意义(P<0.05),2周、4周模型组较同时间点正常组明显升高,差异有统计学意义(P<0.05);1周中药组、西药组大鼠外周血Th2细胞比例虽然较模型组升高(P<0.05),但与同时间点正常组比较,差异有统计学意义(P<0.05);2周、4周中药组、西药组均较同时间点模型明显降低,差异有统计学意义(P<0.05),且与同时间点正常组比较,差异无统计学意义(P>0.05)。见表6。见图2。

图1 5组3个时间点大鼠外周血Th1流式细胞
组别1周2周4周正常组(n=6)1.35±0.151.03±0.380.65±0.1模型组(n=6)0.68±0.18*3.15±0.75*1.30±0.09*中药组(n=6)0.90±0.13*△1.15±0.23△0.63±0.12△西药组(n=6)0.88±0.15*△1.18±0.22△0.62±0.12△
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
3)外周血Th1/Th2比值:1周模型组大鼠外周血Th1/Th2比值较正常组升高,差异有统计学意义(P<0.05),2周、4周模型组较同时间点正常组明显降低,差异有统计学意义(P<0.05);1周中药组、西药组大鼠外周血Th1/Th2比值虽然较模型组降低,与模型组比较,差异无统计学意义(P>0.05);2周、4周中药组、西药组均较同时间点模型升高(P<0.05),且4周中药组、西药组升高明显,差异有统计学意义(P<0.05),而与同时间点正常组比较,差异无统计学意义(P>0.05);2周中药组、西药组虽较模型组升高,差异有统计学意义(P<0.05),但与同时间点正常组比较,差异有统计学意义(P<0.05)。见表7。
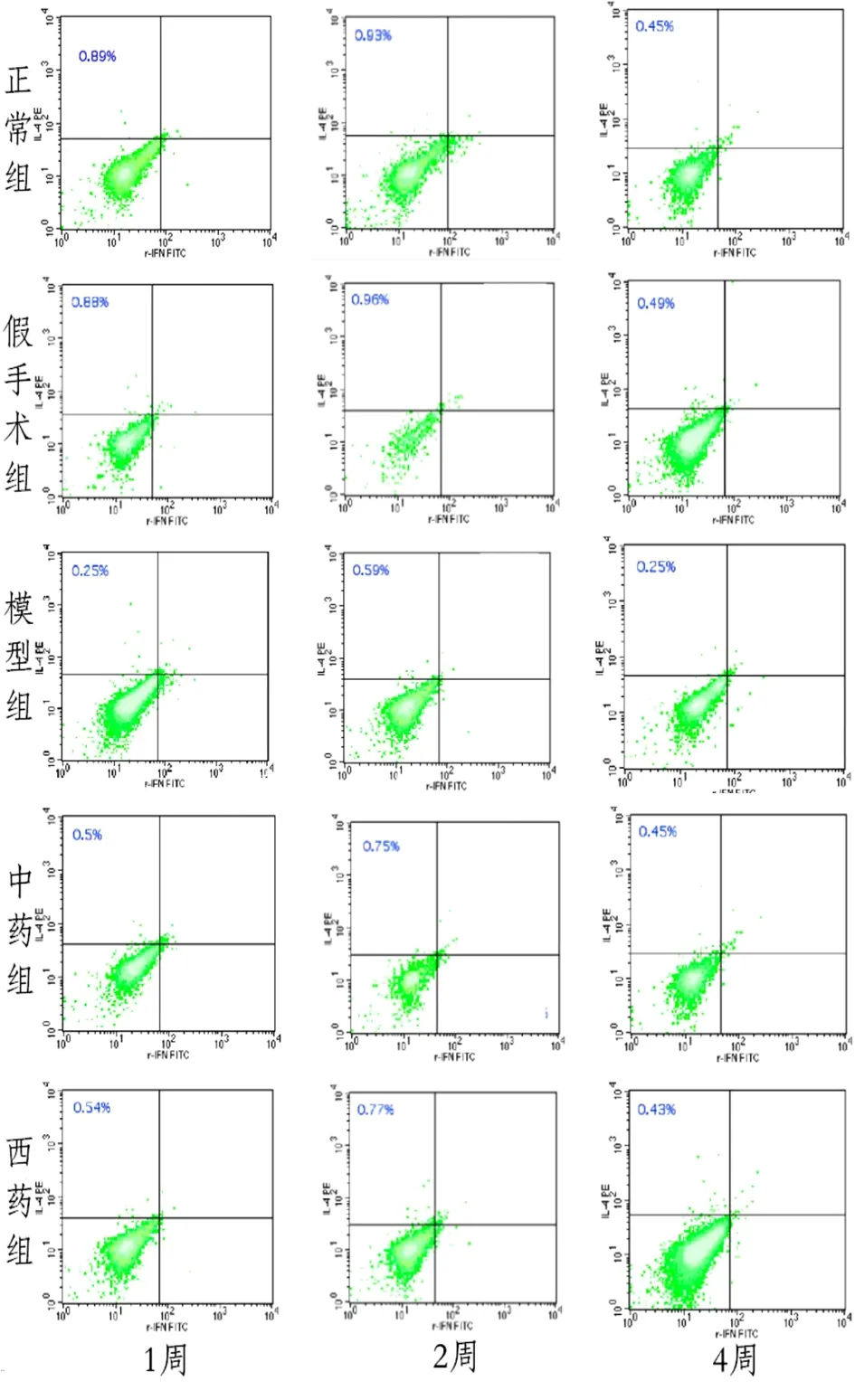
图2 5组大鼠外周血Th2流式细胞

组别1周2周4周正常组(n=6)4.86±0.665.87±2.338.08±1.59模型组(n=6)6.13±1.53*2.24±0.95*4.73±0.22*中药组(n=6)4.97±0.474.19±0.69*△8.39±1.65△西药组(n=6)5.21±1.054.14±0.79*△8.64±1.53△
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
3 讨论
辅助性T细胞Th1和Th2(helper T cell,Th),是初始CD4+T细胞2种不同功能的亚群,均来自于共同的前体细胞Th0。Th1与Th2细胞是Th0细胞发展的2种形式。而IFN-γ、IL-2和IL-4都参与Th1/Th2细胞因子的调节作用。近些年来,发现Th细胞亚群及其细胞因子对于心理应激及抑郁症的发病及治疗中具有重要作用。现有研究主要集中在探讨抑郁症与Th1/Th2平衡状态的相关性方面,多数学者认为抑郁症以Th1/Th2比值升高为特点,表现为促炎性反应为主。Myint等[10]研究表明,抑郁患者存在Th1和Th2细胞因子的失衡状态。亦有学者通过观察IL-1β/IL-10的比值来反映急性期抑郁症患者Th1/Th2平衡状态,结果可见抑郁患者IL-1β/IL-10的比值明显升高,说明Th1/Th2失衡对急性期抑郁症发病起重要作用[11]。目前有关PPD发病与Th1/Th2平衡状态的关系报道相对较少,新近有学者发现,产后精神病患者Th1细胞数在产后4周时明显降低[12]。
本研究中实验HSP大鼠模型Th1细胞比例在造模后1周时明显降低,差异有统计学意义(P<0.05),2周和4周时明显升高,差异有统计学意义(P<0.05),同时模型组大鼠行为学评分与正常组、假手术组比较,差异有统计学意义;中、西药物治疗4周时恢复正常;Th2细胞比例在各时间点均明显减少,差异有统计学意义(P<0.05),经中药、西药干预4周后恢复正常;Th1/Th2比值在各时间点均明显升高,差异有统计学意义(P<0.05),治疗4周后恢复正常。在Th1、Th2以及Th1/Th2的数量变化上,中药组和西药组在1、2、4周时所显示出的变化趋势均为第1周接近模型组,即以手术后引起的变化为主。而随着时间延长,这种数量变化水平逐渐接近正常组,即以药物的干预作用为主;同时,在大鼠行为学变化,即蔗糖水消耗量、强迫游泳不动时间、OFT水平得分及垂直得分上,中药组、西药组这种变化趋势也符合其Th1、Th2以及Th1/Th2比值的变化趋势,这说明大鼠外周血细胞中Th1、Th2以及Th1/Th2的数量变化可以直接或间接影响大鼠行为学变化,即影响其抑郁变化水平;而中药、西药组即通过调整大鼠外周血Th1、Th2以及Th1/Th2的数量变化而影响大鼠行为学变化,对大鼠的抑郁状态进行干预;同时,上述结果也说明,PPD大鼠Th1和Th2细胞比例较正常大鼠均有不同,主要体现在以Th1细胞比例先降低后再升高,在造模后1周时Th2细胞比例降低,Th1/Th2比值升高,进一步表明在造模后1周时,PPD大鼠体内主要以炎性反应为主。在造模后2周和4周时间点,HSP大鼠Th2细胞比例降低,Th1/Th2比值升高,大鼠与造模1周时相同,均以促炎性反应为主,进一步表明HSP模型大鼠处于炎性反应状态。
Th1和Th2细胞亚群是一组动态平衡的细胞因子,一旦失去平衡则可出现相关免疫学病理产物,从而引发疾病。近年研究发现,正常机体Th1和Th2细胞间保持着类似于“阴阳消长”的动态平衡,亦与中医学虚实变化相契合[13-14]。有学者认为,实证与虚证时的失衡状态有规律可循[15]:当Th1型细胞因子占优势时,表现为细胞免疫亢进,产生炎性反应与实证表现;当Th2型细胞因子占优势时,提示免疫抑制与虚证表现。相关实验研究表明,实证与虚证时的Th1/Th2失衡状态具有一定的规律性。有学者通过RT-PCR检测小鼠脾单个细胞核中Th1/Th2 2类细胞因子的表达,发现阴虚和阳虚小鼠2类细胞因子的表达均受到明显抑制,差异有统计学意义(P<0.05),阳虚小鼠Th1类细胞因子IFN-γmRNA抑制率明显高于阴虚小鼠,差异有统计学意义(P<0.05),IFN-γ/IL-10比值显著增高(P<0.05),实验表明阴阳失调小鼠Th1/Th2平衡发生漂移,阴虚小鼠较阳虚小鼠的Th1类细胞因子处于相对的表达优势[16]。有学者应用四君子汤干预脾虚证大鼠,观察其Th1/Th2平衡状态的变化,发现大鼠IFN-γmRNA的表达显著降低;而IL-4mRNA的表达却明显升高,Th2细胞占据优势[17];在由四君子汤干预后,IFN-γmRNA的表达上调,而IL-4mRNA的表达则下调至正常水平。此外,补中益气汤也能够削减Th2的优势,调节机体Th1/Th2的平衡,进而可以治疗时中气虚等证[18]。有学者亦指出阴虚证、阳虚证共同表现为Th1/Th2比值降低[19],阴阳失调时Th1/Th2比值升高。据此可以推测,实验中HSP模型大鼠在造模后1周、2周和4周时外周血Th1/Th2比值升高,向Th1型细胞因子偏移,提示此模型PPD大鼠可能处于本虚标实状态;体现了PPD由本虚标实证向本虚证转化的动态过程,与中医学理论相契合,而通过中医补益心脾法治疗其Th1/Th2失衡状态效果显著。由此亦可认为,以补益心脾法遣方而成之参芪解郁方在治疗PPD本虚标实证状态时,可通过削弱Th1优势引发的促炎性反应而发挥作用;而对于PPD本虚证状态时,是通过削减Th2优势产生的抑炎性反应,调节机体Th1/Th2的失衡状态,从而对PPD的疾病过程发挥补益心脾,调气祛瘀,颐脑醒神的作用,而正是通过这一系列免疫调节从而发挥其治疗作用。
