类乌齐牦牛乳酸脱氢酶基因克隆及组织表达
2018-11-29柴志欣信金伟姬秋梅钟金城
黄 兴,柴志欣,王 会,信金伟,姬秋梅,钟金城
(1.青藏高原动物遗传资源保护与利用教育部重点实验室,成都 610041;2.西藏自治区农牧科学院 省部共建青稞和牦牛种质资源与遗传改良国家重点实验室,拉萨 850009)
乳酸脱氢酶(Lactate dehydrogenase,LDH)是一种广泛存在于脊椎动物、植物和细菌中的寡聚酶[1],能够催化乳酸转化成丙酮酸进入三羧酸循环彻底氧化分解。LDH 是由LDHA和LDHB 2 个亚基组成的四聚体酶,LDHA基因编码M 亚基,LDHB基因编码H 亚基,两者按不同比例组成 5 种同工酶。研究发现,乳酸脱氢酶是一种含锌的糖酵解酶,几乎存在于所有组织中,心、骨骼肌和肾脏最丰富,其次为肝、脾、胰腺、脑、肺脏等,体内分布具有明显的组织特异性[2]。普通牛LDHB基因位于 5 号染色体,包括 7 个外显子,CDS区全长1 005 bp。同时,LDH 与肿瘤关系密切,敲除LDHB基因可抑制HeLa细胞生长,下调LDHB的表达水平可能有助于宫颈癌的治疗[3]。王光庆等[4]利用免疫组化SP法检测72 例结肠癌组织(CC组)及72例结肠组织(对照组)中的LDHB蛋白,结果两组差异有统计学意义(P<0.01),进一步分析发现LDHB蛋白在结肠癌细胞癌性组织中的表达低于非癌性结肠组织,其表达可能与结肠癌的发生有关。目前,在人[5]、鼠兔[6]、鼠[7]等物种开展相关研究,而牦牛上鲜见报道。在牦牛上发现编码 LDH1H 亚基的LDHB基因存在多态性,理论上会形成杂合基因型,并导致 LDH1 等同工酶谱带型复杂化[8],而这种LDH特殊带型是由Ldhb-F和Ldhb-S杂合型基因编码[9]。LDHB基因编码H亚基的单碱基突变形成2种突变型[10],也证实这一观点。此外,对79头麦洼牦牛检测发现存在Ldhb-AA 和Ldhb-AG 2 种基因型[11]。
牦牛能适应缺氧等极端生态环境[12-13],是高海拔地区畜牧业的主要畜种,为当地牧民提供生产和生活资料。西藏作为中国牦牛的主产区,其独特的地理位置和环境因素形成许多地方品种(类群)[14-15],牦牛遗传资源十分丰富。类乌齐俗称西藏“小瑞士”,山清水秀,鸟语花香,泉水潺潺,青草萋萋,形成优良的牦牛类群。世界牦牛看中国,中国牦牛看西藏,西藏牦牛看类乌齐。类乌齐牦牛遗传多样性丰富,生活环境海拔高,肉质鲜美,于 2017 年通过国家畜禽资源委员会鉴定,成为优良牦牛遗传资源[16]。本研究通过类乌齐牦牛LDHB基因的克隆及组织表达,为其与高海拔地区极端低氧适应性调控及能量代谢功能的遗传机制研究奠定基础。
1 材料与方法
1.1 材 料
1.1.1 样本采集 在西藏自治区昌都市类乌齐县选取 4.5 岁健康的类乌齐牦牛 3 头,分别采集心脏、肝脏、肺脏等组织,DEPC冲洗,锡箔纸包装后迅速置于液氮保存,备用。
1.1.2 主要试剂与分析软件 Trizol(life technologies公司)、RNA提取试剂盒(TIANGEN公司);琼脂糖(Amresco公司)、DL2000 DNA ladder(Biomiga公司)、反转录试剂盒(TIANGEN公司)、DNA纯化试剂盒(TIANGEN公司)、RNase-Free ddH2O、pMD19-T载体(TaKaRa公司)、DH5α感受态细胞等。
分析软件有DNAStar;MEGA.6;ProtPar:https://web.expasy.org/protparam/;
ORF Finder:https://indra.mullins.microbiol.washington.edu/sms2/orf_find.html;
ExPASy-ProtScal:https://web.expasy.org/protscale/;
SOPMA:https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html;
PHYREZ:http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=inde;Raswin;
EMBOSS:cpgplot:http://emboss.bioinformatics.nl/cgi-bin/emboss/cpgplot;
NetPhos3.1Server:http://www.cbs.dtu.dk/services/NetPhos/;
Conserved Do-main Search Service:https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi;
PSORT Prediction:https://psort.hgc.jp/form2.html;
PredictProtein:https://www.predictprotein.org/。
1.2 方 法
1.2.1 总RNA提取及反转录 称取 80~110 mg组织样品于研钵中,液氮中研磨,将研磨好的组织迅速转移到含Trizol裂解液的离心管,按试剂盒说明提取组织总RNA,15 g/L琼脂糖凝胶电泳检测RNA质量。采用分光光度计测定RNA样品的质量浓度及OD260nm/OD280nm值。利用DNaseⅠ去除残留DNA,用反转录试剂盒反转录成cDNA,15 g/L琼脂糖凝胶电泳检测质量,4 ℃保存,备用。
1.2.2 引物设计与合成 根据GenBank公布的普通牛LDHB基因序列(No:AC_000172),利用Primer Premier 5.0软件设计特异性引物(表1),引物由英潍捷基(上海) 生物技术有限公司合成。

表1 类乌齐牦牛LDHB基因的引物Table 1 Primers of LDHB gene in Leiwuqi yak
1.2.3 牦牛LDHB基因的克隆 以反转录产物为模板,PCR扩增体系(25 μL):ddH2O 9.5 μL、上下游引物各1 μL、DNA模板1 μL、TaqGreen PCR Master Mix(2×,1.25 mL) 12.5 μL。PCR反应程序:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸80 s,循环35次;72 ℃延伸10 min,4 ℃保存。PCR产物用15 g/L琼脂糖凝胶电泳检测,利用DNA纯化回收试剂盒回收PCR产物,4 ℃保存,备用。
1.2.4 目的片段的TA克隆与鉴定 回收纯化后的PCR产物在4 ℃下与pMD18-T载体过夜连接,将连接产物转化至DH5α感受态细胞,筛选阳性克隆,送上海生物工程技术有限公司测序。
1.2.5 RT-PCR分析 反应体系20 μL:10 μL SYBR premix Dimer Eraser(2×),上下游引物各0.8 μL,无菌去离子水6.8 μL,cDNA稀释2~3倍后取1.6 μL。定量程序:95 ℃预变性30 s;95 ℃变性5 s,55.2 ℃退火30 s,72 ℃延伸30 s,40个循环。同一牦牛个体的心、肝、肺分为 3 组,每组样品 3 个重复。反应结束后以熔解曲线来判定RT-qPCR反应的特异性,获得每个样品的Ct值, 以GAPDH作为内参基因,采用2-△△Ct法计算各个样本的相对表达水平。
1.2.6 生物信息学分析 利用NCBI中ORF Finder程序对类乌齐牦牛LDHB基因进行开放阅读框分析,利用DNAStar软件分析碱基组成。运用SOPMA、PHYREZ、Raswin等在线软件预测LDHB基因二、三级结构。利用EMBOSS分析LDHB基因的CPG岛、跨膜结构、磷酸位点、蛋白保守结构域等,PSORT Prediction在线软件对亚细胞定位进行预测和分析;利用MegAlign和MEGA.6软件进行同源性比对和系统进化树构建。
2 结果与分析
2.1 总RNA质量检测及LDHB基因的克隆
总RNA经15 g/L琼脂糖凝胶电泳检测,存在18 S和28 S条带(图1),宽度和亮度基本接近1∶2,表明RNA完整性良好。反转录产物检测到大小约1 000 bp的片段(图2),条带清晰,与预期扩增片段大小(1 079 bp)吻合,有少量杂带,切胶回收后,对PCR扩增条件优化,确认无误后送公司测序。

图1 牦牛提取组织总RNA琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of total RNA of yaks
2.2 LDHB基因的序列分析
类乌齐牦牛LDHB基因存在 6 个开放阅读框,参照Kozak法则,获得 1 个1 005 bp的ORF(图3),起始密码为ATG,终止密码为TGA,对应氨基酸序列分别为M、L,共编码 334 个氨基酸,碱基含量分别为:A 25.13%、G 20.20%、T 28.46%、C 26.21%,基因编码区G+C含量(46.41%) 低于A+T含量(53.59%)。与NCBI的家牦牛序列(HQ874654.1)比对, 3 头类乌齐牦牛均存在362、466 bp 2 处突变,突变导致密码子AAG→GAG(赖氨酸→谷氨酸)、ATC→AGC(异亮氨→丝氨酸)。应用DNAstar软件将LDHB基因氨基酸序列与家牦牛相应氨基酸序列(ABJ97276.1)进行比对,两者同源性为99.7%。

M.DL2000 DNA marker;1.PCR产物 PCR amplicons of LDHB;2.DNA 纯化回收 Purification recycling of DNA;3.菌液PCR产物 Amplicons of bacteria liquid PCR
2.3 LDHB基因编码蛋白的理化性质
利用ProtParam软件进行预测,LDHB基因编码蛋白带负电的残基(Asp + Glu)为 39个,带正电的残基 (Arg + Lys)为 35 个,其中缬氨酸(Val)与亮氨酸(Leu)最多,分别为 37和 36个,占整个氨基酸组成的11.10%和10.80%(表2)。蛋白分子质量为36.72 ku,总原子数为5 234,理论等电点(PI)为6.02。消光系数[r=280 nm/(mol·cm) ]为43 680,不稳定指数26.87,表明这类蛋白质较稳定,脂溶系数109.04,亲水性平均值为0.04,此蛋白为疏水性蛋白。
运用ExPASy-ProtScale在线分析软件,获得类乌齐牦牛LDHB基因编码蛋白的亲水性/疏水性(图4),第 292 位亮氨酸疏水性最强(Max=2.556),第 226 位谷氨酸亲水性最强(Min=-2.956),LDHB含有较强的疏水区域,是不可溶蛋白。
运用SOPMA 在线软件预测类乌齐牦牛LDHB基因的二级结构,其中162个氨基酸构成α-螺旋、67个为延伸链,分别占48.50%、20.06%,有35和70个氨基酸为β-转角和无规则卷曲,分别占10.48%和20.96%(表3),说明牦牛LDHB基因编码蛋白为混合型蛋白质。应用PHYREZ在线软件和Raswin软件预测LDHB正值表示疏水,负值表示亲水,窗口大小为n=9 Positive value indicates hydrophobicity,negative value indicates hydrophilic,window size withn=9编码蛋白,发现其主要由无规卷曲、α-螺旋和β-转角在空间上盘绕,折叠形成,与二级预测结构基本一致(图5)。

图3 类乌齐牦牛 LDHB 基因ORF序列及其编码氨基酸序列Fig.3 Nucleotide sequence and amino acid sequence of LDHB ORF region in Leiwuqi yak
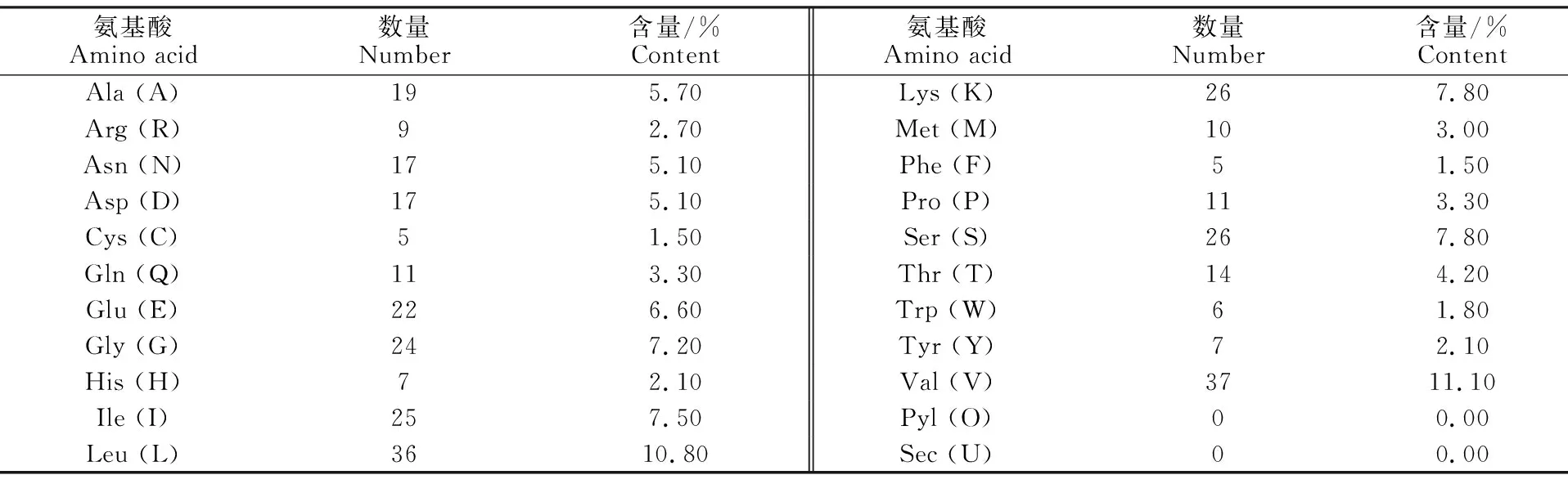
表2 类乌齐牦牛LDHB基因编码蛋白氨基酸组成Table 2 Amino acid profile of LDHB in Leiwuqi yak

图4 类乌齐牦牛LDHB编码蛋白的疏水性/亲水性预测Fig.4 Hydrophobic / hydrophilic analysis for LDHB in Leiwuqi yak
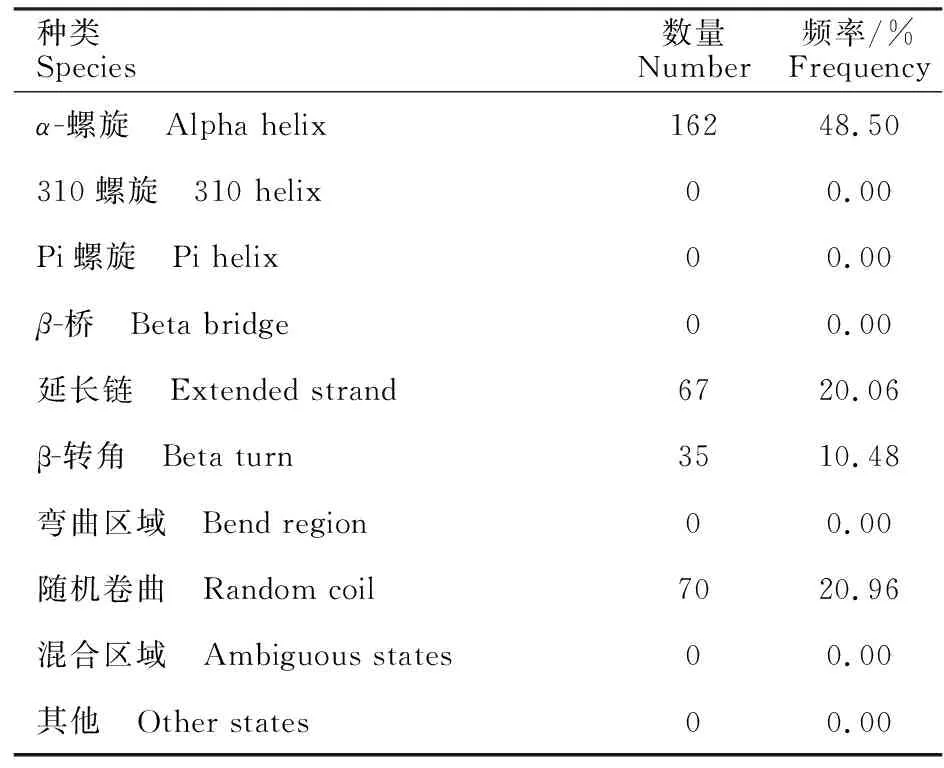
表3 牦牛LDHB基因二级结构频率预测Table 3 Secondary structure frequency prediction for yak LDHB
2.4 蛋白结构功能预测
2.4.1LDHB基因跨膜区结构预测 在LDHB基因中未发现CpG岛,运用 TMpred预测蛋白质跨膜区和跨膜方向,存在多个跨膜区域,其中最优跨膜区域两处,分别是序列位置为24、42(19),螺旋形式以里向外,长度得分为1 375和序列位置为126 149(24),螺旋形式由外向内,长度得分550的同时TM-螺旋长度预测为17~33,如图6。

图5 类乌齐牦牛LDHB蛋白三级结构预测Fig.5 Putative tertiary structure of LDHB in Leiwuqi yak
2.4.2 磷酸位点分析 运用NetPhos 3.1 Server在线分析软件对LDHB基因编码序列的磷酸化位点进行预测,发现其编码蛋白共含有 23 处磷酸化位点。其中Serine磷酸化位点15 处,Threonine磷酸化位点6 处,Tyrosine磷酸化2 处,不含有Threshold磷酸化位点(图7)。
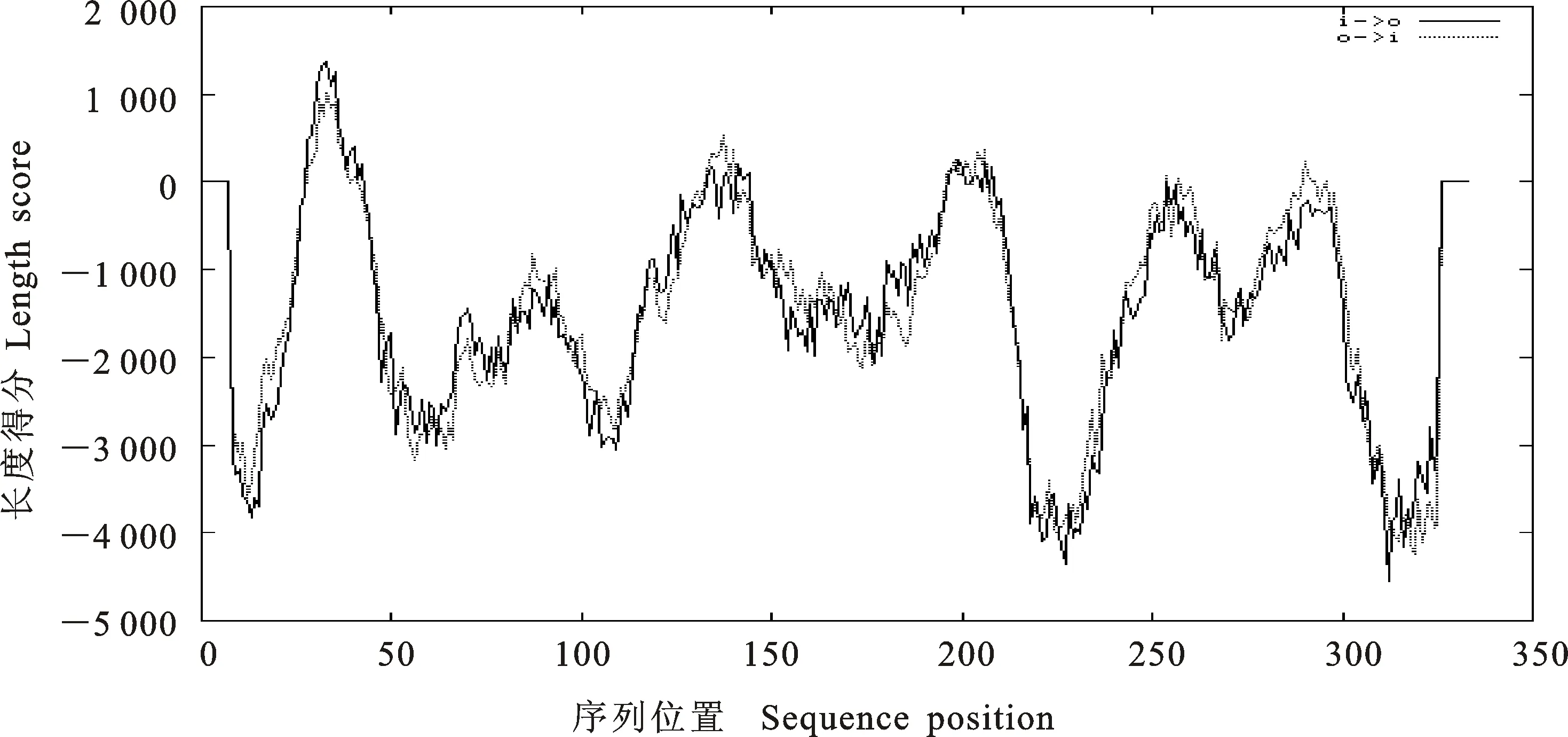
i.在里面 Inside;o.在外面 Outside;只有分值达到500以上才有效 Only scores above 500 are considered significantly
2.4.3 蛋白质保守结构域 运用NCBI 中[Conserved Do-main Search Service ( CD Search) ]在线分析LDHB基因的蛋白质保守结构域,发现 1 个保守功能结构域,为NADB Rossmann superfamily结构域(图8),通过Rossmann折叠与NADPH结合。在糖酵解等许多代谢途径的脱氢酶中均发现这种结构域,与NADPH结合时常涉及许多氢键和范德华力。
2.4.4 蛋白质功能分析 PSORT Prediction分析发现,LDHB基因编码的蛋白分布于内质网、线粒体、细胞质、细胞核和高尔基体,其中在内质网中分布最多。该蛋白在L-乳酸脱氢酶活性、蛋白质结合、L-苹果酸脱氢酶活性、NAD或NADB结合,以及与自身相同的蛋白结合等一系列生物合成过程中发生作用,但在糖酵解、氧化还原等过程中发挥主要作用(表4)。

图7 类乌齐牦牛LDHB基因编码蛋白的磷酸化位点分析Fig.7 Phosphorylation site analysis of LDHB Protein in yak

图8 类乌齐牦牛LDHB基因结构域预测Fig.8 Structural domain prediction of LDHB gene in Leiwuqi yak

表4 LDHB基因功能分析Table 4 Functional analysis of LDHB gene
2.5 构建系统进化树
为进一步研究类乌齐牦牛LDHB基因的进化过程,利用MegAlign软件分析其与其他18个物种该基因氨基酸序列的同源性(表5),并用MEGA.6软件构建系统进化树(图9)。结果表明,类乌齐牦牛与九龙牦牛、普通黄牛的氨基酸序列同源性最高,亲缘关系最近,表明发育树与其物种进化树基本一致,符合物种的进化规律。其次为山羊、宽吻海豚、猪、马、羊驼、野生双峰骆驼等;与鸡、乌鸦、非洲爪蟾、鲤鱼亲缘关系较远。
2.6 RT-qPCR分
RT-qPCR定量分析表明(表6),利用Spass 22.0进行单因素方差分析。选择Duncan’s法进行各组织间的多重比较,发现LDHB基因在类乌齐牦牛的心脏和肺脏组织中表达水平较高,在肝脏中最低,在肺脏中的表达水平显著高于其他组织(P<0.05),心脏组织中的表达水平也显著高于肝脏(P<0.05)(图10)。
3 讨 论
青藏高原环境独特,物种丰富,是一个宝贵的遗传资源库,而牦牛作为青藏高原的特殊物种对生态环境具有极强适应力,因此以牦牛为研究对象,探讨牦牛低氧适应性的分子机制和调控网络具有重要的理论和实际意义。脱氢酶类是生物体内参与氧化还原反应的重要催化剂之一,在生物解毒、氧化产能、Cori循环等过程发挥重要作用[17-18],其中以乳酸脱氢酶类为代表,这类酶分子质量为130 000~145 000 u,是一类存在LDH1~LDH5 5 种分子形态的同工酶[19-20]。其中LDH5占主要优势,研究报道藏系绵羊骨骼肌、心肌的LDH 同工酶谱中LDH5的含量高于其他4种同工酶[21]。目前,关于牦牛LDHB基因的研究大部分建立在常规同工酶的基础上,难以获得丰富的遗传参数,因此本研究通过对类乌齐牦牛LDHB基因的克隆及生物信息学分析,并获得其在不同组织中的差异表达情况,为进一步分析LDHB基因的功能及表达调控机制提供基础数据。

表5 牦牛与18个物种LDHB基因的序列同源性比对Table 5 Homology comparing of Nucleotide sequences of LDHB between yak and other 18 species %
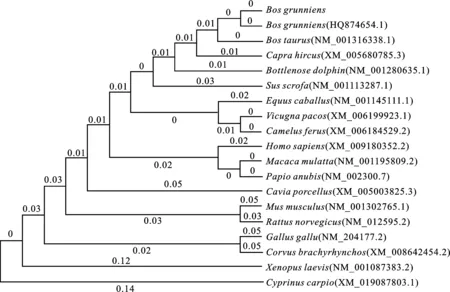
图9 19个物种的LDHB基因系统进化树Fig.9 LDHB gene phylogenetic tree of 19 species

表6 LDHB基因在牦牛不同组织器官中的实时荧光定量Table 6 RT-qPCR of LDHB gene in different tissues and organs of yak

图10 牦牛LDHB基因的mRNA组织表达分析Fig.10 mRNA expression of LDHB gene in various tissues in yak
类乌齐牦牛LDHB基因开放阅读框共编码 334 个氨基酸,与九龙牦牛序列(HQ874654.1)比对,存在2处突变(赖氨酸突变成谷氨酸,异亮氨酸突变成丝氨酸)。赖氨酸和异亮氨酸是人体或其他脊椎动物的必须氨基酸,谷氨酸是一种酸性氨基酸,在生物体内的蛋白质代谢过程中发挥重要作用,参与动物、植物和微生物中许多重要化学反应,同时是重要的鲜味剂,对香味具有增强作用,这与类乌齐牦牛肉质鲜美、口味独特可能存在联系。相关研究证明谷氨酸能改善肉质性状,如对鸡 CACNA1S基因单核苷酸多态性及其与肉质性状的关联性分析发现谷氨酸含量能影响鸡肉品质[22];对延边黄牛 PRKAG3基因第10外显子单核苷酸多态性及其与肉质性状的相关分析发现谷氨酸与该基因呈正相关,影响肉质[23]。通过对青海牦牛肉营养品质分析可知牦牛肉相较于黄牛肉组氨酸、谷氨酸、精氨酸、丙氨酸、天门冬氨酸、甘氨酸的含量较高,揭示青海牦牛肉品营养丰富、肉质优良的内在特性[24],以上相关研究均证明谷氨酸与肉品质及风味存在显著关联。丝氨酸作为非必须氨基酸,在脂肪和脂肪酸新陈代谢及肌肉生长中发挥作用,在猪[25]和山羊[26]等研究中得以证实。此外,丝氨酸有助于免疫血球素和抗体的产生,使免疫系统免受侵害以维持其健康的免疫环境,类乌齐县类乌齐牦牛位于西藏自治区昌都市,较平原地区气候及生态环境更为恶劣,而本研究发现LDHB基因中丝氨酸含量较多,推测这有助于增强当地牦牛的免疫力,以适应当地恶劣环境。
通过对类乌齐牦牛LDHB基因编码蛋白的理化性质分析发现,缬氨酸和亮氨酸占比最大,缬氨酸与异亮氨酸、亮氨酸共同促进机体正常生长,修复组织,调节血糖,并提供需要的能量[27],这与LDHB基因参与生物氧化还原反应一致。该编码蛋白半衰期较长,是一类稳定蛋白,推测该蛋白能够稳定高效持续参与机体代谢过程,不易被降解,在酪蛋白源降血压肽稳定性及抑制作用机理研究中也有类似发现[28]。LDHB有较强的疏水区域,是不可溶蛋白,具备作为一类信号分子的基本结构,可参与生物代谢调控,L-乳酸脱氢酶催化反应机理研究中发现该蛋白首先与辅酶(NAD+)结合为二元复合物的信号分子,待反应结束,释放蛋白,完成催化[29]。该蛋白二级结构和三级结构主要以无规则卷曲、 螺旋、 转角为基础进一步在空间上延伸,其中α-螺旋高达48.50%,作为一种混合类蛋白,推测这种结构影响该蛋白在糖酵解或氧化还原中的信息传递。LDHB基因编码蛋白存在多处跨膜结构域,这种结构域连接细胞膜内外的部分,同时能够影响信号传递。存在 23 处磷酸化位点,蛋白质磷酸化是调节和控制蛋白质活力和功能最基本、最普遍,也是最重要的机制[30-31],说明该蛋白在细胞信号传导的过程中起重要作用。
在亚细胞定位中发现LDHB基因编码蛋白在内质网和线粒体中占比最大。LDHB基因编码蛋白是一种分泌蛋白,同时也是一种跨模蛋白,分泌蛋白和跨膜蛋白均在内质网中合成。而线粒体是细胞中制造能量的重要结构,是细胞进行有氧呼吸的主要场所。LDHB基因编码蛋白是参与有氧呼吸的关键酶,作为氧化还原的主要场所,LDHB基因编码蛋白所占比例较大与线粒体主要功能保持一致。功能预测表明,该蛋白主要以辅酶或激酶的形式参与调控[18-20]。通过构建物种进化树,类乌齐牦牛与九龙牦牛、黄牛同源性最高,同源性在一定程度上反映出物种间同一基因序列的保守性,说明在漫长进化过程中,LDHB基因编码区具有较强的保守性。此外,发现宽吻海豚LDHB基因的编码序列与牦牛的同源性高达95.12%,同时发现其与普通黄牛、山羊的亲缘性较高,这种关系是否能证明海豚这一水生哺乳动物曾经是一种陆生、类似反刍动物的推论还有待进一步研究。
组织表达结果表明LDHB基因在肺中的表达水平远高于其他组织,肝脏中表达水平最低。在心脏中的表达水平也较高,这与LDHB基因编码的H亚基主要在心脏中被发现有关[32],同时心脏中主要以H亚基为主[33]。而在肺组织中LDHB基因表达水平最高,可能与肺作为一个主要的呼吸器官有关,类乌齐牦牛生活在平均海拔4 000 m的高海拔区域,其肺组织为适应低氧环境发生适应性改变,也从另一方面证实LDHB基因对牦牛低氧适应性存在调控作用;同时,LDH中M亚基和H亚基含量受组织中氧浓度的调节,氧浓度越高H亚基越高,M亚基越少[34]。肝脏、心脏、肺脏组织氧浓度依次增加,LDHB基因编码的H亚基表达水平也随之增加,低氧限制LDHB基因的表达,在大鼠中得到证实[32]。
4 结 论
通过对类乌齐牦牛LDHB基因克隆及序列分析,结合不同组织表达分析,系统阐述LDHB基因的理化性质、结构功能,进一步完善牦牛能量代谢调控机制的试验参数,为牦牛LDHB基因低氧适应性的遗传特性研究提供理论依据,同时也为西藏优良牦牛品种相关生物学功能研究提供新的数据资料。
