利用分子跟踪检测和滚动回交创制转基因矮败小麦抗旱新种质
2018-11-29王文静张增民张萌琪闵东红陕西省农业机械鉴定推广总站西安70068陕西省富平县种子技术推广中心陕西富平7700
王文静,张增民,张萌琪,闵东红(.陕西省农业机械鉴定推广总站,西安 70068;.陕西省富平县种子技术推广中心,陕西富平 7700;
3.长春师范大学 生命科学学院,长春 130032;4.西北农林科技大学 农学院,陕西杨凌 712100)
小麦是世界重要的粮食作物,是中国城乡居民的主要口粮作物。目前,中国有60%以上的小麦主要分布在干旱与半干旱地区,随着全球气候变暖与生态环境的恶化,中国旱地面积和干旱程度不断扩大和加剧,对中国小麦的生产将产生更加严峻的考验。因此,通过遗传改良提高小麦对干旱、盐碱等环境胁迫的耐受性显得更加迫切[1-3]。由于常规育种技术与方法的局限性,通过常规育种途径创制抗旱种质难以在短期内满足作物遗传改良对抗旱种质的需求,因此,挖掘抗逆基因,通过基因工程途径,结合有限回交、滚动回交等常规育种技术手段创制小麦抗旱新种质对改良品种抗旱性具有重要作用[4-8]。近年来,中国相继在水稻和小麦等作物上利用遗传转化获得的具外源基因的转基因植株,结合常规回交转育和轮回选择创制了一批抗虫抗旱的转基因材料[9-11]。
矮败小麦的成功创制为开展小麦的轮回选择育种和相关遗传研究提供了重要的遗传工具[12-17],利用矮败小麦育种技术可以大幅度地提高杂交效率,快速培育具有目标性状的导入系,利用分子标记辅助手段构建轮回选择群体,实现多个目标基因在优良遗传背景下的聚合,加快作物重要性状的改良速度,缩短转基因回交品系的选育时间,起到事半功倍的效果[5,15,18]。近年来利用矮败小麦遗传改良工具开展转基因材料的轮回选择育种研究,已取得了卓有成效的进展[19]。本研究以农艺性状全面、具备矮败小麦特征的‘矮败周麦18’小麦为受体,以T4代转抗旱相关转录因子基因的小麦株系为供体,采用杂交、回交与滚动回交方法,开展抗旱转基因矮败小麦种质创制,以期为抗旱转基因矮败小麦轮回选择群体构建和相关转基因育种技术与方法研究奠定一定的材料与方法基础。
1 材料与方法
1.1 材 料
1.1.1 供体材料 T4代转基因小麦株系‘G新春9号’(TaEBP)、‘G鲁麦23-69’(GhDREB)、‘G鲁麦14-299’( GmDREB1)、‘G石4185’( GmDREB3),基因的功能验证及转基因植株抗逆性鉴定结果表明,这些基因的超表达能够显著提高转基因植物、特别是转基因小麦的非生物胁迫抗性[16-21],是小麦抗逆遗传育种和抗逆种质创新的重要基因资源,转基因供体材料均由中国农科院作物科学研究所马有志课题组提供。
1.1.2 受体材料 ‘矮败周麦18’由中国农业科学院作物科学研究所矮败小麦育种课题组周杨研究员馈赠,该材料是通过‘周麦18’与矮败小麦创制的回交导入系,具有良好的农艺性状和黄淮麦区的适应性等特点。
1.2 方 法
1.2.1 外源基因的回交聚合 分别选取转基因株系‘G新春9号’‘G鲁麦23-69’‘G鲁麦14-299’和‘G石4185’单株的种子各100粒,选取‘矮败周麦18’种子300粒,于10月上旬正常播种于西北农林科技大学小麦抗逆转基因隔离试验区,至当年11月下旬,对供体材料进行阳性植株分子检测并标记,于当年12月下旬待完成春化作用后,选取各转基因株系的阳性植株和受体材料移栽至转基因专用温室培养。
杂交:待发育至抽穗末期,选取矮败不育穗套袋,到开花期,用供体材料授粉杂交。分别收获杂交F1代种子和供体转基因小麦种子,破除休眠、发芽,进行绿体春化。
连续回交:绿体春化完成后,移入温室加代培养。开花前选择阳性矮败株套袋、选择阳性供体株花粉(均预先进行阳性植株的PCR跟踪检测)进行第一轮回交(BC1),第二轮回交(BC2)依照同样方法进行。
滚动回交:选取每一供体与矮败小麦连续回交的BC2F1种子若干,破除休眠、发芽、春化处理后继续温室加代培养,供体材料以同样方法处理。在苗期对矮败小麦和供体植株分别进行外源基因检测。待生长发育进入孕穗期后,选取检测阳性矮败植株套袋,在开花期,选用阳性供体植株花粉分别给携带不同外源基因的矮败小麦授粉杂交,收获杂交种,春化处理后种植;在苗期对矮败小麦和供体植株分别进行外源基因检测,待生长发育进入孕穗期后,选取检测阳性矮败植株套袋,开花期选用携带相同外源基因的阳性供体植株花粉分别给上代杂交的相应F1穗授粉,开始滚动回交,以聚合不同的目的基因(GBC1),连续回交2代后(GBC2),将所有回交种子混合种植于大田,形成矮败小麦的小群体,使矮败小麦混合群体内每一个体实现自交的同时,在群体内群体之间实现充分互交,收获矮败不育株杂交穗上的种子进入下一轮种植。4个抗旱相关转录因子基因的回交、聚合过程如图1所示。

图1 抗旱转基因矮败小麦种质创制路线图Fig.1 Germplasm creating flow of drought-resistant transgentic dwarf male-sterile wheat
1.2.2 杂交后代外源基因的跟踪检测 为了确保回交转育的准确、可靠性,在最初的杂交和以后的每一轮回交之前,对各分离后代和供体植株的外源基因进行PCR检测,并标记,以筛选阳性植株为供体授粉。具体做法如下:
DNA提取:基因组DNA采用CTAB法提取[20],以15 g/L琼脂糖凝胶电泳检测DNA完整性,并检测其浓度。
PCR检测:以后代植株基因组DNA为模板进行目的基因分子检测。GhDREB、 GmDREB1、 GmDREB3、TaEBP检测的引物序列分别为:GhDREB:5′-AGGAAGTGGGGAAAGTGGGT-3′(F)和5′-AGTGAGGTCTGTAAAGCGTCG-3′(R),扩增片段为257 bp; GmDREB1:5′-CG GGTAGAAGAAGTCCAACATCG-3′(F)和5′-AGTCGGGCTTGAGATTGAGAGAG-3′(R),扩增片段为423 bp; GmDREB3:5′-ATTGAACTGGGGAAAGGGTTAGT-3′(F)和5′-TGAATCGGTGAGGTGTTGCGTCG-3′(R),扩增片段为441 bp;TaEBP采用bar基因引物检测:5′-AGGTTCGGCCGATAGTTAGGT-3′(F)和5′-GGCTGAATGGTCTGACGTTGCG-3′(R),扩增片段为435 bp。扩增产物用8 g/L的琼脂糖凝胶电泳,紫外灯下观察照相。
2 结果与分析
2.1 转基因供体植株的分子检测
在温室内,待供体植株生长发育进入分蘖盛期,每个转基因株系,各选取25株标记、编号,取其叶片,提取基因组DNA,利用PCR扩增方法,筛选阳性植株(图2-A、B、C、D)。

A. 转GhDREB基因株系‘G鲁麦23-69’阳性植株分子检测 PCR analysis for GhDREB gene of ‘G-Lumai 23-69’ plants;B. 转 GmDREB1基因株系‘G鲁麦14-299’阳性植株分子检测 PCR analysis for GmDREB1 gene of ‘G-Lumai 14-299’ plants;C. 转 GmDREB3基因株系‘G石4185’阳性植株分子检测 PCR analysis for GmDREB3 gene of ‘G-Shi 4185’ plants;D. 转TaEBP基因株系‘G新春9号’阳性植株的分子检测 PCR analysis for TaEBP gene of ‘G-Xinchun 9’ plants;M. D2000 marker;CK+. 阳性质粒 Positive plasmid;CK-. 阴性对照 Negative control;1-15. 转基因株系 Transgenic lines
供体植株外源基因分子检测结果说明,转基因供体亲本已经接近纯和,这对保证回交转育的准确可靠性具有关键作用。
2.2 杂交和有限回交(BC1F1~BC2F1)
待供体和受体材料生长发育至抽穗期,选取矮败小麦群体‘矮败周麦18’发育健壮的不育株套袋,编号。进入开花期,选择足购数量已检测的转基因阳性供体植株给矮败不育穗人工饱和授粉杂交。成熟期,采收母本不育株上杂交种(F1代种子),以备下一轮回交使用。将上轮收获的杂交种子、供体材料种子破除休眠、春化后,于温室条件培养至抽穗期,分别在杂交F1矮败群体中选取不育株挂牌、编号,待进入盛花期,继续回交、收获。BC2依照同样方法。
在完成供体亲本和受体亲本杂交的基础后,对回交F1分离群体选株,同样用前述4对引物分别检测相应的F1植株,并挂牌标记。至植株进入开花前期,将检测的矮败阳性不育穗套袋,用相应的转基因供体亲本给其人工定向、饱和授粉,完成第一轮回交。图3是BC1F1部分矮败植株PCR检测结果。
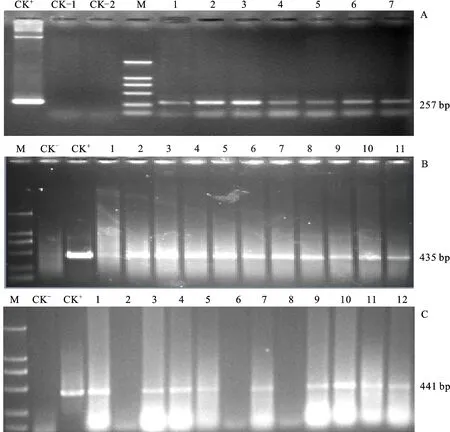
A. BC1F1群体矮败小麦不育株目的基因GhDREB的分子检测 PCR detection for GhDREB gene of BC1F1 dwarfing-sterile wheat;B. BC1F1群体矮败小麦不育株目的基因TaEBP的分子检测 PCR detection for TaEBP gene of BC1F1 dwarfing-sterile wheat;C. BC1F1群体矮败小麦不育株目的基因 GmDREB3 的分子检测 PCR detection for GmhDREB3 gene of BC1F1 dwarfing-sterile wheat;CK+. 阳性质粒 Positive plasmid;CK-/CK-1. 阴性对照 Negative control;CK-2.H2O;M.D2000 marker;1-12. BC1F1群体矮败不育植株 Dwarfing-steile plant of BC1F1 populations
由图3的检测结果可知,经过一次杂交和一轮回交,外源基因均不同程度的转育到矮败小麦遗传背景,这为下一轮回交奠定了材料基础。
成熟后,收获BC1F1矮败小麦不育穗上的杂种种子,将其与相应的转基因供体亲本一起破除休眠、春化。通过春化阶段后,所有苗期材料移入温室,培养加代,以备下一轮回交(BC2),方法与上一轮回交(BC1)相同。
2.3 滚动回交(GBC1F1~GBC2F1)
将上轮不育株回交的BC2F1种子和互交的BC1F1种子,进行破除休眠、春化处理后种植于温室。待矮败植株生长发育进入抽穗期后,在杂交BC2F1矮败群体中,随机选取发育健壮的矮杆不育植株套袋、挂牌、编号,叶片取样,检测。转基因供体植株也做一定数量的PCR检测,待矮败小麦生长发育进入开花期后,依照父母本各自携带外源基因的类型,开展不同外源基因植株间的交叉授粉(滚动杂交),成熟后收获种子,以备下一轮回交之用。
第一轮滚动回交(GBC1) :收获滚动杂交F1种子,将其与转基因供体亲本种子采用前述方法处理后移入加代温室。在进入拔节期后,选取矮败不育株、供体转基因植株,对其携带目的基因进行PCR检测,并对阳性植株挂牌标记,待生长发育进入开花期时,依照亲本双方携方带基因类型,进行相应的第一轮滚动回交。由图4可知,经过一次杂交和滚动回交后,GBC1F1植株中检测到了 GmDREB3、TaEBP和GhDREB外源基因的回交导入。
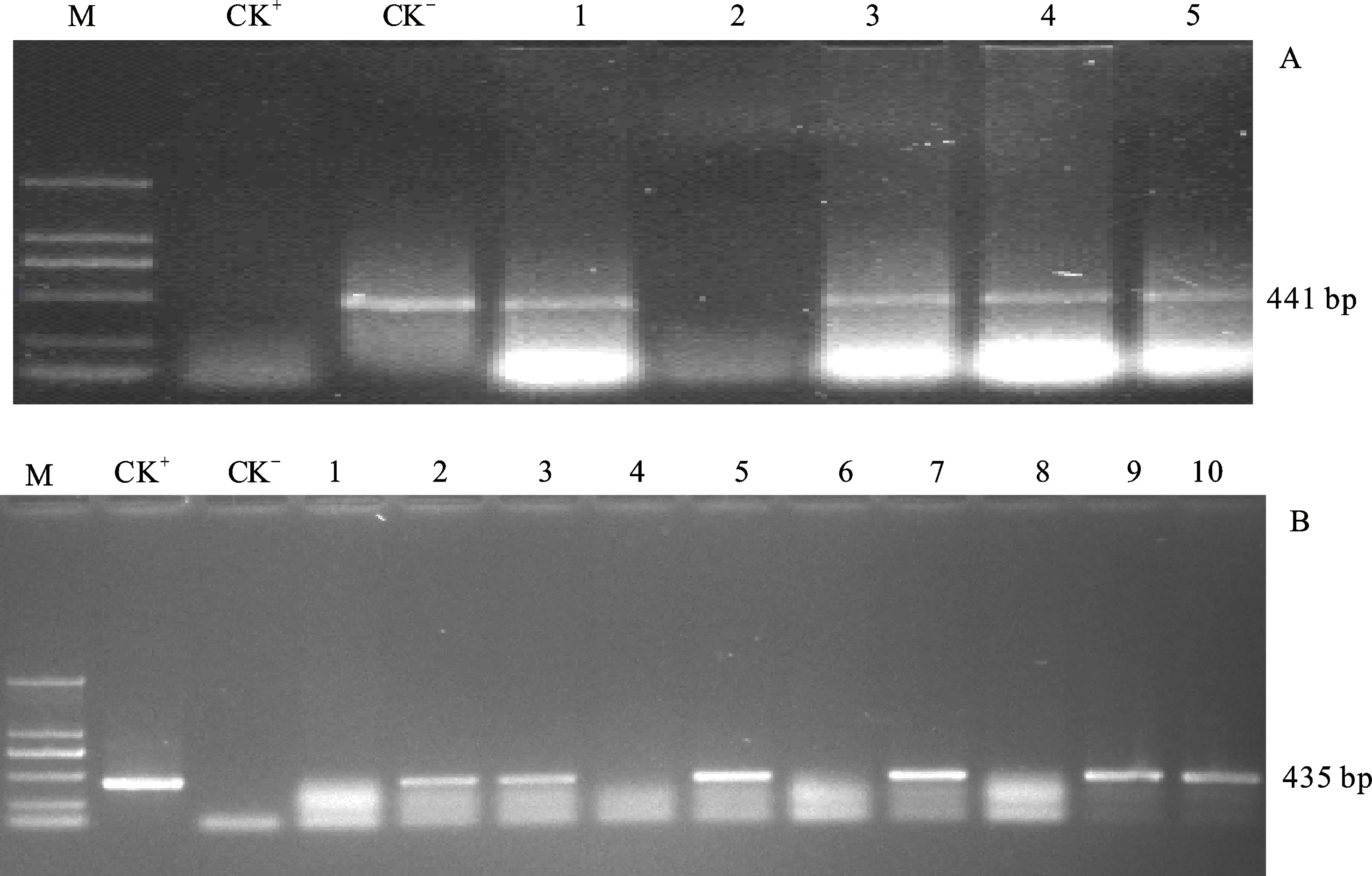
A. 滚动回交GBC1F1矮败小麦目的基因 GmDREB3分子检测 PCR detection for GmDREB3 gene of GBC1F1 dwarfing-sterile wheat;B. 滚动回交GBC1F1矮败小麦目的基因TaEBP分子检测 PCR detection for TaEBP gene of GBC1F1 dwarfing-sterile wheat;M. D2000 marker;CK-. 阴性对照 Negative control;CK+.阳性对照 Positive plasmid;1-10. GBC1F1群体阳性不育 Positive dwarfing-sterile plant of BC1F1Populations
第二轮滚动回交(GBC2) :第一轮滚动回交结束后,收获第一轮回交种子和相应供体阳性植株种子,种子处理与第一轮滚动回交相同。将处理好的种子幼苗移入温室培养至拔节期,采用与第一轮回交相同的方法完成第二轮滚动回交(GBC2)。
群体内交配:第二轮滚动回交结束后,收获滚动回交不育株上F1种子,将F1种子全部混合,在隔离条件下种植于大田,让矮败小麦群体内个体间充分异交、自交,即可育株与不育株之间充分互交的同时,可育株自交。成熟后,按照不育株农艺性状的优劣,混收不育株种子,同时严格选收农艺性状优良的可育株种子。
2.4 转基因矮败小麦外源基因聚合的分子鉴定
选用连续滚动回交两代、群体内交配后收获的不育株回交种子2~3粒,发芽,水培至3叶期时剪取叶片,提取基因组DNA,以采用多重引物PCR对其进行外源基因聚合情况的PCR分子检测,以确定外源基因的导入与否,以及导入外源基因的种类。
外源基因检测结果表明,经过两轮的有限回交和两轮的滚动回交,转基因供体材料的目的基因已经不同程度的回交转育于矮败小麦(图5)。具体而言,分别已有TaEBP+GhDREB、 GmDREB3+ GmDREB1、 GmDREB3+GhDREB、 GmDREB3+TaEBP2个不同外源基因聚合于同一植株(分别见图5中第1、2、3、5泳道), GmDREB3+TaEBP+GhDREB3个不同的外源基因聚合在同一矮败小麦植株(图5中第4、6泳道)。
综上,经过抗旱转基因株系与矮败小麦的两轮有限回交和两轮滚动回交,所获植株既具备矮败小麦的特征,又聚集了同时携带多个供体的抗旱相关基因,从而使得矮败不育植株具备了转基因抗旱与矮败小麦的双重特质,为进一步开展转基因抗旱小麦轮回选择育种及种质创新奠定了良好基础。

M. DNA MarkerⅠ;1:GBC2F1植株中扩增的TaEBP基因片段435 bp和GhDREB基因片段257 bp Fragment of TaEBP and GhDREB gene by PCR on GBC2F1 plant;2. GBC2F1植株中扩增的 GmDREB3基因片段441 bp和 GmDREB1基因片段423 bp Fragment of GmDREB3 and GmDREB1 gene by PCR on GBC2F1 plant;3. GBC2F1植株中扩增的 GmDREB3基因片段441 bp和GhDREB基因片段257 bp Fragment of GmDREB3 and GhDREB gene by PCR on GBC2F1 plant;4,6. GBC2F1植株中扩增的 GmDREB3基因片段441 bp、TaEBP基因片段435 bp和GhDREB基因片段257 bp Fragment of GmDREB3、TaEBP and GhDREB gene by PCR on GBC2F1 plant;5. GBC2F1植株中扩增的 GmDREB3基因片段441 bp和TaEBP基因片段435 bp Fragment of GmDREB3 and TaEBP gene by PCR on GBC2F1 plant
3 讨 论
矮败小麦是具有显性矮核不育基因(Ms2)与显性矮杆基因(Rht10)紧密连锁的具有表型遗传标记的特异种质,是开展小麦轮回选择育种和相关研究的重要遗传工具和遗传资源[12-19]。TaEBP、 GmDREB1、 GmDREB3、GhDREB属转录因子基因,可在转录水平调控下游若干抗逆(抗旱)基因的表达,其超量表达能明显提高小麦对干旱等非生物胁迫的耐受性[21-26]。
本研究以‘矮败周麦18’为遗传改良工具,以‘G新春9号’‘G鲁麦14-299’‘G鲁麦23-69’‘G石4185’等分别携带前述4个抗旱相关转录因子基因的小麦株系为供体,通过有限回交、滚动回交,结合杂种后代PCR跟踪检测,创制转基因矮败小麦新种质,分子检测结果表明,初步获得了同时携带 GmDREB3、TaEBP、GhDREB基因于一体的矮败小麦,为进一步利用其开展转基因小麦的轮回选择育种,研究双价、多价抗旱相关转基因植株的抗旱效果和抗旱机理,以及其它相关研究提供了重要的材料支撑。
在材料创制方法上,虽然采用传统的回交转育方法,但结合了外源基因的PCR分子扩增的回交后代跟踪检测手段,加之温室加代技术的运用,保证种质材料创新过程中外源基因导入的准确性、定向性和快速性等特点。
虽然已有数个抗旱相关基因导入矮败小麦,从理论上讲,这些材料的抗旱性能应该有较大幅度的改良,但由于基因之间、基因与环境间互作等诸多因素的影响,创制新种质材料的抗旱性能,如抗旱相关的农艺性状指标、生理生化指标等抗旱机制还有待于进一步鉴定。
