陕西关中地区苹果褐斑病菌遗传多样性分析
2018-11-29宋艳艳谢士昌高小宁黄丽丽韩青梅
宋艳艳,谢士昌,高小宁,冯 浩,黄丽丽,韩青梅
(西北农林科技大学 植物保护学院,旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
苹果褐斑病是由子囊菌门苹果壳二孢Diplocarponmali,(无性态为Marssoninacoronariae)引起的苹果早期落叶病害之一,在世界上各苹果主产区都有分布[1],常引起生长季节果树叶片黄化和大量脱落,导致树体衰弱,影响苹果的产量和品质,造成严重的经济损失。苹果褐斑病在中国最早发生于湖北省[2],该病害在中国苹果产区属于连年流行病害,并有逐渐加重的趋势[3]。目前生产上对该病害的防治以喷施化学药剂为主,但是使用化学药剂存在生产成本高、农药残留和病菌抗药性等问题[4],因此选育抗病品种,挖掘抗病种质资源对于苹果褐斑病的可持续控制具有重要意义。
近年来分子技术成为遗传多样性检测的有效手段,简单序列间重复(ISSR)是由Zietkiewicz等[5]提出的一种多态性分子标记,该技术使用16~25 bp的微卫星引物,利用多种基因组位点的单引物PCR反应扩增不同大小的ISSR序列[6]。ISSR是一种显性遗传标记,可以生成大量信息和可复制的等位基因,具有成本低、使用方便、操作简单、重复性好等特点[7],该技术不需要特殊的DNA序列,并且能够克服RAPD和AFLP等技术的限制[8-9],同时微卫星中的进化速率比大多数其他类型的DNA高,所以这些序列的多态性可能更大[6]。目前,ISSR分子标记的应用领域已经从植物扩展到真菌方面[10-12],在对植物病原真菌的研究中,该技术常被用来研究病原真菌的群体遗传和生理小种鉴定、病原菌致病性、遗传多样性等。
本研究利用ISSR分子标记技术,通过ISSR-PCR扩增,对分离自陕西省关中地区7个县(区)苹果褐斑病菌的遗传多样性和群体遗传结构进行分析,以期了解不同地区苹果褐斑病菌的群体遗传多样性及其与地理来源之间的关系,为病害的防治和抗病育种工作提供理论依据。
1 材料与方法
1.1 菌株来源
苹果褐斑病菌(D.mali)由西北农林科技大学植物保护学院果树病害病原生物学及综合防治研究室提供,分离自陕西关中7个(县)区,共64株,样品采集地点:关中东部,白水县10株;关中中部,乾县4株、杨凌区15株;关中西部,陈仓区6株、扶风县15株、凤翔县7株、眉县7株。
1.2 菌株活化
将保存于-80 ℃的苹果褐斑病菌转移至马铃薯胡萝卜葡萄糖琼脂(PCDA)培养基上[13],在25 ℃培养箱黑暗培养3周,将活化的菌体再转接扩繁,相同条件下培养7 d,用接种针刮取培养基上的菌体,液氮速冻后置于-80 ℃冰箱,备用。
1.3 模板DNA制备
将在-80 ℃下保存的苹果褐斑病菌体在液氮中充分研磨,使用Biospin真菌基因组DNA提取试剂盒(杭州博日科技有限公司)提取DNA,用10 g/L的琼脂糖凝胶电泳检测其完整性,并用核酸蛋白检测仪检测品质和浓度。当DNA无降解,OD260/280和OD260/230的值均为1.8~2.0时,说明DNA符合使用要求,4 ℃保存,备用。
1.4 ISSR-PCR反应体系优化
1.4.1 ISSR-PCR反应体系 供试ISSR引物由西安擎科泽西生物科技有限公司合成。ISSR-PCR反应体系和扩增程序如下:
反应体系:2×TaqMaster Mix 5 μL,ISSR引物(10 μmol/L)0.5 μL,模板DNA(200 ng/μL)0.6 μL,ddH2O补至10 μL。
扩增程序:94 ℃预变性4 min;随后94 ℃变性30 s,退火30 s,72 ℃延伸1 min,34个循环;72 ℃ 再延伸10 min;最后于16 ℃保存。
PCR反应结束后,吸取7 μL扩增产物,使用15 g/L琼脂糖凝胶电泳,在120 V电压下电泳30 min,电泳完成后使用凝胶成像系统观察照相。
1.4.2 ISSR引物及引物退火温度筛选 根据每一条引物的Tm值,设置退火温度梯度,温度范围为43~50 ℃和50~58 ℃,使用上述反应体系进行扩增。筛选条带清晰、无弥散、多态性稳定的引物,随后将筛选出的引物再进行扩增确定最佳退火温度,最后将筛选出的引物以64个菌株的基因组DNA为模板,进行ISSR-PCR扩增,每条引物重复扩增3次。
1.5 ISSR-PCR扩增数据的统计与分析
由于ISSR标记是显性遗传标记,每个条带都可以作为一个等位基因位点[14],依次对每一条引物扩增的带型进行统计,选择清晰、稳定的条带,模糊不清的条带忽略不计。首先确定条带的大小,根据同一大小处条带的有无,分别记为“1”和“0”,构建0-1矩阵表。
利用Popgene 1.32 软件计算以下参数:(1)反映基因多少和状况的遗传参数:多态性条带数(Number of polymorphic loci,NP)、多态条带百分率(Percentage of polymorphic loci,P)、等位基因观测数(Observed number of alleles,Na)、有效等位基因数(Effective number of alleles,Ne);(2)反映基因多样性信息的遗传参数:Nei’s基因多样性指数(Gene diversity,H)、Shannon信息指数(Shannon’s information index,I);(3)反应遗传分化程度的参数:种群遗传分化系数(Coefficient of genetic differentiation among population within species,Gst),Gst=Dst/Ht,其中Dst=Ht-Hs,Ht为总遗传多样性,Hs为群体内的遗传多样性,Dst为群体间遗传多样性。根据Wright的Fst算法[15],得到反映基因流强度的居群每代迁移数(Number of migrants per generation,Nm)其关系为:Fst=1/(1 + 4Nm),Nm(W)=(1 -Fst)/4Fst,在此,Fst可认为等同于Gst。当Nm>1(N为有效居群大小,m为基因流比率)时,证明种群间存在一定的基因流动,能发挥匀质化作用;当Nm<1时,则表示基因流传受到部分阻碍,亚群体间随即蕴藏遗传分化的潜能;如果Nm>4,它们就是一个随机单位。利用Popgene 1.32软件计算不同类群的遗传距离和遗传一致度,并用NTsys-2.0软件使用非加权算术平均聚类(UPGMA)方法进行群体聚类分析。
2 结果与分析
2.1 ISSR-PCR扩增筛选引物及引物退火温度
经过多次的ISSR-PCR扩增反应,结果表明,引物的退火温度是影响ISSR-PCR特异性的重要因素之一,通过设置退火温度梯度,选择多态性条带稳定且清晰的引物进行重复扩增,确定最适退火温度。图1为引物BIS07和BIS15在不同温度下的扩增结果,二者的最佳退火温度确定为50.0 ℃,其他引物的退火温度如表1所示。最终从40条ISSR引物中筛选出11条扩增效果好的引物,引物序列见表1,部分引物扩增电泳图如图2(引物P 5)和图3(引物BIS15)所示,条带清晰无杂带,并且具有多态性。
2.2 ISSR-PCR扩增检测苹果褐斑病菌遗传多样性
对筛选出的11条引物进行ISSR-PCR扩增,结果显示,二核苷酸重复的引物多态性较高,平均值为92.3%,同时二核苷酸重复引物有9条,占到总引物的81.8%,三核苷酸重复的引物仅有2条,且引物的多态性百分率低,分别为33.3%(824)和50.0%(P5),说明在苹果褐斑病菌的基因组中富含较多的二核苷酸串联重复序列;从引物序列中可知,当引物的重复序列为(AG)、(GA)、(CT)、(TC)、(AC)时,引物表现出更高的多态性。从11条ISSR引物共扩增得到82个位点,其中多态性位点71个,引物扩增得到的总位点数为4~12个,多态性位点数为2~11个,平均每条引物扩增7.5个位点,6.5个多态性位点,多态性位点的百分率为33.3%~100.0%,平均多态性位点率为86.6%,说明苹果褐斑病菌具有遗传多样性。

泳道1~8的温度依次为:50.0 ℃、50.8 ℃、51.8 ℃、53.2 ℃、55.0 ℃、56.5 ℃、57.4 ℃、58.0 ℃ Annealing temperature of lane 1 to 8 is 50.0 ℃,50.8 ℃,51.8 ℃,53.2 ℃,55.0 ℃, 56.5 ℃,57.4 ℃,58.0 ℃,respectively;左图为引物BIS07的温度梯度,右图为引物BIS15的温度梯度 The left plate shows the temperature gradient for the primer BIS07,and the right for BIS15;DNA模板为Hbj-0435 The DNA template is Hbj-0435;M.DS2000

表1 供试ISSR引物扩增特征Table 1 The amplification characteristics of selected ISSR primers
2.3 不同县(区)苹果褐斑病菌群体遗传多样性分析
陕西省关中平原不同县(区)苹果褐斑病菌群体遗传多样性参数如表2所示,结果表明,苹果褐斑病菌具有较丰富的遗传多样性。在物种水平上,病菌的等位基因观测数(Na)为1.87,有效等位基因数(Ne)为1.48,Nei’s基因多样性指数(H)为0.29,Shannon 信息指数(I)为0.44,多态性位点数(NP)为71个,多态性位点率(P)为86.59%。在群体水平上,病菌的等位基因观测数为1.50~1.77,平均为1.67;有效等位基因数为1.30~1.45,平均为1.41;Nei’s基因多样性指数为0.20~0.26,平均为0.24;Shannon 信息指数为0.20~0.40,平均为0.35;多态性位点数为 41~62个,平均为55个;多态性位点率为50.00%~76.83%,平均为66.72%。其中渭南市白水县(Na=1.76,Ne=1.45,H=0.26,I=0.40)种群的遗传多样性水平最高,咸阳市乾县(Na= 1.50,Ne=1.36,H=0.20,I=0.29)种群的遗传多样性水平相对较低。
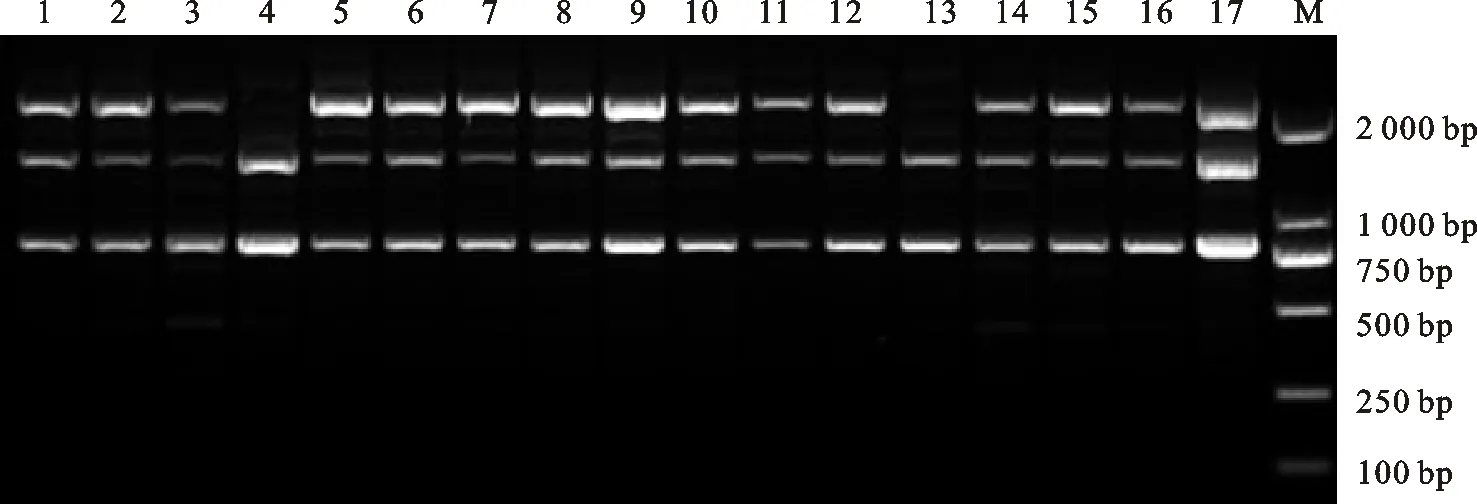
1~17.Hbj-0364,Hbj-0369,Hbj-0371,Hbj-0375,Hbj-0347,Hbj-0336,Hbj-0341,Hbj-0343,Hbj-0311,Hbj-0439,Hbj-0416,Hbj-0400,Hbj-0414,Hph-0027,Hph-0070,Hph-0101,Hph-0105; M. DS2000;下同 The same below

图3 引物BIS15对17株苹果褐斑病菌株的ISSR-PCR扩增电泳图Fig.3 The ISSR-PCR amplification of 17 isolates of D.mali with primer BIS15

表2 不同县(区)苹果褐斑病菌遗传多样性分析Table 2 Genetic diversity analysis of D.mali of different counties
2.4 关中地区苹果褐斑病菌群体遗传多样性和遗传分化分析
陕西省关中地区苹果褐斑病菌群体遗传多样性的参数如表3所示,结果显示,关中西部地区群体的等位基因观测数为1.84,有效等位基因数为1.47,Nei’s基因多样性指数为0.28,Shannon 信息指数为0.43,高于中部地区和东部地区,说明关中西部地区的群体遗传多样性高于关中中部和东部。
陕西省关中地区苹果褐斑病菌群体遗传分化程度的参数如表4所示,结果显示,关中平原不同地区的遗传分化程度不同。其中东部、西部、中部地区遗传分化系数(Gst)分别为0.17、0.14、0.13,东部的遗传分化系数高于中部和西部。在群体水平上,遗传分化系数为0.03,即群体内的遗传多样性占总群体遗传多样性的97%,群体间的遗传多样性占总群体多样性的3%,说明遗传分化主要发生在群体内。关中中部的基因流(Nm=1.62)高于西部(Nm=1.51)和东部(Nm=1.24),表明不同地区的种群间存在不同程度的基因交流,其中中部地区种群间的基因交流更广泛。由表中数据可以看出,不同区域之间的群体基因交流也存在差异,其中关中东部和西部地区之间的基因流最大(Nm=7.79),其次为关中东部和中部之间(Nm=3.97),关东中部和西部之间的基因交流相对较少(Nm=3.85),说明关中东部和西部地区之间存在更频繁的基因交流。

表3 陕西关中地区苹果褐斑病菌群体遗传多样性分析Table 3 Genetic diversity analysis of D.mali populations in Guanzhong Shaanxi
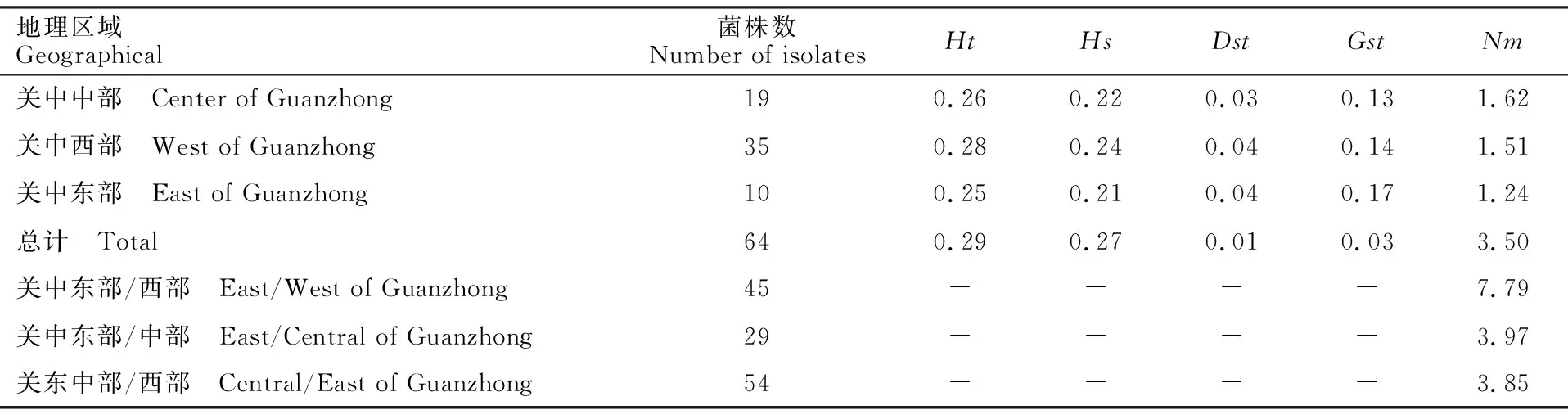
表4 陕西关中地区苹果褐斑病菌群体遗传结构和遗传分化分析Table 4 Genetic structure and genetic differentiation analysis of D.mali populations in Guanzhong Shaanxi
2.5 不同县(区)苹果褐斑病菌种群的聚类分析
遗传距离和遗传一致度是衡量群体之间的遗传分化程度的重要指标之一,通过分析苹果褐斑病菌群体的遗传距离和遗传一致度,结果(表5)显示,不同县(区)群体之间的遗传距离范围为0.036 1~0.144 9;其中白水县和眉县的遗传距离最近,为0.036 1,同时两者之间的遗传一致度最高;杨凌区和陈仓区之间的遗传距离最远,为0.144 9,遗传一致度最低。根据群体的遗传一致度,使用NTsys-2.0软件进行不同地区苹果褐斑病菌群体聚类分析,结果(图4)显示,在遗传相似系数为0.92时,7个县(区)的病菌被分为3个类群,类群1包括陈仓区;类群2包括凤翔县、乾县、白水县、眉县、扶风县,为优势类群;类群3包括杨凌区。以上结果表明,不同地理种群之间的遗传距离存在差异,种群之间的遗传亲缘关系与分离株的地理来源之间没有明显的相关性。

表5 不同县(区)苹果褐斑病菌株的遗传距离Table 5 Nei’s genetic distance of D.mali in different counties

图4 陕西关中地区苹果褐斑病菌不同自然种群的 UPGMA 聚类图Fig.4 The UPGMA dendrogram of D.mali populations in Guanzhong Shaanxi
3 讨 论
ISSR标记被广泛应用是由于其重复性良好,且比RAPD更稳定,通过检测多个遗传位点之间的差异,表现出更高的多态性,是一种高效、可靠的分子标记技术。研究表明,通常在3′或5′端锚定的二核苷酸重复的ISSR引物具有高度的多态性[16-18]。本研究的ISSR引物筛选结果也表明,二核苷酸重复的引物多态性较高,平均值为92.3%。通常来说,相比较于其他的三核苷酸和四核苷酸序列,ISSR引物的重复序列为(AG)、(GA)、(CT)、(TC)、(AC)、(CA)时,引物表现出更高的多态性[6],这与本研究筛选到的多态性引物序列特征相符合。由此可见,本研究使用ISSR分子标记技术分析病原菌的遗传多样性是可靠的。
种群遗传多样性分析结果表明,渭南市白水县群体遗传多样性水平最高。李旻等[19]利用ISSR标记研究球孢白僵菌遗传多样性,认为其遗传多态性差异与地理环境以及气候有关。苹果褐斑病在陕西省各苹果产区均有发生,但是各地的发病程度却不相同,相比较于其他6个县(区),白水县昼夜温差大,夜间在叶片上易形成潮湿的环境,利于病害发生,因此该地区褐斑病发生严重[20]。据此推测各地种群遗传多样性差异与病害发生的严重程度有关。
遗传分化系数是衡量群体间和群体内相对遗传变异大小的重要指标,能够很好的解释群体遗传变异。种群之间的基因分化水平与很多因素有关,如长期进化历史和物种的性质、基因流动、种群隔离等[21]。本研究中从群体水平分析发现,苹果褐斑病菌种群间的遗传分化程度较低,病菌的遗传分化主要发生在群体内;同时群体之间存在基因流动,存在均质化作用,不易出现遗传分化,不同地区之间也存在菌源流动。基因流的存在能够影响群体的遗传结构,基因流传播越顺畅则遗传分化程度越低[22]。王建锋等[23]利用TP-M13-SSR 自动荧光检测技术,分析陕西省小麦条锈菌群体遗传结构,认为基因流是陕西省小麦条绣菌群体遗传分化程度低的影响因素之一。因此推测导致苹果褐斑病菌群体间遗传分化程度低的原因是群体间基因流动频繁。
本研究中对于苹果褐斑病菌种群遗传变异的分析,将有助于研究遗传变异与其他表型性状如致病性的相关性。另一方面,种群的遗传多样性与物种的进化发展相关联[21],可进一步为抗病育种工作提供理论依据。但是由于本研究的供试菌株分离样品仅局限于陕西省关中地区,因此对于更多地区病原菌之间的遗传多样性,尚待深入研究论证。
