PET/CT联合血清MIC-1、SCC-Ag诊断肺癌的临床效能分析
2018-11-29曾瑶彭俊红
曾瑶,彭俊红
[湖北省武汉市第四医院(华中科技大学同济医学院附属普爱医院),湖北 武汉 430033]
据世界卫生组织统计[1],肺癌是发病率最高的恶性肿瘤,因缺乏有效的手段诊断,确诊时已为晚期,死亡率较高,治疗疗效和预后均较差。因此,肺癌及时、准确的诊断,对于延长患者生存期、改善预后至关重要。随着影像学的快速发展和肿瘤标志物逐渐用于临床,肺癌的诊断率大幅提高,但都有一定的局限性。正电子发射断层显像/X射线计算机断层成像(positron emission tomography/computed tomography,PET/CT)结合PET和CT的生物影像和功能显像特征,对肺癌诊断的敏感性较高,但受呼吸运动影响,容易出现假阴性和假阳性结果[2]。而肿瘤标志物诊断肺癌费用低、损伤小,有一定的特异性,但敏感性不足[3]。有研究表明,将PET/CT与肿瘤标志物联合使用,可提高肺癌的诊断效能[4]。巨噬细胞抑制因子1(macrophages inhibitory cytokine-1, MIC-1)是广泛参与肺癌细胞凋亡、侵袭及转移的肿瘤标志物,诊断肺癌的敏感性和特异性分别为71.3%和96.5%[5],鳞癌相关抗原(squamous cell carcinoma-related antigen, SCCAg)是特异性较好的鳞癌标志物,诊断肺癌的敏感性和特异性分别为60.88%和93.21%[6]。MIC-1和SCCAg均是肺癌诊断特异性较高的肿瘤标志物,本研究拟采用PET/CT联合血清MIC-1、SCC-Ag诊断肺癌,以期提高PET/CT诊断肺癌的特异性,提高肺癌的诊断效能。现报道如下。
1 资料与方法
1.1 一般资料
选取2015年1月-2017年1月普爱医院收治的120例疑似肺癌的患者。其中,男性80例,女性40例;年龄30~70岁,平均(50.2±4.1)岁。临床症状表现为声音嘶哑、胸闷气短、痰中带血、咳嗽及胸痛等。依据病理结果将患者分为两组。肺癌组68例:其中腺癌36例,鳞癌23例,小细胞癌9例;男性48例,女性20例;年龄(50.5±4.6)岁。良性病变组52例:其中,男性32例,女性20例;年龄(50.0±4.0)岁。炎性肉芽肿17例,结核30例,炎性假瘤5例。纳入标准:①所有患者均经手术切除病变组织活检或纤支镜活检或经皮肺穿刺病理诊断;②无其他合并肿瘤;③未经放疗和化疗治疗;④对需要手术治疗患者,入院次日进行PET/CT、MIC-1、SCC-Ag检测,10 d后进行手术。⑤自愿参与本研究,并签署知情同意书。排除标准:①无完整的PET/CT或 MIC-1或SCC-Ag检测结果;②肺部有不只1个原发病灶;③肺部转移;④肝肾功能异常;⑤严重感染;⑥合并基础代谢性疾病。两组性别、年龄等基本资料比较,差异无统计学意义(P>0.05)。本研究通过普爱医院伦理委员会批准。
1.2 方法
1.2.1 PET/CT检测方法 所有患者入院后检查身高和体重。检查当天禁止剧烈运动,空腹4~6 h,经血糖测定仪检测证实空腹血糖在正常水平后,静脉注射显像剂氟代脱氧葡萄糖18F-FDG 5.55 MBq/kg(防化纯度>97%,pH=7.3),静息平卧1 h,排尿后进行PET/CT扫描。设备为Siemens Biograph 16 truepoint PET/CT扫描仪(德国西门子公司),CT扫描参数:管电压120 kV,管电流200~230 mA,层厚2.5~5 mm;PET参数:5~6床位,每床位2.5 min,3D扫描,采用迭代法重建。由2位工作10年的高年资核医学科医师双盲分析重建图像,以病灶为中心勾画感兴趣区,确定放射性核元素浓聚集灶,记录最大标化摄取值(SUVmax),计算平均值。以SUVmax≥2.5诊断为肺癌。
1.2.2 血清MIC-1测定 入院次日清晨取空腹肘静脉血4 ml,自然凝结30 min后,4 000 r/min离心15 min,取上清液,采用双抗体夹心ELISA测定血清MIC-1水平,具体参照试剂盒说明书进行操作。以MIC-1≥1 ng/ml诊断为肺癌。
1.2.3 血清SCC-Ag测定 入院次日清晨取空腹肘静脉血5 ml,置于肝素抗凝管中,3 000 r/min离心10 min,取上层血清,化学发光法测定SCC-Ag水平。以SCC-Ag≥1.5 ng/ml诊断为肺癌。
1.2.4 诊断标准 分别采用PET/CT+MIC-1、PET/CT+SCC-Ag及PET/CT+MIC-1+SCC-Ag 3种联合诊断方案诊断肺癌,联合诊断时,所有项诊断为阳性即判断为阳性,其中一项诊断为阴性,即判断为阴性。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数+标准差(±s)表示,比较用t检验,计数资料以率(%)表示,比较用χ2检验,采用ROC曲线分析PET/CT、MIC-1及SCC-Ag联合检测的曲线下面积,P<0.05为差异有统计学意义。
2 结果
2.1 两组SUVmax、MIC-1及SCC-Ag比较
两组SUVmax、MIC-1及SCC-Ag比较,差异有统计学意义(P<0.05);肺癌标准摄取值SUVmax、MIC-1及SCC-Ag水平高于良性病变组。见表1。
2.2 PET/CT、MIC-1、SCC-Ag单独诊断肺癌的诊断效能
PET/CT、MIC-1、SCC-Ag单独诊断肺癌的诊断效能比较,差异有统计学意义(P<0.05);PET/CT诊断肺癌的敏感性高于MIC-1、SCC-Ag,特异性低于MIC-1、SCC-Ag。见表2。
表1 两组 SUVmax、MIC-1 及 SCC-Ag 比较 (±s)

表1 两组 SUVmax、MIC-1 及 SCC-Ag 比较 (±s)
SCC-Ag/(ng/ml)肺癌组(n =68) 9.22±1.37 1.35±0.23 3.89±1.02良性病变组(n =52) 2.28±0.93 0.37±0.09 0.72±0.17 t值 32.997 30.072 25.175 P值 0.000 0.000 0.000组别 SUVmax MIC-1/(ng/ml)
2.3 PET/CT、MIC-1及SCC-Ag联合诊断肺癌的诊断效能
PET/CT+MIC-1、PET/CT+SCC-Ag及 PET/CT+MIC-1+SCC-Ag 3种联合诊断方案的敏感性、特异性比较,差异无统计学意义(P>0.05),但联合诊断的特异性比较,差异有统计学意义(P<0.05)。ROC曲线分析表明,PET/CT+MIC-1、PET/CT+SCC-Ag、PET/CT+MIC-1+SCC-Ag联合诊断肺癌的ROC 曲线下面积分别为 0.782(95%CI:0.755,0.881)、0.765(95%CI:0.686,0.830)、0.843(95%CI:0.853,0.941),PET/CT+MIC-1+SCC-Ag联合诊断的效能最高。见表3和附图。
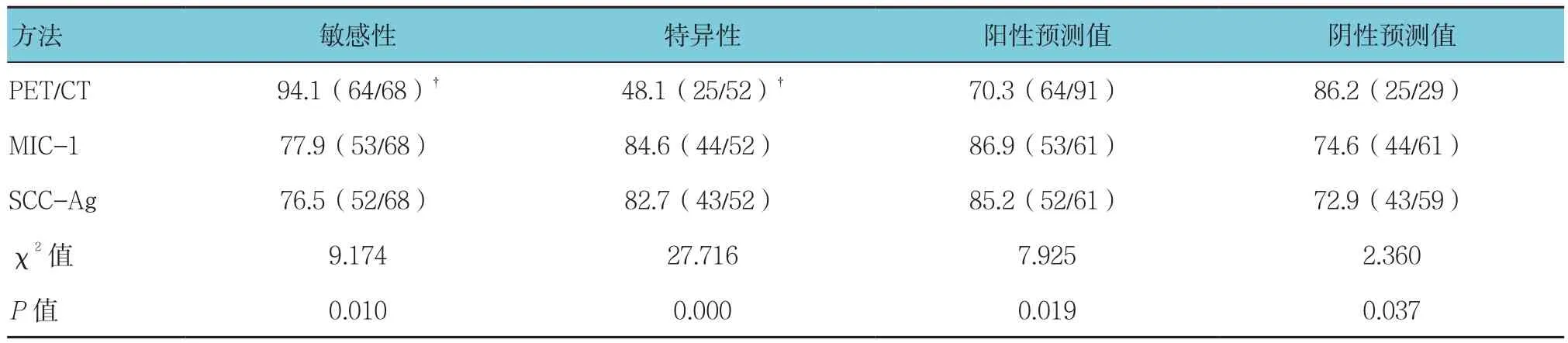
表2 PET/CT、MIC-1、SCC-Ag单独诊断肺癌的诊断效能 %
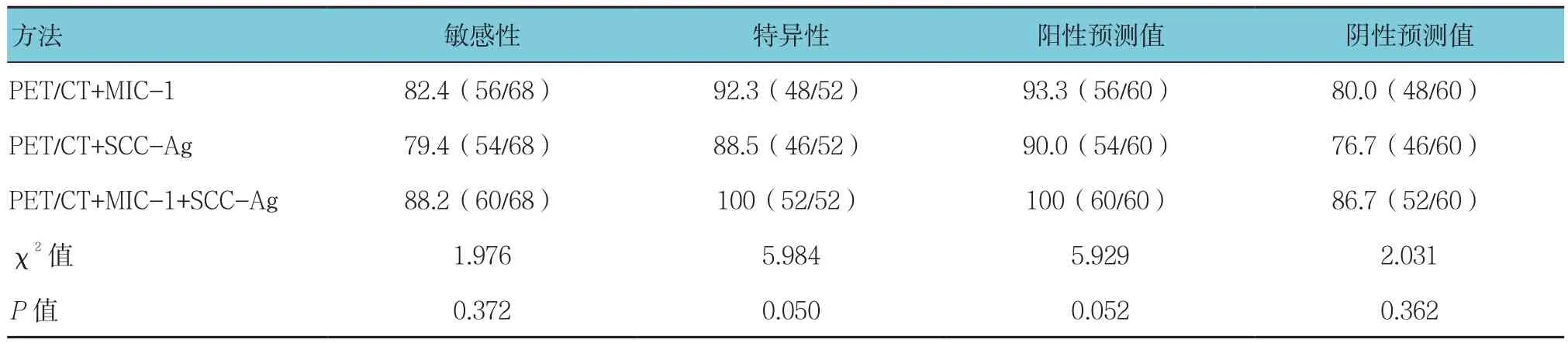
表3 联合诊断效能分析 %

附图 联合诊断ROC曲线
3 讨论
肺癌是世界范围内最常见的恶性肿瘤,发病率高,死亡率以每年1%~5%的速度增长[7],严重危害人类生命健康。肺癌的早期诊断和治疗是降低死亡率的关键[8]。目前病理学检查是肺癌诊断的金标准,辅助诊断包括影像学检查、肿瘤标志物及脱落细胞学检查等[9-10]。理想的肺癌诊断方法应具有高敏感性、高特异性的特征,并能反映肺癌进程和预后[10]。然而影响影像学检查的因素很多,诊断肺癌特异性低[11],目前又暂未找到一种具有高敏感性和特异性的肿瘤标志物[12]。针对这一问题,目前的研究做法为依据不同肿瘤标志物和影像学诊断肺癌的互补性,联合多种手段来提高肺癌的诊断率,以弥补单一诊断手段在临床检查中的敏感性和特异性不足[13-15]。由于肺癌和良性病变患者的SUVmax、MIC-1及SCC-Ag水平有差异,因此本研究选择PET/CT联合肿瘤标志物MIC-1、SCCAg来诊断肺癌。
PET/CT是《肺癌诊断和治疗指南》[16]推荐的8~10mm的孤立性肺结节的早期诊断手段。PET/CT通过CT扫描可直观了解病灶形态和准确定位,并可通过SUV进行半定量诊断。SUV是指病灶的放射性摄取量是全身组织平均摄取量的倍数,与肿瘤细胞的恶性程度呈正比,SUV越高,病灶恶性程度越高。目前SUV诊断肺癌的临界值尚未形成共识,但SUV临界值越高,诊断的准确率越高[17]。由于SUV受肿瘤直径的影响,提高SUV的临界值可能导致小病灶肿瘤的漏诊。参照高世乐等[13]的研究,本研究选取SUVmax≥2.5诊断为肺癌,其诊断肺癌的敏感性、特异性分别为94.1%和48.1%,敏感性较高,特异性低,与杨彦辉等[18]结果趋势一致。PET/CT诊断肺癌准确率高,但特异性较低,原因是[19]:①部分代谢能力低、分化程度高的肿瘤(如腺癌、支气管肺泡细胞癌及类癌等,SUVmax低);②PET/CT的分辨能力和部分容积效应可能引起肿瘤直径<7 mm的病灶诊断呈假阴性,③炎症、结核及结节病灶均会富集显像剂。因此PET/CT诊断肺癌,需联合其他手段进行。
肿瘤标志物的浓度变化与肿瘤的发生、生长密切相关,是肺癌诊断的另一重要手段。MIC-1[20]是一种细胞因子,主要功能为肿瘤生长调控和炎症反应,具有抑制肿瘤细胞增殖、促进凋亡等作用,参与肺癌细胞的增殖、分化及凋亡和转移。研究证实[21],血清MIC-1水平与肺癌的临床分期呈正相关,是肺癌早期诊断的比较理想的肿瘤标志物。沈迪等[5]采用MIC≥1 000 pg/ml诊断肺癌,敏感性和特异性为71.3%、96.5%,ROC曲线下面积为0.912。本研究中,MIC诊断肺癌的敏感性、特异性为77.9%、84.6%,特异度较沈迪等低,可能与样本量有关。SCC-Ag[22]是一种糖蛋白,主要存在于肺、子宫及食管等鳞状上皮细胞癌的胞质中,为鳞癌的标志物,是临床医师诊断肺癌常用的5中肿瘤标志物之一。陈邹阳[6]报道的SCC-Ag诊断肺癌敏感性和特异性分别为60.88%和93.21%,本研究采用与陈邹阳一致的诊断临界点,即SCC-Ag≥1.5 ng/ml,诊断的敏感性和特异性分别为76.5%和82.7%。MIC-1、SCCAg诊断肺癌具有较高的特异性,但敏感性较低,这是因为肿瘤标志物检测的准确性受浓度影响,在肿瘤很小时,标志物浓度很低,测定的准确性有限,因此,需联合其他手段共同诊断肺癌。
PET/CT从肿瘤病灶代谢角度评估肺癌,MIC-1、SCC-Ag分别从肿瘤生长调控和炎症反应、鳞癌形成角度评估肺癌,3者均从不同方面反映和评估肺癌,因此具有一定的互补性,联合诊断肺癌具有一定的可行性。尽管3种联合诊断方案的敏感性、特异性无差异,但PET/CT+MIC-1+SCC-Ag诊断肺癌的ROC曲线下面积最下,提示PET/CT+MIC-1+SCC-Ag联合更有助于肺癌的诊断。
综上所述,肿瘤标志物MIC-1、SCC-Ag可作为PET/CT诊断肺癌的补充手段,3者联合能有效改善肺癌诊断的敏感性和特异性,提高诊断效果。
