多普勒超声联合血清可溶性间皮素相关肽及癌胚抗原检测对早期卵巢癌的预测价值
2018-11-29耿月王君梅李建玲
耿月,王君梅,李建玲
(河南省新乡市中心医院 超声科,河南 新乡 453500)
卵巢癌是妇科常见恶性肿瘤之一,是危害女性健康的重要疾病,近年来其发患者群呈现逐渐年轻化趋势。该病初期临床症状较为隐匿不易被发现,超过半数以上的患者确诊时病情已经进展至晚期[1]。相关研究显示卵巢癌早期患者行根治手术治疗生存率可达85%[2]。因此,早发现早治疗,对于改善卵巢癌患者预后和降低病死率具有重要意义。超声、MRI、CT及血清学肿瘤标志物检查是卵巢癌早期确诊的重要手段,其中多普勒超声检查凭借其无创、易操作、低成本等优点在临床得到广泛应用,但其存在特异性较低的缺点[3]。癌胚抗原(carcinoembryonic antigen, CEA)、可溶性间皮素相关肽(soluble mesothelin related proteins,SMRP)是由癌细胞产生并释放到血液中的能够反映肿瘤存在的临床常用血清肿瘤肿瘤标志物。研究表明,卵巢癌患者血清中CEA、SMRP水平较正常人群增高[4-5]。但上述两种血清肿瘤标志物单独用于卵巢癌的临床诊断时存在各自的优点和不足,其敏感性和特异性均不高。近年来多项研究显示,采用多项血清肿瘤标志物联合检测或联合不同诊断方式共同检测有利于提高卵巢癌临床诊断效能[6-7]。但目前关于如何联合诊断对疾病高危人群临床筛查价值最佳,仍无统一的确切的定论。因此,本研究旨在通过超声联合血清SMRP、CEA水平检测,探究联合诊断对卵巢癌的检出率,进而为该病的临床治疗提供依据。
1 资料与方法
1.1 一般研究
选取2015年1月-2017年1月本院收治的120例卵巢肿块患者,所有患者均行手术后病理检查,依据病理检查结果,将患者分为卵巢癌组(55例)和良性肿瘤组(65例)。其中卵巢癌组患者年龄34~74岁,平均(52.8±5.6)岁;绝经9例;依据国际妇产科联盟(FIGO)关于卵巢癌肿瘤分期标准[8]:Ⅰ期10例,Ⅱ期14例,Ⅲ、Ⅳ期31例。良性肿瘤组患者年龄35~72岁,平均(51.4±5.1)岁;绝经12例。另选取同期来我院体检的健康女性50例作为健康人群组。年龄36~71岁,平均(53.1±6.1)岁;绝经7例。3组患者年龄、绝经情况等资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院伦理委员会审核通过。
1.1.1 纳入标准 ①所有卵巢癌患者和良性肿瘤患者均经病理检查确诊;②所有卵巢癌患者均为首次发病,均为单发病灶;③健康体检者血细胞计数、血脂、肝肾功能均在正常范围,并排除相关肿瘤性疾病;④入组患者及健康体检者均知情同意,并签署知情同意书。
1.1.2 排除标准 ①排除肝肾功能不全及存在精神疾病患者;②排除妊娠及哺乳期妇女;③合并其他类型肿瘤疾病患者;④合并肝肾心脑血管疾病、合并免疫系统疾病、合并感染性疾病患者。
1.2 方法
1.2.1 超声检测 采用Voluson E8 Tru ScanTM实时4维彩色多普勒超声波诊断仪,所有患者均行经腹超声检查、经阴道超声检查和彩色多普勒超声检查。腹部超声检查前患者应适当充盈膀胱,取仰卧位,腹部检查时探头频率为2.5~6.0 Hz;阴道超声检查前应先排空膀胱后取截石位,探头频率为6.0~9.0 Hz。先行二维超声筛查,后行彩色多普勒超声。二维超声检查中依据病灶检查情况调整聚焦部位和深度,以获得清晰的二维图像。彩色超声检查过程中选择低流速范围以尽量显示低速血流,取样时调至血流最明亮处的感兴趣区域以获得清晰频谱(至少获得3个周期以上频谱)。采集卵巢形态、肿块大小、边界、位置、内部回声、有无包膜、盆腔有无积液、血管分布、血流信号,血流阻力指数(resistance index, RI)和搏动指数(pulsatile index PI)等信息。
1.2.2 血清SMRP﹑CEA测定 所有患者入组后,取肘静脉血5 ml,3 000 r/min离心15 min,取血清,采用ELISA测定SMRP、CEA水平,试剂盒由上海酶联免疫生物公司提供(SMRP生产批号:20170410;CEA生产批号:20170601),具体步骤参照说明书进行操作。
1.2.3 研究方案 首先比较患者血清SMRP、CEA水平差异,同时比较卵巢肿块患者超声血流参数,然后,分别采用多普勒超声、血清SMRP、血清CEA以及血清SMRP+CEA联合诊断和多普勒超声联合血清SMRP+CEA,并进行ROC曲线分析。
1.2.4 结果判定标准[9-11]①彩色多普勒超声。a彩色血流:肿块内部未检测到血流信号或血流稀少记为阴性,以肿块内部显示丰富血流信号(增益为-3,功率为35 kHz,RI<0.4)记为阳性;b包膜:包膜不完整记为阳性,包膜光滑完整记为阴性;c边界:边界不清晰记为阳性,边界清晰、整齐为阴性;d盆腔积液:盆腔存在积液记为阳性,盆腔检测未存在积液记为阴性;e内部回声:回声不均记为阳性,回声强弱均匀记为阴性。以上符合任意4项及以上则判断为阳性(卵巢癌)。②SMRP:>2.20 nmol/L判定为阳性;③CEA:>5 ng/ml判定为阳性;④联合检测判定:不同检测方法中,超声检测阳性或血清检测阳性即判定为阳性,其中SMRP、CEA检测同时为阳性则判定为阳性。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验或方差分析,方差分析的两两比较用LSD-t检验。计数资料以率(%)表示,比较采用χ2检验,绘制ROC曲线,P<0.05为差异有统计学意义。
2 结果
2.1 血清SMRP、CEA水平比较
卵巢癌组、良性肿瘤组、健康人群组3组间血清SMRP、CEA水平比较差异有统计学意义(P<0.05);其中卵巢癌组血清SMRP、CEA水平高于良性肿瘤组和健康人群组,差异有统计学意义(P<0.05)。而良性肿瘤组和健康人群组SMRP、CEA水平比较差异无统计学意义(P>0.05)。见表1。
2.2 卵巢肿块患者多普勒超声血流参数比较
卵巢癌组患者RI和PI均低于良性组患者,差异有统计学意义(P<0.05)。见表2。
2.3 超声及血清SMRP、CEA单项和联合检测卵巢癌诊断效能比较
以病理学结果为金标准,超声联合血清SMRP、CEA水平联合检测的敏感性(92.7%)高于单项检测的敏感性(83.6%、72.7%、75.0% 及 80.0%)(P<0.05)。联合检测在提高卵巢癌检测敏感性的同时,还保持较高的特异性(80.0%)和Kappa值(85.8%),见表3。超声及血清SMRP、CEA单独和联合检测诊断卵巢癌的ROC曲线见附图,联合检测ROC曲线下面积为0.846(95%CI:0.753,0.941),超声、血清SMRP及CEA单独诊断的ROC曲线下面积依次为0.810(95%CI:0.755,0.881)、0.665(95%CI:0.607,0.768)、0.730(95%CI:0.686,0.830),联合检测 ROC 曲线下面积高于超声、血清SMRP及CEA单独诊断,差异有统计学意义(P<0.05)。
表1 3组患者血清SMRP、CEA水平比较 (±s)
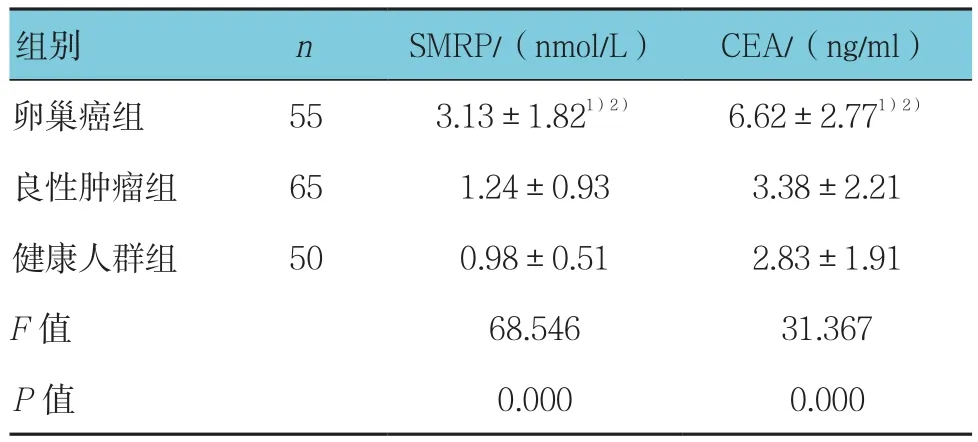
表1 3组患者血清SMRP、CEA水平比较 (±s)
注:1)与良性组比较,P <0.05;2)与健康组比较,P <0.05
组别 n SMRP/(nmol/L) CEA/(ng/ml)卵巢癌组 55 3.13±1.821)2) 6.62±2.771)2)良性肿瘤组 65 1.24±0.93 3.38±2.21健康人群组 50 0.98±0.51 2.83±1.91 F值 68.546 31.367 P值 0.000 0.000
表2 卵巢肿块患者多普勒超声血流参数比较 (±s)
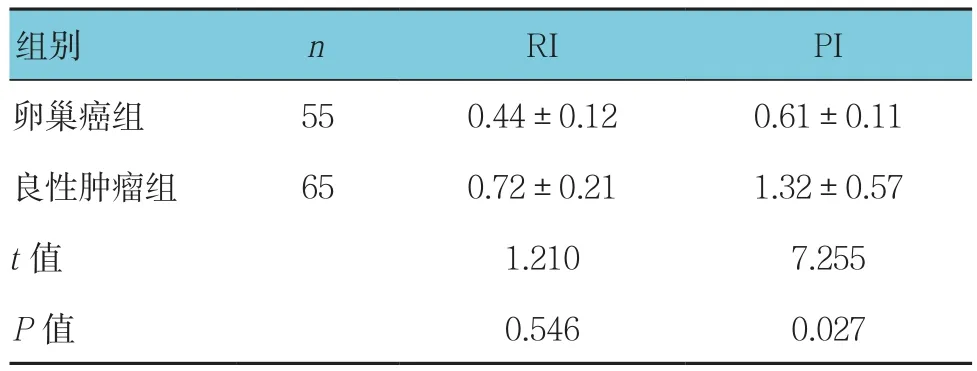
表2 卵巢肿块患者多普勒超声血流参数比较 (±s)
组别 n RI PI卵巢癌组 55 0.44±0.12 0.61±0.11良性肿瘤组 65 0.72±0.21 1.32±0.57 t值 1.210 7.255 P值 0.546 0.027
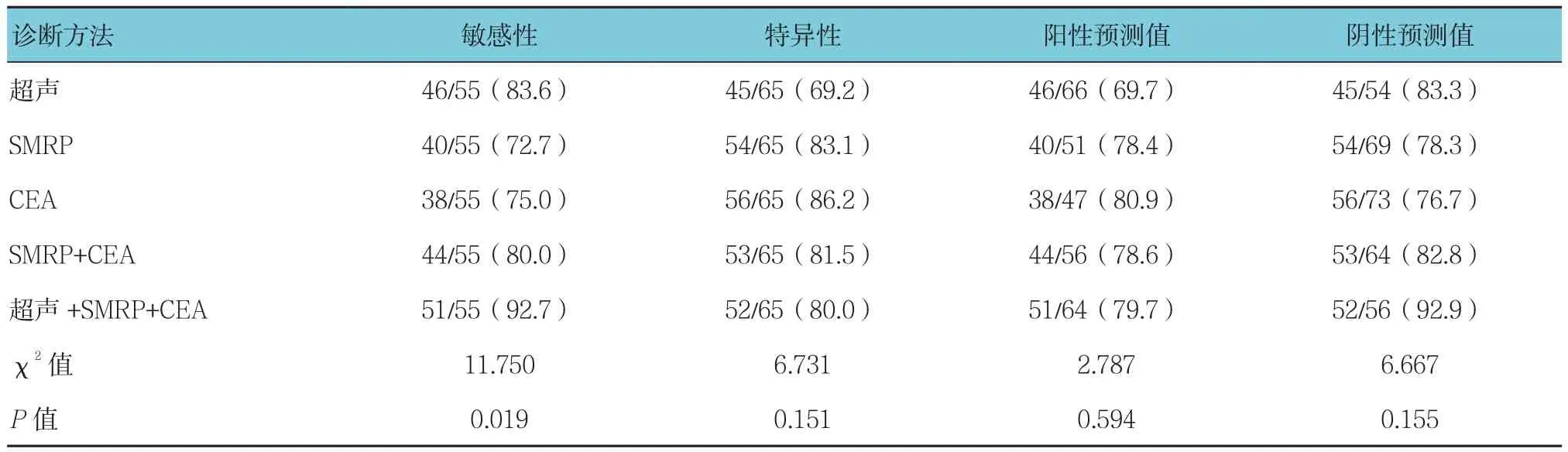
表3 超声及血清SMRP、CEA单项检测和联合检测卵巢癌诊断效能比较 %
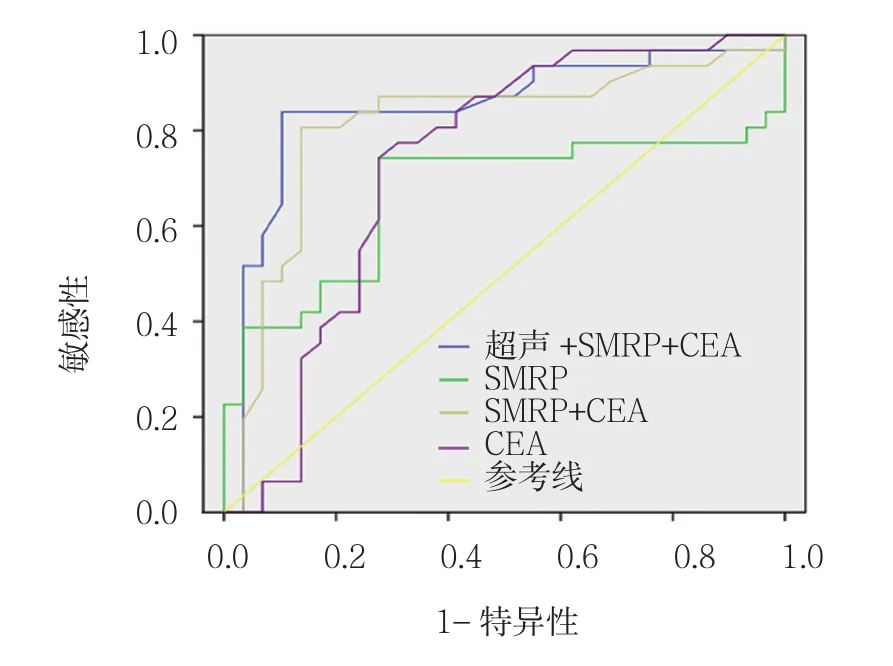
附图 ROC曲线图
3 讨论
卵巢癌属于生殖系统常见恶性肿瘤,统计资料显示近年来卵巢癌的发病率不断上升,但由于其早期临床症状较为隐匿和卵巢结构的特殊性,多数患者确诊时病情已经进展至晚期,患者错过最佳根治术治疗时机,患者术后5年生存率大大降低[12]。因此,寻求一种便捷、高效的诊断方式提高早期卵巢癌临床筛查的检出率对于疾病确诊、临床治疗及改善预后具有重要意义。
超声检查是卵巢癌病情确诊的重要手段,具有创伤小、操作便捷的优点。超声检查能够清晰显示肿块的形态和结构,并通过检测肿瘤血管生成特点进一步鉴别其良性或是恶性病变。本研究中发现,卵巢癌组患者RI及PI低于良性肿瘤组与上述分析相符,且单用超声检查诊断卵巢癌的敏感性为83.6%。分析认为正常的卵巢组织动脉及静脉血管大致呈平行藤蔓趋势分布,而肿瘤病灶由于肿瘤细胞不断增殖,血管异常新生,因此肿瘤病灶处血管分布多杂乱无规律,容易形成血管网中的动静脉短路。恶性肿瘤生长速度较快,血管不断新生,因此容易形成较大压力差超声显像结果多为血流阻力较低,血流速度较快,血流显示信号丰富。相较恶性肿瘤,良性肿块及其周围组织血流阻力指数较高,血流不丰富,因此其超声检查结果血管信号并不明显。因此采用多普勒超声对卵巢及周围组织器官进行成像能够清晰反映该部位的血流状况,有利于对肿块的良性或恶性病变作出区分。但超声诊断的特异性仅为69.2%,分析认为,临床超声筛查中发现部分恶性肿瘤病灶显像结果会出现良性病变的特征,而类似卵巢畸胎瘤等部分良性肿块,病灶周围组织发生病变、缺血,肿块内部结构紊乱,因此超声显像结果由于变性、缺血等原因,造成肿瘤内部结构紊乱,从图像特征看无法与恶性肿瘤区分[13]。因此,多普勒超声检查单独用于卵巢癌诊断时存在误诊和漏诊。
研究表明,超声检查联合血清肿瘤标志物联合检测能够提高疾病诊断的准确度[14]。血清肿瘤标志物是由肿瘤细胞生成并释放到血液中的一类能够反应疾病发生、病情进展、预后以及复发的一类化学物质。目前临床上一直致力于寻找一种或者多种肿瘤标志物联合超声诊断用于提高早期疾病的检出率,但具体联合何种血清肿瘤标志物具有良好的诊断价值,临床上尚无明确的定论。CEA是一种胚胎性致癌抗原,在乳腺癌、大肠癌、胰腺癌等肿瘤组织中均呈高表达,是目前临床应用较为广泛的一种肿瘤标志物,但单独应用于卵巢癌诊断时其灵敏度和特异性均不高,但相关研究表明其对上皮性卵巢癌具有较好的诊断效能[15]。SMRP是一种新发现的肿瘤细胞表面抗原,由间皮细胞表达,具有3种异构其中一种可从细胞表面脱落入血,称可溶性间皮素相关蛋白,与胰腺癌、卵巢癌、间皮瘤等肿瘤发病和病情分期密切相关。SMRP分子量明显低于目前临床常用的血清肿瘤标志物CA125,所以,理论上SMRP诊断的敏感性要高于CA125[16]。徐宝琳等[17]发现,卵巢癌患者血清中SMRP明显升高,有望成为卵巢癌诊断的标志物。石榴花等[18]研究学者发现,单独检测卵巢癌患者血清CEA其诊断敏感性为57%,特异性为82%,而单独检测SMRP特异度度可达80.0%。本文结果显示卵巢癌组血清CEA及SMRP均高于良性肿瘤组合健康人群,与上述分析相符,提示上述两种血清标志物对卵巢癌的疾病诊断具有一定的临床意义。以病理诊断为金标准进一步比较其单独诊断、联合诊断以及与超声联合诊断的效能发现,两种血清标志物诊断灵敏度及特异度均不高,但与已有的临床报道接近[19-20],而仅血清标志物联合能够一定程度提高诊断敏感性,但仍只有80.0%,而多普勒超声联合血清CEA及SMRP诊断时,敏感性(92.7%)、阴性预测值(92.9)、Kappa值(85.8%)均高于其他单独检测以及血清联合检测方式,进一步采用ROC曲线分析发现多普勒超声联合血清CEA及SMRP诊断ROC曲线下面积高于超声、血清SMRP、CEA单独应用于卵巢癌诊断。考虑可能的原因为一种肿瘤可释放多种肿瘤标志物,而一种肿瘤标志物可能会在多种恶性肿瘤中呈现高表达。因此敏感性较低,血清单独诊断时并无明显优势,而联合超声能够弥补各自的不足通过将影像学检查和实验室血清检查结合起来用于疾病评估,从不同方面反映病情的发生及进展能够明显降低疾病早期筛查的漏诊率。
总之,超声联合血清SMRP、CEA水平检测可提高卵巢癌诊断的敏感性,并能够保持较高的特异性,能够弥补单独检测的不足,对卵巢癌的的早期筛查诊断具有一定价值。
