FeSO4引发提高秦艽种子萌发的生理机制*
2018-11-29牛晓雪李保华董学会
牛晓雪, 牟 萌, 李保华, 董学会
FeSO4引发提高秦艽种子萌发的生理机制*
牛晓雪1,2, 牟 萌1, 李保华1, 董学会2**
(1. 潍坊市农业科学院 潍坊 261071; 2. 中国农业大学农学院 北京 100193)
为探讨FeSO4引发提高秦艽种子萌发抗性的生理机制, 同时设置水引发处理, 以未作任何处理的种子为对照(CK), 研究了0.6% FeSO4引发处理24 h对种子膜透性、储藏性物质、能量、激素及抗性相关酶等方面的影响。结果表明: FeSO4引发降低了种子膜透性, 提高种子活力, 在吸水12 h和24 h时, 电导率分别较CK降低了6.61%和11.67%; 调动了种子内部储藏物质的代谢, 蔗糖含量减少9.57%, 可溶性蛋白增加49.63%, 饱和脂肪酸中的豆蔻酸和木焦油酸甲酯含量分别增加4.93%和9.03%, 不饱和脂肪酸中的山嵛酸、油酸、亚油酸和亚麻酸分别减少6.73%、8.18%、8.40%和6.70%; 改变了种子激素平衡, 其中脱落酸的含量下降64.78%, 赤霉素含量增加近22倍; 加速了种子能量代谢, ATP含量增加2.16倍, 细胞色素C氧化酶活性增加67.91%。此外, FeSO4引发使线粒体非酶促系统中谷胱甘肽含量和抗坏血酸的含量分别增加74.08%和10.89%, 使细胞内酶促系统超氧化物歧化酶、过氧化氢酶和抗坏血酸过氧化物酶活性分别增加285%、179%以及19.6%。因此, FeSO4引发对种子萌发是一个综合过程, 一方面可促进种子物质代谢和提高能荷水平, 一方面可改善种子内部生理状态和提高胁迫响应能力, 从而提高种子活力, 促进种子快速和整齐萌发。
种子引发; 秦艽; FeSO4引发; 水引发; 萌发; 生理机制
秦艽()为龙胆科(Gentianaceae)龙胆属的多年生草本植物, 以根入药, 被用作中国草药已有两千多年的历史[1], 是国家三级重点保护植物。秦艽主要靠种子进行繁殖, 但其种子小、寿命短、产量低、有后熟作用, 且在生产实践育苗过程中存在发芽率低、发芽不整齐、出苗时间长等情况, 严重制约着秦艽的规范化种植与生产。种子引发是一项控制种子缓慢吸水并回干的播前种子处理技术, 它可使种子处于“萌发”的状态, 而胚根不突破种皮。现在, 种子引发技术在许多农作物上被用来改变种子的萌发和出苗性质[2]。经过引发的种子不仅能够提高农作物的出苗速率、出苗整齐度、节约种子用量、减少成本, 而且还可提高幼苗素质, 增强苗期抗逆性能[3-11]。在比较多种引发剂对秦艽种子萌发影响的试验[12]中发现, FeSO4效果最好, 不仅能够解决生产实际育苗中存在的问题, 且提高了种子抗低温和耐高温的能力, 该方法显著优于目前研究中常采用的药剂处理、温差处理和物理处理等方法。在大豆()种子研究中[13], 也发现用FeSO4能够提高种子的发芽率、发芽指数和活力指数。除此之外, 以FeSO4作为引发剂的研究鲜见报道, 有关FeSO4引发机理的研究未见报道。本文以秦艽种子为研究对象, 通过比较FeSO4引发的种子与未处理的种子在储藏物质、能量、激素以及某些酶等方面的差异, 了解FeSO4引发导致的种子内部变化, 探讨FeSO4引发提高种子萌发表现的相关机理, 为其在非生物胁迫应答中的作用提供理论依据, 也为FeSO4引发技术在其他植物种子生产中应用提供理论参考。
1 材料与方法
1.1 供试材料
试验所用秦艽种子于2012年采收于陕西省宝鸡市陇县八渡镇中国农业大学试验基地, 种子试验前进行以下处理: 1)通过风选去掉大杂、秕粒及破损的种子; 2)通过0.45 mm筛子剔除小粒种子, 挑选大小均匀且饱满的种子用于试验, 种子试验前于4 ℃保存。
1.2 试验设计
参照文献[12], 取一定重量的上述种子约5 g用0.6%(/)FeSO4溶液在20 ℃的恒温环境下避光处理24 h, 用蒸馏水清洗掉表面多余的FeSO4溶液, 将处理的种子铺放在20 ℃的恒温环境下直至水分恒定, 所得样品为FeSO4引发所得种子; 取一定重量的上述种子约5 g用蒸馏水在相同的环境下避光处理24 h, 之后于20 ℃的恒温环境下直至水分恒定, 所得样品为H2O引发所得种子, 此样品作为FeSO4引发所得种子对照, 排除H2O影响; 另一对照(CK)为未作任何处理的上述供试种子。每个处理重复4次。FeSO4引发、H2O引发、CK所得种子立刻直接用于各项生理生化指标的测定, 待测样品于4 ℃保存。
1.3 测定指标及方法
1.3.1 种子电导率的测定
取各处理0.25 g()放入干净的玻璃试管, 用去离子水冲洗3次, 然后加入去离子水15 mL, 用DDS-11A型电导率仪测定各处理的初始电导率(1)作为对照, 将其放在20 ℃的恒温环境下, 分别在浸泡后的2 h、4 h、8 h、12 h、24 h测定浸泡液的电导率(2), 按公式[种子电导率(µS∙cm-1∙g-1)=(2-1)/]计算各处理的电导率。
1.3.2 种子储藏物质的测定
取各处理后的种子0.25 g, 参照植物生理学实验指导[14]采用比色法测定各类可溶性糖(蔗糖、果糖、葡萄糖)、可溶性总糖和淀粉含量; 取各处理后的种子0.20 g, 研磨粉碎后采用凯氏定氮法测定粗蛋白含量; 取各处理1 g, 采用气相色谱法测定脂肪酸含量, 在中国农业大学农业部饲料效价与安全监督检验测试中心完成。
1.3.3 激素、腺苷三磷酸及抗氧化酶活性含量的测定
取各处理后的种子0.2 g, 参照何钟佩酶联免疫法(ELISA)[15]测定激素ABA和GA3含量, 在中国农业大学植物生理与生物化学国家重点实验室完成; 取各处理后的种子0.5 g, 参照种子生物学研究指南[16]采用荧光素酶法测定腺苷三磷酸含量,采用紫外分光光度计法测定超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)含量。
1.3.4 线粒体完整性及内相关酶的测定
取各处理后的种子5 g, 置于铺有两层滤纸的培养皿中, 加入足量的蒸馏水, 在恒温培养箱20 ℃光/暗交替环境下培养24 h, 取出吸干表面多余的水分, 迅速放入液氮中冷冻,-40 ℃保存待提取。种子线粒体的提取参照Yin等[17]的方法; 线粒体完整性的测定参照Hernández等[18]方法; 细胞色素氧化酶(COX)活性测定参考Neuburge[19]的方法; 谷胱甘肽(GSH)以及总谷胱甘肽(GSH+GSSG)含量, 抗坏血酸(ASC)和总抗坏血酸(ASC+DHA)含量的测定参照种子生物学研究指南[16]。
1.4 数据处理
所有数据均以4次重复的平均值及标准差(SD)表示, 采用Microsoft Excel处理数据和作图, 用SPSS 17.0进行数据统计和分析, 并运用Duncan检验法对显著性差异(<0.05)进行多重比较。
2 结果与分析
2.1 FeSO4引发处理对秦艽种子电导率的影响
种子浸出液的电导率是种子活力检验中的常规指标, 可以有效反映细胞膜透性能力的大小, 而浸出液的电导率又与种子活力呈负相关。由图1可知, 随着浸泡时间的延长, CK、H2O引发和FeSO4引发种子电导率均呈升高趋势。种子在浸泡8 h以前, 此阶段种子处于吸水模式第Ⅰ阶段快速吸水期, 电导率表现为FeSO4引发>CK>H2O引发, 可能是由于FeSO4引发后存在于细胞间隙中的铁离子外渗导致; 8 h以后吸水稳定, 电导率CK>H2O引发>FeSO4引发, FeSO4引发种子电导率与CK差异显著(0.05), 在吸水12 h、24 h, 分别较CK降低了6.61%、11.67%, 说明FeSO4引发通过降低种子膜透性, 使种子活力均高于H2O引发和CK, FeSO4引发提高了种子活力。
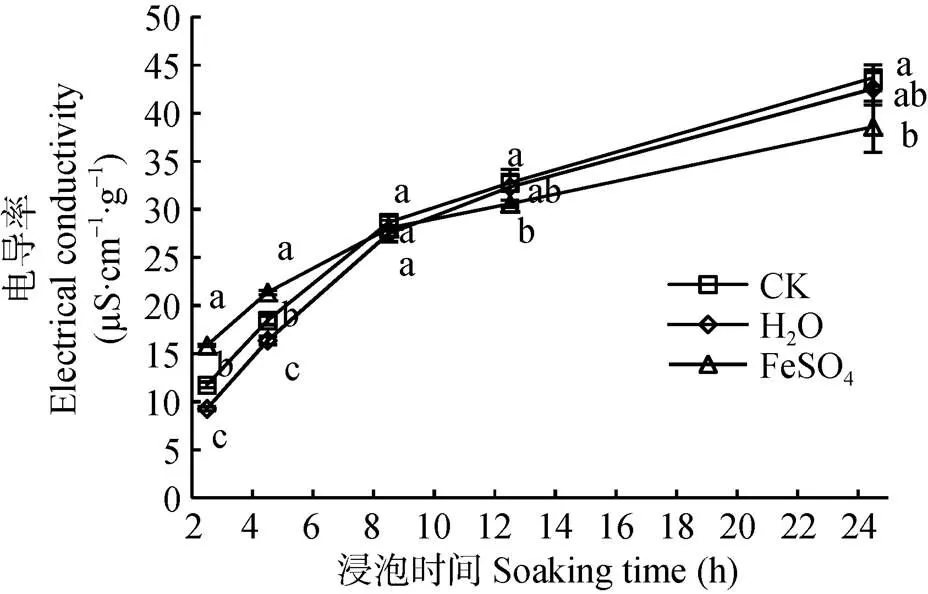
图1 不同引发剂处理对秦艽种子电导率的影响
同一时间不同字母表示处理间差异显著(<0.05)。At the same soaking time, different lowercase letters indicate significant differences among different treatments (0.05).
2.2 FeSO4引发处理对秦艽种子储藏物质的影响
表1表明, FeSO4引发能够显著降低蔗糖含量, 较CK降低9.57%, 对葡萄糖、果糖和淀粉含量无影响; H2O引发对种子内可溶性总糖、葡萄糖、蔗糖、果糖和淀粉含量无影响。此外, 引发还能显著提高种子内可溶性蛋白的含量, H2O引发和FeSO4引发较CK分别增加13.0%和49.63%。
从表2中可以看出, 秦艽种子脂肪酸由豆蔻酸、棕榈酸、棕榈一烯酸、硬脂酸、油酸、亚油酸、亚麻酸、花生一烯酸、山嵛酸、山嵛酸甲酯和木焦油酸甲酯组成。以不饱和脂肪酸为主, 不饱和脂肪酸含量平均值可达91.34%, 其中亚油酸含量最高, 其次为油酸。FeSO4引发对饱和脂肪酸中的棕榈酸、硬脂酸、花生一烯酸和山嵛酸甲酯4种含量基本无影响, 但却显著(0.05)提高了豆蔻酸和木焦油酸甲酯的含量, 较CK分别增加4.93%和9.03%; 对不饱和脂肪酸中除棕榈一烯酸外的其他4种脂肪酸山嵛酸、油酸、亚油酸和亚麻酸有显著降低的作用, 较CK分别减少6.73%、8.18%、8.40%和6.70%。H2O引发对除硬脂酸外的其他脂肪酸含量无显著影响, 硬脂酸含量较CK降低5.05%。
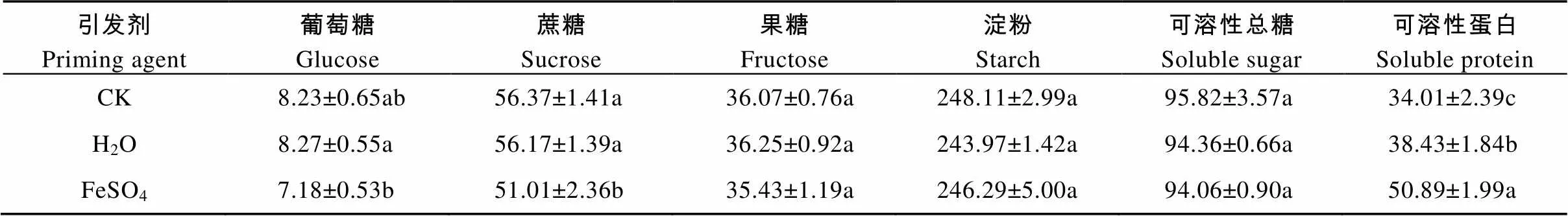
表1 不同引发剂处理对秦艽种子内储藏物质的影响
同列不同字母表示差异显著(<0.05)。Different lowercase letters in the same column indicate significant differences (0.05).
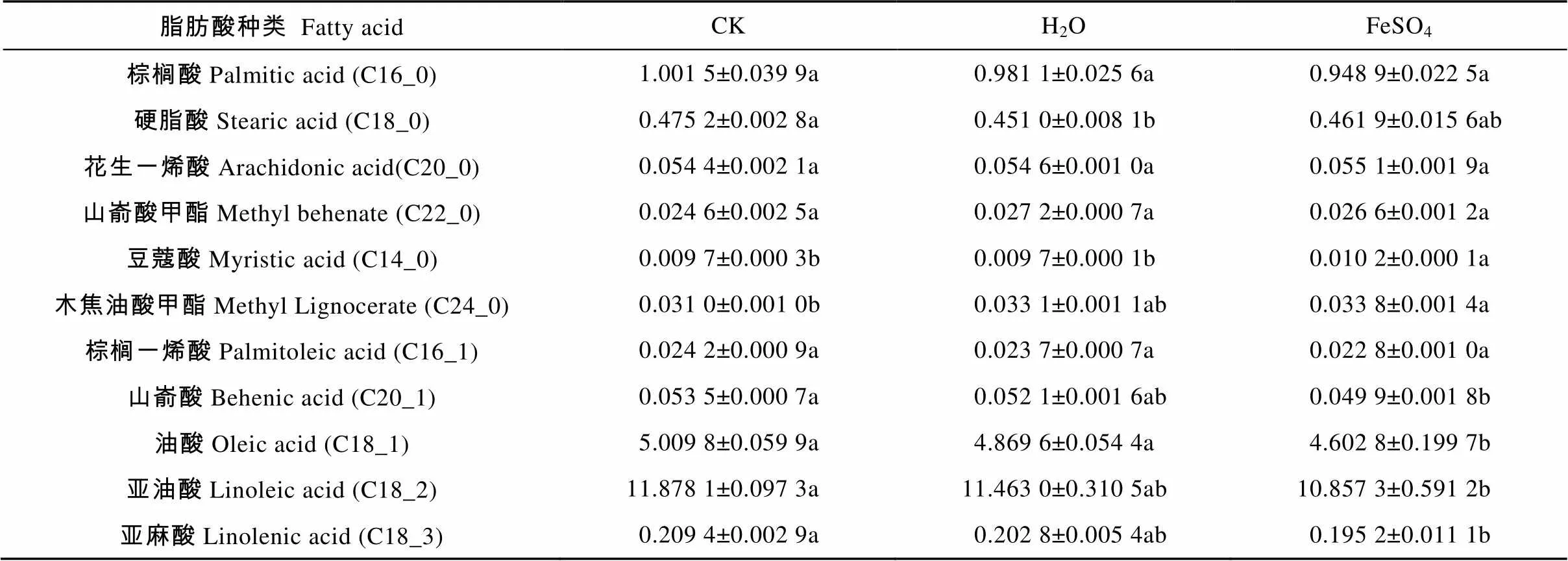
表2 不同引发剂处理对秦艽种子脂肪酸含量的影响
同行不同字母表示差异显著(<0.05)。Different lowercase letters in the same line indicate significant differences (< 0.05).
2.3 FeSO4引发处理对秦艽种子内激素和ATP含量的影响
CK、H2O引发和FeSO4引发秦艽种子内源激素(包括ABA、GA含量及GA/ABA比值)和ATP含量结果如表3所示。从表中可以看出, FeSO4引发降低了种子内ABA的含量, 分别较H2O引发和CK减少17.14%和64.78%; 提高了种子内GA的含量, 分别较H2O引发和CK增加16.09倍和21.54倍。引发通过改变种子内部ABA和GA含量而改变了GA/ABA的比值, FeSO4引发分别较H2O引发和CK增加24.07倍和39.78倍。FeSO4引发显著提高了种子内部ATP含量, 较H2O引发和CK分别增加2.18倍和2.16倍; H2O引发对秦艽种子内部的ATP含量无显著影响。

表3 不同引发剂处理对秦艽种子激素(ABA、GA)含量、GA/ABA比值及ATP含量的影响
同列中不同字母表示差异显著(<0.05)。Different lowercase letters in the same column indicate significant differences (< 0.05).
2.4 FeSO4引发处理对秦艽种子内线粒体完整性及其内部相关酶的影响
线粒体外膜完整性通过细胞色素氧化还原酶活性测定, Triton X-100能够破碎完整的线粒体, 通过测定Triton加入前后细胞色素氧化还原酶活性之比来确定线粒体的完整性。从表4可以看出, FeSO4引发提高了种子内线粒体COX的活性(加入Triton后), 分别较H2O引发和CK增加33.91%和67.91%, Triton加入前后两者之间的差值即完整线粒体的活性, FeSO4引发、H2O引发和CK平均值分别为0.05 U×g-1×min-1、0.064 U×g-1×min-1和0.056 U×g-1×min-1, 三者之间差异不显著; FeSO4引发降低了线粒体完整性, 分别较H2O引发和CK减少了35.83%和43.57%, 表明线粒体的数量有所增加, 引发过程中存在新的线粒体的合成。
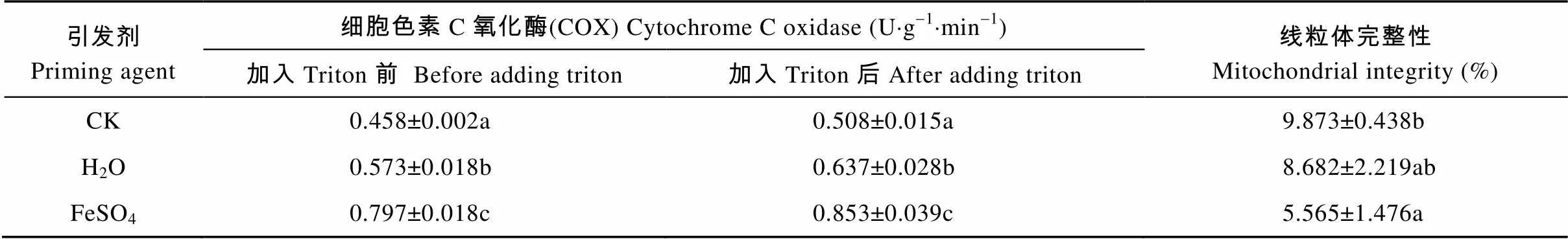
表4 不同引发剂处理对秦艽种子线粒体完整性的影响
同列不同字母表示差异显著(<0.05)。Different lowercase letters in the same column indicate significant differences (< 0.05).
从表5可以看出FeSO4引发显著提高了线粒体中GSH的含量, 分别较H2O引发、CK增加49.86%、74.08%; 显著降低了GSSG的含量, 较CK减少22.59%, 与H2O引发差异不显著。引发处理前后GSH的含量低于GSSH, FeSO4引发通过提高线粒体内GSH的含量、降低GSSG的含量, 使得GSH/GSSG的比值升高, 相对于H2O引发和CK分别增加0.56倍和1.06倍。
从表5可以看出引发增加了线粒体内ASC和DHA的含量, 降低了ASC/DHA的比值。与CK相比, FeSO4引发使ASC的含量显著增加10.89%, H2O引发所得ASC含量与FeSO4引发差异不显著; FeSO4引发显著提高了DHA的含量, 分别较H2O引发和CK增加0.28倍和1.15倍。引发处理前后线粒体内ASC的含量高于DHA, FeSO4引发虽然使得ASC、DHA含量增加, 但由于DHA增幅较快, 导致了种子内ASC/DHA的比值急剧降低, 分别较H2O引发和CK显著降低24.10%和48.64%。
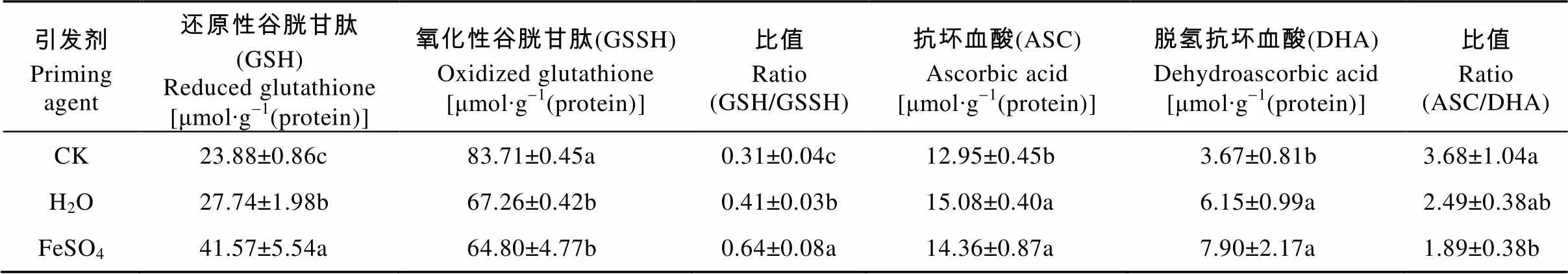
表5 不同引发剂对秦艽种子线粒体内非酶促保护系统酶的影响
同列不同字母表示差异显著(<0.05)。Different lowercase letters in the same column indicate significant differences (< 0.05).
2.5 FeSO4引发处理对秦艽种子抗性相关酶的影响
CAT、APX能有效清除代谢过程中生成的H2O2, 保护膜免受自由基伤害; SOD是植物体内清除活性氧自由基的关键酶, 其活性的强弱与植物抗氧化能力密切相关; MDA是脂质过氧化的主要产物, 其含量高低可以反映植物膜系统的受伤程度。由表6可见, FeSO4引发增加了种子内部CAT、APX和SOD活性, 3种酶的变化趋势一致, 与H2O引发相比分别提高了52.88%、36.43%、和16.92%, 与CK相比分别提高了2.85倍、1.79倍和0.20倍, 差异显著。FeSO4引发增加了种子内部MDA的活性, 分别较H2O引发和CK显著提高1.19倍和0.85倍。
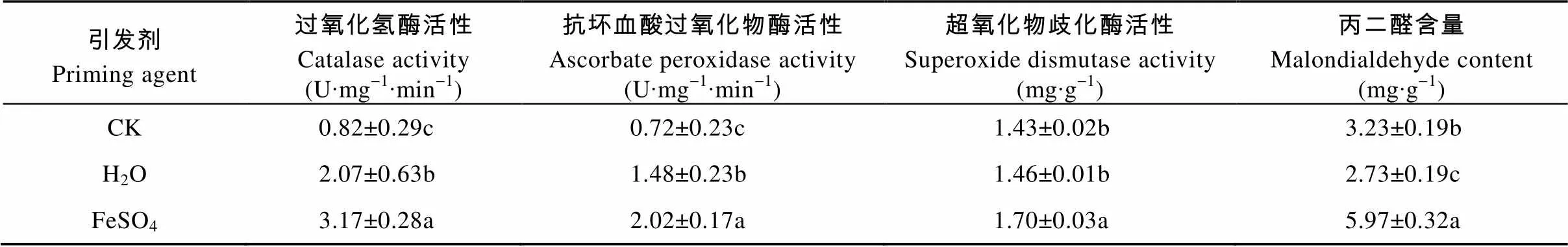
表6 不同引发剂对秦艽种子抗性相关酶的影响
同列不同字母表示差异显著(<0.05)。Different lowercase letters in the same column indicate significant differences (< 0.05).
3 结论与讨论
种子在储藏过程中膜结构的损伤会使种子内部有机物质大量外泄, 导致种子活力下降。本研究发现随着浸泡时间的延长, 引发种子的电导率均降低, 且FeSO4引发后所得种子电导率最低, 与杨小环等[20]在大豆种子引发试验中的研究结果一致; 这或许是引发过程中存在损伤的细胞、细胞器膜结构的修复和重组, 使膜的完整性增强透性降低。另外, 在对线粒体研究过程中, 发现COX的活性明显提高, 但线粒体的完整性降低, 这可能存在新的不完整的线粒体的合成, 而线粒体的活性与种子的活力密不可分。由此认为, 引发通过提高种子活力来增强种子萌发过程中的耐逆性, 改变种子萌发特性。
对FeSO4引发的种子中各个代谢物质进行研究发现, 引发之所以能够提高种子萌发的另一个主要原因是引发改变了种子的萌发状态, 提前启动萌发。蛋白质、淀粉和脂肪等营养物质含量的变化反映了种子的存在状态, 可溶性糖含量是种子能否顺利萌发和生长的重要生理基础; 脂类、淀粉是种子萌发期间所需养分和能量的主要来源; 可溶性蛋白大多数是参与各种代谢的酶类, 其含量的变化是显示胚生命活动强弱的重要指标。本文研究结果发现, FeSO4引发后种子内部糖、蛋白、脂肪酸等物质代谢规律与种子萌发过程中变化规律一致[21-23]。激素是植物生长发育过程中起关键作用的物质, 种子从成熟到之后的萌发过程中都会受到激素的调控。GA具有解除种子休眠、促进种子萌发和拮抗ABA的作用, 它可以通过促进基因表达、激活种子中多种水解酶活性、合成与萌发相关的新酶来促进种子萌发; ABA在种子萌发过程中拮抗GA诱导储藏物质的转化来诱导、维持种子休眠和抑制种子的萌发[24-25]。本研究发现FeSO4引发通过调控秦艽种子内部ABA、GA的含量, 促进了种子萌发, 其变化趋势同大量种子萌发实验过程中测定结果一致[26-32]。对FeSO4引发种子内部ATP含量进行测定, 结果发现引发对ATP含量有显著提高作用, 在番茄()、茄子()、南洋杉()、菠菜()、燕麦()和卷心菜()种子的引发研究中[33], 也发现同样的结果, 而ATP的产生是种子萌发初期主要的代谢活动变化[34], 由此说明引发促进了种子萌发。
除此之外, 我们还认为引发本身就是一个胁迫, 在引发过程中可以使植物产生抗性。植物体内存在两类保护系统[35]: 一类是包括SOD、POD等在内的酶促保护系统, 另一类是包括GSH、AsA等在内的非酶促保护系统。它对于种子内部ROS的清除、减少种子内部细胞损伤具有重要作用。我们对FeSO4引发后的秦艽种子内部的两类保护系统相关酶进行测定, 结果发现, FeSO4引发使得SOD、APX、CAT、GSH、ASC等的活性均增强, 说明种子在引发过程中, 可诱导建立防御体系, 在遇到同样逆境条件下, 引发种子会表现出较强的萌发特性。本研究结果与Khaliq等[36]在玉米()种子硒引发, 刘洁[37]在对老化葫芦种子引发以及Chen等[35]对菠菜种子的引发结果一致。
综上所述, 秦艽种子在FeSO4引发过程中, 提高了种子活力, 内部发生一系列的生理生化反应, 改变了种子的激素、储藏物质、能量物质、酶等代谢水平, 使种子向着萌发的方向做准备, 提前启动萌发; 引发过程相当于胁迫, 提高了种子内部抗氧化系统活性。种子在回到原始含水量时, 这些变化不会消失, 进而提高了种子萌发特性。
[1] NIU X X, CHEN X W, SU H, et al. Changes of secondary metabolites and trace elements inflowers: A potential medicinal plant part[J]. Chinese Herbal Medicine, 2014, 6(2): 145–151
[2] BRADFORD K J. Manipulation of seed water relations via osmotic priming to improve germination under stress conditions[J]. Hortscience, 1986, 21(5): 1105–1112
[3] 阮松林, 薛庆中, 王清华. 种子引发对杂交水稻幼苗耐盐性的生理效应[J]. 中国农业科学, 2003, 36(4): 463–468 RUAN S L, XUE Q Z, WANG Q H. Physiological effects of seed priming on salt-tolerance of seedlings in hybrid rice (L.)[J]. Scientia Agricultura Sinica, 2003, 36(4): 463–468
[4] IQBAL M, ASHRAF M. Seed preconditioning modulates growth, ionic relations, and photosynthetic capacity in adult plants of hexaploid wheat under salt stress[J]. Journal of Plant Nutrition, 2007, 30(3): 381–396
[5] KORKMAZ A, KORKMAZ Y. Promotion by 5-aminolevulenic acid of pepper seed germination and seedling emergence under low-temperature stress[J]. Scientia Horticulturae, 2009, 119(2): 98–102
[6] CHEN K, ARORA R, ARORA U. Osmopriming of spinach (L. cv. Bloomsdale) seeds and germination performance under temperature and water stress[J]. Seed Science and Technology, 2010, 38(1): 36–48
[7] 杨小环, 马金虎, 郭数进, 等. 种子引发对盐胁迫下高粱种子萌发及幼苗生长的影响[J]. 中国生态农业学报, 2011, 19(1): 103–109 YANG X H, MA J H, GUO S J, et al. Effect of seed priming on sorghum (L.) seed germination and seedling growth under salt stress[J]. Chinese Journal of Eco-Agriculture, 2011, 19(1): 103–109
[8] 肖雪峰, 刘丽, 郭巧生, 等. 种子引发对NaCl胁迫下通关藤种子萌发及幼苗生理特性的影响[J]. 中国中药杂志, 2015, 40(2): 218–225 XIAO X F, LIU L, GUO Q S, et al. Effects of seed priming on physiology of seed germination and seeding growth of Marsdenia tenacissima under NaCl stress[J]. China Journal of Chinese Materia Medica, 2015, 40(2): 218–225
[9] 谢娟娜, 路杨, 房琴, 等. 种子引发对小麦抗盐及抗旱特性影响综述[J]. 中国生态农业学报, 2016, 24(8): 1025–1034 XIE J N, LU Y, FANG Q, et al. Effect of seed priming on drought and salinity tolerance of wheat: An overview[J]. Chinese Journal of Eco-Agriculture, 2016, 24(8): 1025–1034
[10] 朱文彬, 王长林. 种子引发对盐碱地夏枯草出苗质量的影响[J]. 江苏农业科学, 2017, 45(4): 106–108 ZHU W B, WANG C L. Effect of seed priming on seedling quality of Prunella vulgaris on saline-alkali land[J]. Jiangsu Agricultural Sciences, 2017, 45(4): 106–108
[11] 马超, 孔蓓蓓, 张均, 等. 不同引发剂处理对水分胁迫下小麦发芽及幼苗生理特性的影响[J]. 核农学报, 2017, 31(2): 357–363 MA C, KONG P P, ZHANG J, et al. Effects of seed priming with different agents on seed germination and seedling physiological characteristics of wheat under dehydration stress[J]. Journal of Nuclear Agricultural Sciences, 2017, 31(2): 357–363
[12] 中国农业大学. 一种促进秦艽种子萌发的方法: 中国, 201310157467.2[P/OL]. 2015-03-04[2018-03-12]. http://www. soopat.com/Patent/201310157467#thisChina Agricultural University. Method for promoting germination ofL. seed : CN, 201310157467.2[P/OL]. 2015-03-04[2018-03-12]. http://www. soopat.com/Patent/201310157467#this
[13] 周长军, 李建英, 田中艳, 等. 大豆芽菜萌发条件研究[J]. 黑龙江农业科学, 2010, (11): 12–14 ZHOU C J, LI J Y, TIAN Z Y, et al. Study on germination and determination of material content of soybean sprouts[J]. Heilongjiang Agricultural Sciences, 2010, (11): 12–14
[14] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003: 127–132 ZHANG Z L, QU W J. The Experimental Guide for Plant Physiology[M]. Beijing: Higher Education Press, 2003: 127–132
[15] 何钟佩. 农作物化学控制实验指导[M]. 北京: 中国农业大学出版社, 1993: 60–68HE Z P. The Experimental Guide for Crops Chemical Control[M]. Beijing: China Agricultural University Press, 1993: 60–68
[16] 宋松泉. 种子生物学研究指南[M]. 北京: 科学出版社, 2005: 67–75 SONG S Q. The Research Guide for Seed Biology[M]. Beijing: Science Press, 2005: 67–75
[17] YIN G K, SUN H M, XIN X, et al. Mitochondrial damage in the soybean seed axis during imbibition at chilling temperatures[J]. Plant and Cell Physiology, 2009, 50(7): 1305–1318
[18] HERNÁNDEZ J A, CORPAS F J, GÓMEZ M, et al. Salt-induced oxidative stress mediated by activated oxygen species in pea leaf mitochondria[J]. Physiologia Plantarum, 1993, 89(1): 103–110
[19] NEUBURGE M. Preparation of plant mitochondria, criteria for assessement of mitochondrial integrity and purity, survival in vitro[M]//DOUCE R, DAY D A. Higher Plant Cell Respiration. Berlin, Heidelberg: Springer, 1985: 7–24
[20] 杨小环, 王玉国, 杨文秀, 等. 种子引发对水分胁迫下大豆幼苗生理特性的影响[J]. 中国生态农业学报, 2009, 17(6): 1191–1195 YANG X H, WANG Y G, YANG W X, et al. Effect of seed priming on physiological characteristics of soybean seedling under water stress[J]. Chinese Journal of Eco-Agriculture, 2009, 17(6): 1191–1195
[21] 张青, 李隆云, 孙年喜. 青蒿种子萌发过程中生理生化变化的研究[J]. 种子, 2011, 30(3): 10–13 ZHANG Q, LI L Y, SUN N X. Study on the change of physiology and biochemistry during process ofseed germination[J]. Seed, 2011, 30(3): 10–13
[22] 刘凤, 曹帮华, 蔡春菊, 等. 毛竹种子萌发过程中生理生化特性变化的研究[J]. 种子, 2009, 28(2): 12–14 LIU F, CAO B H, CAI C J, et al. Study on the change of physiology and biochemistry ofseed during germination[J]. Seed, 2009, 28(2): 12–14
[23] 杨忠仁, 郝丽珍, 张凤兰, 等. 沙葱种子萌发特性及脂质代谢变化规律试验[J]. 广东农业科学, 2013, 40(1): 31–34 YANG Z R, HAO L Z, ZHANG F L, et al. Dynamic change of germination character and lipid metablism ofRegel seed[J]. Guangdong Agricultural Sciences, 2013, 40(1): 31–34
[24] LINKIES A, LEUBNER-METZGER G. Beyond gibberellins and abscisic acid: How ethylene and jasmonates control seed germination[J]. Plant Cell Reports, 2012, 31(2): 253–270
[25] NAMBARA E, OKAMOTO M, TATEMATSU K, et al. Abscisic acid and the control of seed dormancy and germination[J]. Seed Science Research, 2010, 20(2): 55–67
[26] SCHWEMBER A R, BRADFORD K J. A genetic locus and gene expression patterns associated with the priming effect on lettuce seed germination at elevated temperatures[J]. Plant Molecular Biology, 2010, 73(1/2): 105–118
[27] EI-ARABY M M, MOUSTAFA S M A, ISMAIL A I, et al. Hormone and phenol levels during germination and osmopriming of tomato seeds, and associated variations in protein patterns and anatomical seed features[J]. Acta Agronomica Hungarica, 2006, 54(4): 441–457
[28] NAKAUNE M, HANADA A, YIN Y G, et al. Molecular and physiological dissection of enhanced seed germination using short-term low-concentration salt seed priming in tomato[J]. Plant Physiology and Biochemistry, 2012, 52: 28–37
[29] WANG L, HU X Y, JIAO C, et al. Transcriptome analyses of seed development in grape hybrids reveals a possible mechanism influencing seed size[J]. BMC Genomics, 2016, 17(1): 898
[30] 郑秀珍. 紫穗槐和刺槐种子萌发过程中内源激素含量及相关酶活性的动态变化[J].长江大学学报: 自然科学版, 2006, 3(3): 163–165 ZHENG X Z. Dynamic changes of some endogenous hormone content and activities of some related enzymes during the germination of seeds ofL. andL.[J]. Journal of Yangtze University: Natural Science Edition, 2006, 3(3): 163–165
[31] 陈博雯, 刘海龙, 陈晓明, 等. 2个油茶品种种子萌发过程中激素生理初探[J].山西农业科学, 2012, 40(8): 840–843 CHEN B W, LIU H L, CHEN X M, et al. Hormone physiology of twoAbel. species during seed germination[J]. Journal of Shanxi Agricultural Sciences, 2012, 40(8): 840–843
[32] 苏海兰, 周先治, 李希, 等. 云南重楼种子萌发过程内源激素含量及酶活性变化研究[J]. 核农学报, 2018, 32(1): 141–149 SU H L, ZHOU X Z, LI X, et al. Dynamic changes of enzyme and endogenous ofSmith var.seed during different stages of germination[J]. Journal of Nuclear Agricultural Sciences, 2018, 32(1): 141–149
[33] CHEN K, ARORA R. Priming memory invokes seed stress-tolerance[J]. Environmental and Experimental Botany, 2013, 94: 33–45
[34] WEITBRECHT K, MÜLLER K, LEUBNER-METZGER G. First off the mark: Early seed germination[J]. Journal of Experimental Botany, 2011, 62(10): 3289–3309
[35] CHEN K T, ARORA R. Dynamics of the antioxidant system during seed osmopriming, post-priming germination, and seedling establishment in spinach ()[J]. Plant Science, 2011, 180(2): 212–220
[36] KHALIQ A, ASLAM F, MATLOOB A, et al. Seed priming with selenium: Consequences for emergence, seedling growth, and biochemical attributes of rice[J]. Biological Trace Element Research, 2015, 166(2): 236–244
[37] 刘洁. 引发提高老化葫芦种子活力的机理研究[D]. 武汉: 华中农业大学, 2013: 21–23 LIU J. Research on mechanism of priming improving the vigor of aged gourd seeds[D]. Wuhan: Huazhong Agricultural University, 2013: 21–23
Physiological mechanism of FeSO4priming improvement of seed germination performances of*
NIU Xiaoxue1,2, MU Meng1, LI Baohua1, DONG Xuehui2**
(1. Weifang Academy of Agricultural Sciences, Weifang 261071, China; 2. College of Agronomy and Biotechnology, China Agricultural University, Beijing 100193, China)
is a widely used ingredient in traditional Chinese medicine for more than 2 000 years. Now, it is under third-class protection in China and on the list of National Key Protected Wild Herbs.is a seed-propagated plant with extremely low germination rate. Short seed vigor, lower seed yield and after-ripening severely hinder its seedling establishment and significantly raise nursery cost. Various priming methods have shown that ferrous priming is better than other liquid priming, having higher germination performance under both optimal and adverse environments than non-primed seeds. The objectives of this study was to investigate the physiological mechanism of FeSO4priming increasing seed germination performance ofto lay the theoretical basis for FeSO4priming in abiotic stress response and application of FeSO4priming technology in other plants seeds. Compare with non-priming of seeds, we investigated the effects of 0.6% FeSO4priming on seed membrane permeability, stored material metabolism, energy metabolism, hormone homeostasis and enzyme activity. In this study, we noted that FeSO4reduced seed membrane permeability and improved seed vigor by decreasing electrical conductivity by 6.61% at 12 h, 11.67% at 24 h. The mobilization of stored materials such as sugars, proteins and fatty acids were activated, sucrose content decreased by 9.57%, and soluble protein content increased by 49.63%. With regard fatty acids, content of saturated fatty acids increased by 4.93% for myristic acid and 9.03% for methyl lignocerate. Then the content of unsaturated fatty acids decreased by 6.73% for behenic acid, 8.18% for oleic acid, 8.40% for linoleic acid and 6.70% for inolenic acid. In addition, FeSO4priming altered hormone homeostasis of seeds between ABA and GA, of which ABA content decreased by 64.78% and GA content increased by nearly 22 times. In terms of energy metabolism, FeSO4priming remarkably improved energy level, increased ATP content by 2.16 times and increased cytochrome C oxidase activity by 67.91%. Moreover, FeSO4priming acted as an initial stress-exposure, both enzyme-catabolized and non-enzyme-catabolized systems response to environmental stress were activated. This was specifically so for the activities of SOD, CAT, APX of enzyme-catabolized elements, which increased by 2.85 times, 1.79 times and 19.6%, respectively. The contents of non-enzyme-catabolized elements were increased by 74.08% for glutathione and 10.89% for ascorbic acid. In summary, our study indicated that regulation of FeSO4priming was a complex process that promoted stored material mobilization, ATP biosynthesis, key enzyme activation, phytohormone homeostasis between ABA and GA; and simultaneously regulated both enzymatic-catabolized and non-enzymatic-catabolized effecters in biotic and an-biotic stress. On the one hand, priming induced more advanced development in seeds towards complete germination than unprimed ones. On the other hand, priming was considered as a pre-germination stress-exposure that left seeds with “stress-memory” and improved anti-adversity ability. These changes were not eliminated even when seeds dried to original moisture content. This was the main reason why priming enhanced seed vigor and rapid, uniform seed germination performance.
Seed priming;Pall.; Ferrous sulfate priming; Hydro-priming; Germination; Physiological mechanism
, E-mail: xuehuidong@cau.edu.cn
Mar. 13, 2018;
Jun. 30, 2018
S330.2
A
1671-3990(2018)12-1828-08
10.13930/j.cnki.cjea.180257
* 国家“重大新药创制”科技重大专项(20122X09304006)资助
董学会, 主要研究方向为种子生理学。E-mail: xuehuidong@cau.edu.cn
牛晓雪, 主要从事种子生理研究。E-mail: apple.xiaoxue@163.com
2018-03-13
2018-06-30
* This study was supported by the National Science and Technology Project of “Major New Drug Creation” of China (20122X09304006).
牛晓雪, 牟萌, 李保华, 董学会. FeSO4引发提高秦艽种子萌发的生理机制[J]. 中国生态农业学报, 2018, 26(12): 1828-1835
NIU X X, MU M, LI B H, DONG X H. Physiological mechanism of FeSO4priming improvement of seed germination performances of[J]. Chinese Journal of Eco-Agriculture, 2018, 26(12): 1828-1835
