紫花苜蓿种带病毒的检测
2018-11-28文朝慧王玉青
文朝慧,余 玲,王玉青
(1.甘肃出入境检验检疫局,甘肃 兰州 730010; 2.兰州大学草地农业科技学院,甘肃 兰州 730020)
紫花苜蓿简称苜蓿(Medicagosativa),是世界上栽培最早、分布面积最大的多年生优质豆科牧草,素有“牧草之王”的美誉[1],在我国西北、东北、内蒙古和华北各地都有大面积栽培,在促进畜牧业和种草业持续发展中有着不可替代的作用[2],是我国干旱半干旱地区植被生态建设和退耕还草的重要草种。
病害是苜蓿生产的主要限制因素之一。据统计,美国苜蓿每年因病害干草减产25%,种子减产l0%,按1972年价格计算,为4亿美元[3]。目前全世界已发现的苜蓿病害达70余种,我国已报道的近50种[3-14],引起病害的病原生物包括真菌[4-6]、细菌[7-9]、病毒[10-14]和线虫等。根据国内外研究报道,至少有33种植物病毒可以侵染苜蓿[15]。苜蓿被植物病毒侵染后表现花叶、矮缩或畸形等症状[16],致使产量降低,难以越冬。在我国,苜蓿花叶病毒(alfalfa mosaic virus,AMV)[10]、菜豆黄花叶病毒(bean yellow mosaic virus,BYMV)[11]、豇豆花叶病毒(cowpea mosaic virus,CPMV)[12]、番茄花叶病毒(tomato mosaic virus,ToMV)[13]和白三叶草花叶病毒(white clover mosaic virus,WCMV)[14]均有分布。
随着我国草产业的发展,苜蓿种植面积不断扩大,生产上对苜蓿种子的需求量也不断提高[17-19],而种子是病原物远距离传播的主要载体,种子带病后遇适宜的环境条件可造成病害的传播流行。采用健康、无病的苜蓿种子是防治种传病害的重要手段,是提高苜蓿产量、实现农民增收的一个重要环节。为明确甘肃省紫花苜蓿种带病毒的主要种类,通过双抗体夹心酶联免疫吸附分析(double-antibody sandwich enzyme linked immunosorbent assay,DASELISA)的方法对紫花苜蓿种子进行检测,并在此基础上利用RT-PCR方法扩增主要毒原的外壳蛋白基因进行确证,旨在为有效地防范和控制苜蓿病毒病的发生提供依据。
1 材料与方法
1.1 材料
1.1.1种样 供试52份紫花苜蓿种样分别来自甘肃省国家退牧还草、草原生态补奖等工程项目用种及地方品种(表1)。
1.1.2主要试剂 样品抽提液成分为:聚乙烯吡咯烷酮(相对分子质量24 000~40 000)20.0 g,Na2SO31.3 g,NaN30.2 g,卵清蛋白2.0 g,Tween-20 20.0 g,PBST 1 000 mL,pH 7.4。
苜蓿花叶病毒(AMV)和西瓜花叶病毒(watermelon mosaic virus-2,WMV-2)的DAS-ELISA检测试剂盒及阳性对照样品购自美国Agdia公司,豌豆线条病毒(pea streak virus,PSV)、豌豆耳突花叶病毒(pea enation mosaic virus,PEMV)、菜豆卷叶病毒(bean leaf roll virus,BLRV)、菜豆黄花叶病毒(bean yellow mosaic virus-204,BYMV-204)、菜豆黄花叶病毒(bean yellow mosaic virus-B25,BYMV-B25)、烟草条纹病毒(tobacco streak virus,TSV)、黄瓜花叶病毒(cucumber mosaic virus,CMV)和烟草花叶病毒(tobacco mosaic virus,TMV)8种DAS-ELISA检测试剂盒及阳性对照样品购自美国ACD公司。测序由宝生物工程(大连)有限公司完成。测序结果通过BLAST与GenBank中已登录的序列进行一致性比较。
植物总RNA 提取试剂盒、One step RT-PCR试剂盒、Taq DNA聚合酶、dNTP、X-Gal、IPTG、琼脂糖凝胶回收试剂盒等均购自宝生物工程(大连)有限公司;其他化学试剂为国产分析纯级试剂。PCR引物由金唯智生物科技有限公司合成。
1.2 方法
1.2.1样品制备 分别称取待检种样2.5 g,加入5倍体积的样品抽提液研磨,2 000 r·min-1离心10 min,上清液即为制备好的检测样品,用于DAS-ELISA检测,阴性对照作相应的处理,阳性对照按照说明书进行处理。另取350 μL上清液按照RNA 提取试剂盒说明提取植物总RNA。
1.2.2血清学检测 血清学检测采用 DAS-ELISA方法,对种样分别进行苜蓿花叶病毒(AMV)、豌豆线条病毒(PSV)、豌豆耳突花叶病毒(PEMV)、菜豆卷叶病毒(BLRV)、菜豆黄花叶病毒(BYMV)、烟草条纹病毒(TSV)、黄瓜花叶病毒(CMV)、西瓜花叶病毒(WMV-2)和烟草花叶病毒(TMV)9种病毒的检测,每个样品设计2孔重复,并设计阴性和阳性对照,每孔加入100 μL待测样品,检测步骤按照公司产品说明书进行。阴性对照为健康紫花苜蓿种子,空白对照为缓冲液。用MD VersaMax酶标仪在405 nm处检测各反应孔的吸光值(OD)。被测样品OD值/阴性对照OD值≥2.0时判定为阳性反应。
1.2.3RT-PCR检测 根据已报道的特异性引物对AMV-F/AMV-R[20]和BYMV-F/BYMV-R[21](表2)分别检测AMV和BYMV部分DAS-ELISA阳性样品,进行进一步的分子鉴定。
One Step RT-PCR反应总体积25.0 μL,其中:2×1 Step Buffer 12.5 μL,Enzyme Mix 1.0 μL,10.0 μmol·L-1上、下游引物各1.0 μL,RNase Free H2O 4.5 μL,RNA模板5.0 μL。扩增条件为:50 ℃反转录30 min;94 ℃预变性3 min;94 ℃变性30 s、54 ℃(AMV)、50 ℃(BYMV)退火30 s、72 ℃延伸1 min,35个循环;72 ℃延伸7 min。取8 μL PCR产物进行1%琼脂糖凝胶电泳,电泳结束后凝胶成像仪记录结果。
采用柱式通用DNA纯化试剂盒切胶回收目的DNA,将回收的目的DNA连接于载体pMD18-T,将连接产物转化至DH5α感受态细胞中,以Amp/IPTG/X-Gal LB琼脂平板进行蓝/白斑筛选,挑取白色菌落,PCR鉴定重组质粒,阳性克隆的质粒委托宝生物工程(大连)有限公司测序。测序结果通过BLAST与GenBank中已登录的序列进行一致性比较。

表1 紫花苜蓿种样及其来源Table 1 Alfalfa seed samples
续表1
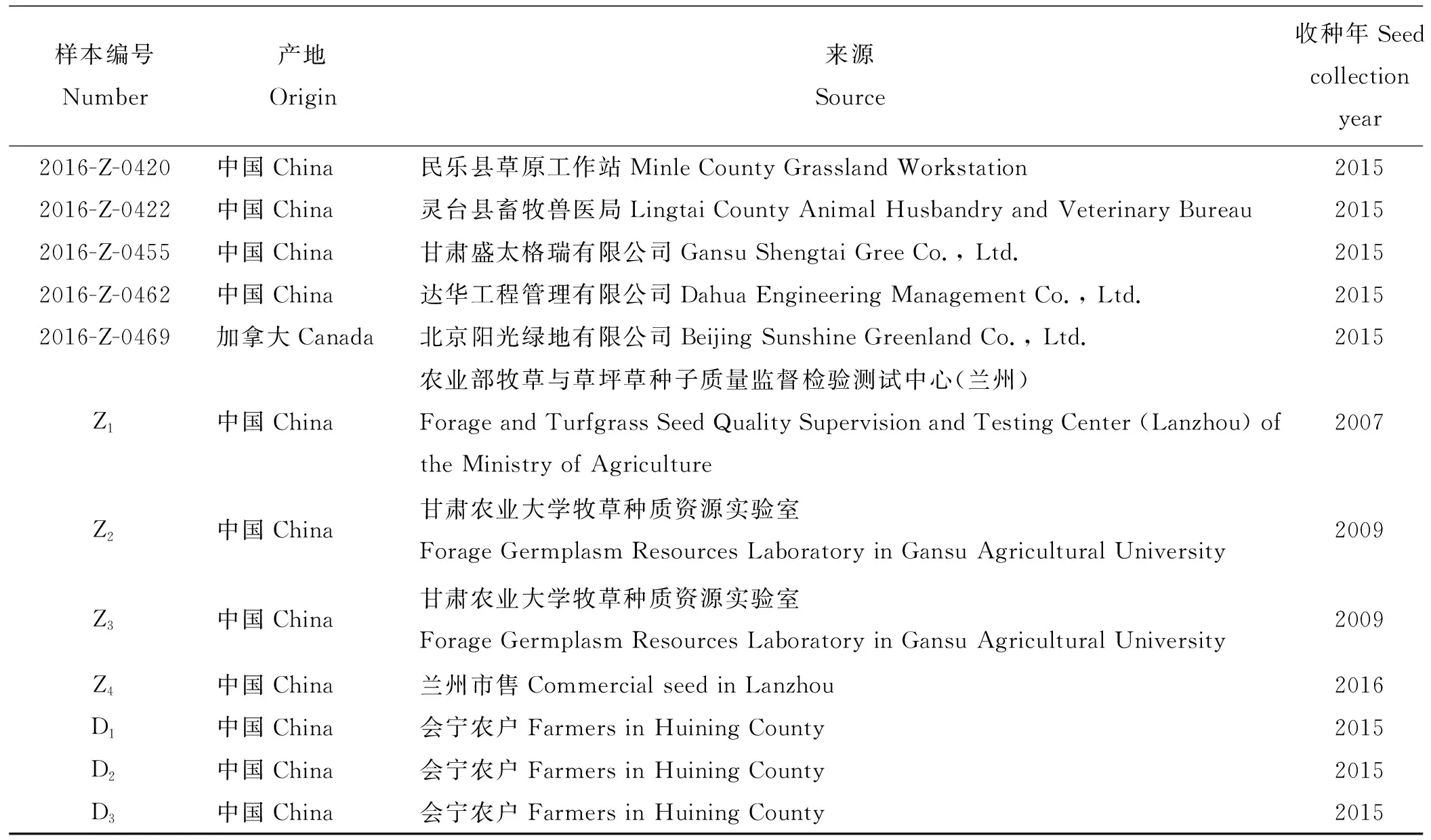
样本编号Number产地Origin来源Source收种年Seed collection year2016-Z-0420中国China民乐县草原工作站Minle County Grassland Workstation20152016-Z-0422中国China灵台县畜牧兽医局Lingtai County Animal Husbandry and Veterinary Bureau20152016-Z-0455中国China甘肃盛太格瑞有限公司Gansu Shengtai Gree Co., Ltd.20152016-Z-0462中国China达华工程管理有限公司Dahua Engineering Management Co., Ltd.20152016-Z-0469加拿大Canada北京阳光绿地有限公司Beijing Sunshine Greenland Co., Ltd.2015Z1中国China农业部牧草与草坪草种子质量监督检验测试中心(兰州)Forage and Turfgrass Seed Quality Supervision and Testing Center (Lanzhou) of the Ministry of Agriculture2007Z2中国China甘肃农业大学牧草种质资源实验室Forage Germplasm Resources Laboratory in Gansu Agricultural University2009Z3中国China甘肃农业大学牧草种质资源实验室Forage Germplasm Resources Laboratory in Gansu Agricultural University2009Z4中国China兰州市售Commercial seed in Lanzhou2016D1中国China会宁农户Farmers in Huining County2015D2中国China会宁农户Farmers in Huining County2015D3中国China会宁农户Farmers in Huining County2015
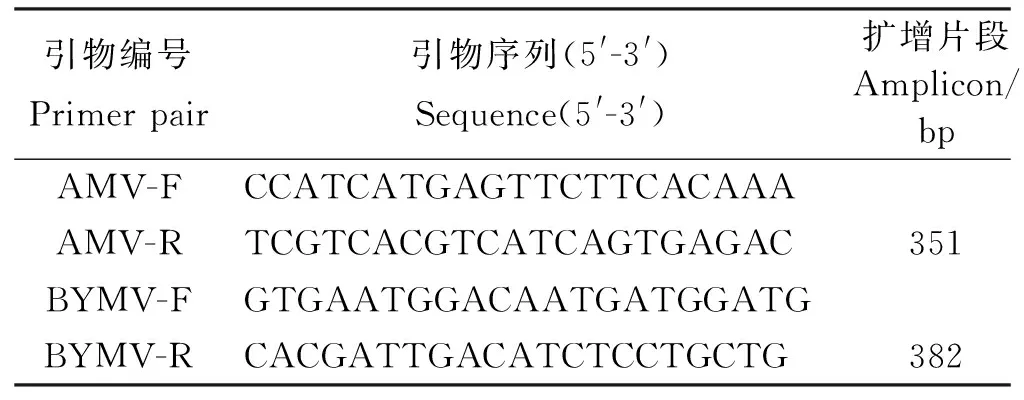
表2 试验所用的引物Table 2 The primers used in this study
2 结果与分析
2.1 血清学检测
52份紫花苜蓿种子分别与苜蓿花叶病毒(AMV)、豌豆线条病毒(PSV)、豌豆耳突花叶病毒(PEMV)、菜豆卷叶病毒(BLRV)、菜豆黄花叶病毒(BYMV-204、BYMV-B25)、烟草条纹病毒(TSV)、黄瓜花叶病毒(CMV)、西瓜花叶病毒(WMV-2)和烟草花叶病毒(TMV)的抗体进行ELISA反应,结果有45份样品为AMV阳性,7份样品(2016-Z-0200、2016-Z-0233、2016-Z-0253、2016-Z-0292、Z1、Z2、Z3)为AMV阴性;4份样品(2016-Z-0201、D1、D2、D3)为BYMV阳性,样品中未检出PSV、PEMV、BLRV、TSV、CMV、WMV-2和TMV。3份样品(D1、D2、D3)检测到AMV和BYMV 2种病毒复合侵染。
2.2 RT-PCR检测
为确证血清学检测结果,随机挑选部分DAS-ELISA反应为AMV阳性的苜蓿种样,进行AMV的RT-PCR扩增,检测结果表明,从编号2016-Z-0009、2016-Z-0142、2016-Z-0212、2016-Z-0237和2016-Z-0282的样本中扩增出约350 bp的特异条带(图1A),与预期AMV的目的片段长度一致,健康样品对照无扩增条带;对DAS-ELISA反应为BYMV阳性的4个苜蓿种样,全部进行BYMV的RT-PCR扩增,检测结果表明,从编号D1、D2、D3的样本中扩增出约380 bp的特异条带(图1B),与预期BYMV的目的片段长度一致,但编号2016-Z-0201的样本中未扩增出目标条带(结果未显示),健康样品对照无扩增条带;说明扩增片段是从AMV、BYMV病毒基因组特异扩增得到的。
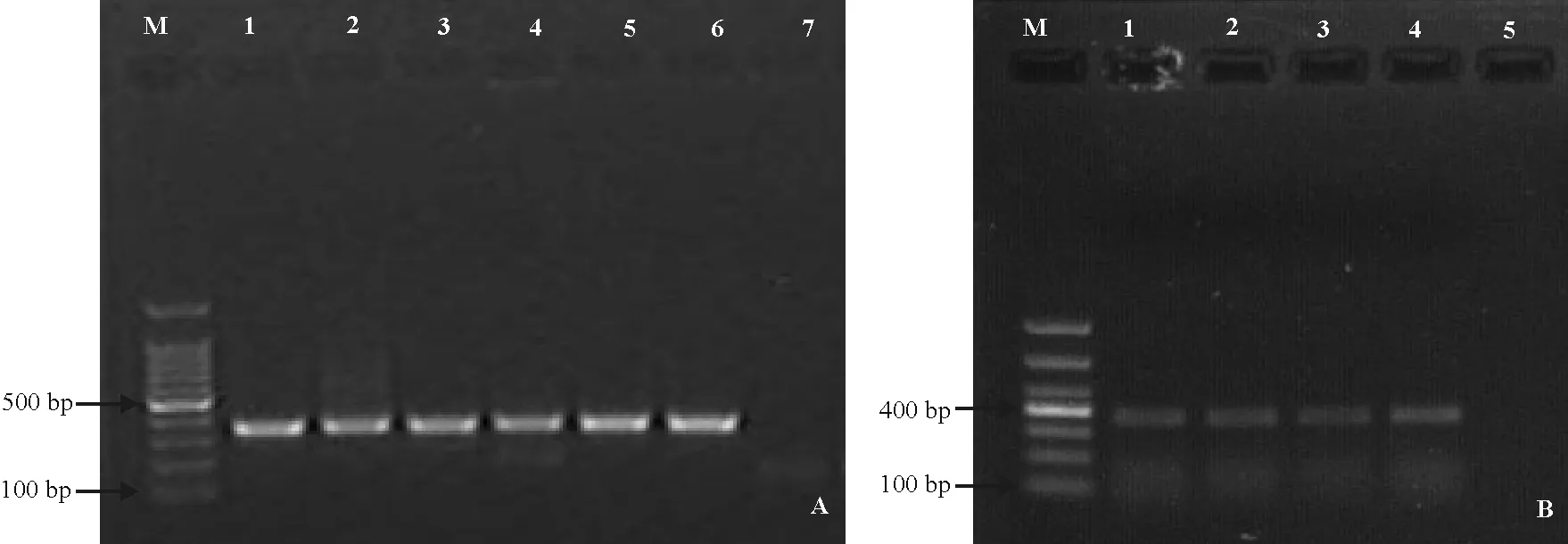
图1 紫花苜蓿种样的RT-PCR检测结果Fig. 1 The results of RT-PCR of alfalfa seed samples
M,1 000 bp DNA分子量标准;(A)1,2016-Z-0009; 2, 2016-Z-0142; 3, 2016-Z-0212; 4,2016-Z-0237; 5,2016-Z-0282; 6,阳性对照; 7,健康对照.(B) 1, D1; 2, D2; 3, D3; 4,阳性对照; 5,健康对照l.
M, 1 000 bp DNA marker;(A)1, 2016-Z-0009; 2, 2016-Z-0142; 3, 2016-Z-0212; 4, 2016-Z-0237; 5, 2016-Z-0282; 6, positive control; 7, health control.(B) 1, D1; 2, D2; 3, D3; 4, positive control; 5, health control.
取样品D1的PCR产物进行测序,BYMV特异性引物的扩增产物(GenBank 序列号MH210645)与已报道的BYMV分离物CP基因核苷酸序列的同源性为89%~92%,氨基酸序列的同源性为94%~100%,说明所测定的序列为BYMV的CP基因部分序列[22]。
3 讨论
采用酶联免疫试剂盒进行血清学检测具有操作简单、可大批量检测等特点,ELISA具有灵敏度高、快速、专化性强、重复性好、检测对象广,可用于粗汁液或提纯样品。本研究利用DAS-ELISA和RT-PCR方法检测了甘肃省紫花苜蓿种子携带病毒的种类,结果表明,在45份样品中检测到AMV,占样品总数的86.5%;3份样品检测到BYMV,占样品总数的5.8%。因此,供试苜蓿种子携带的病毒有AMV和BYMV。AMV是危害苜蓿的重要病毒,可造成苜蓿湿重减少14.8%~22.8%,干重减少15.0%~18.1%,且对第一茬影响最大[23]。AMV在苜蓿上的种传率为10%[24],受侵染的种子是AMV病毒病流行的主要因素[25]。苜蓿花叶病在我国西北地区发生较为普遍,据报道,宁夏苜蓿花叶病发病率达50%以上[26],兰州市安宁区、皋兰县和白银市景泰县苜蓿花叶病样中AMV的检出率为100.0%[14],笔者在甘肃张掖[13]、永昌(数据未发表)等苜蓿田花叶病病株中均检出AMV,苜蓿花叶病普遍发生,与种子带毒传毒有一定的关系。
本研究在3个会宁农家紫花苜蓿种子样品中检测出BYMV,BYMV也是侵染苜蓿的常见病毒,为马铃薯Y病毒属(Potyvirus)病毒,可经种子传播,兰州市安宁区、皋兰县和白银市景泰县的紫花苜蓿花叶病样中BYMV的检出率为75.0%[14]。样品2016-Z-201经 DAS-ELISA检测显示BYMV阳性,但RT-PCR扩增未获得BYMV的CP基因片段,ELISA的阳性结果可能与检测抗血清的非特异性反应有关。
苜蓿是我国种植面积最大的栽培牧草,在生产过程中病毒病是影响苜蓿产量和质量的重要因素,苜蓿病毒病的发生还可增加其他病害的发生率,影响苜蓿的产量和饲用价值[27]。对于病毒病的防治,目前尚无有效的化学药剂,其控制主要采用降低侵染源、限制传毒介体的扩散等手段。防治种传病毒病包括去除病种、种子消毒、种子健康检测和检疫,但由于大多数病种子没有形态和物理性的异常,人工不能除尽病种;种子表面消毒只对少数种子表皮污染的病毒有明显脱毒效果,对大多数胚传病毒低效或无效。因此,防止种植来自疫区和缺乏质量保障的种子是防控病毒病的前提,进行种子健康检验,是防止病毒病从种子源头扩散流行及获得无毒种子的关键。随着苜蓿用种的增加,提高种子繁育田的管理水平,确保种子质量,并加强种子健康检测,是提高种子产量和品质的保障。
