人源CerS2重组腺病毒构建及其对肝癌细胞HepG2细胞周期的作用
2018-11-28杨小理欧阳旭红向加林王凤学
杨小理,钱 玥,欧阳旭红,向加林,杨 艳,王凤学
(1.遵义医学院附属医院医学检验科,贵州遵义 563003;2.遵义医学院检验医学院2015级,贵州遵义 563003; 3.贵州省遵义市第一人民医院检验科 563003)
神经酰胺合酶(ceramide synthase,CerS)基因家族成员主要包括CerS1、CerS2、CerS4、CerS5、CerS6[1-3],各成员在真核生物中呈现出严格的保守性[4]。CerS2参与神经酰胺的合成[5],神经酰胺作为鞘磷脂信号途径中重要的第二信使效应分子,参与激活多种蛋白激酶和蛋白磷酸酶调节凋亡、增殖、分化和生长停滞等信号过程[6]。研究表明,CerS2在肝癌、乳腺癌、前列腺癌、膀胱癌细胞株中具有抑制肿瘤细胞增殖、侵袭的活性[7-10],且较多研究关注CerS2在肿瘤微环境的作用及机制探讨。而CerS对动物来说是很重要的相关基因,其变异将导致严重的代谢紊乱,但CerS2在肿瘤与代谢中的作用却鲜有报道。本研究通过构建人源CerS2重组腺病毒,观察其对肝癌细胞HepG2的转染、介导CerS2基因的表达能力及对细胞周期的影响,为进一步研究CerS2基因对HepG2细胞生长及肝糖、脂质代谢可能的影响奠定基础。
1 材料与方法
1.1材料与试剂 限制性内切酶、感受态大肠埃希菌DH5α、引物合成、RT-PCR、QPCR试剂盒均购自大连宝生物Takara公司;HEK293购自上海中科院细胞库,AdMax重组腺病毒表达载体购自加拿大Microbix公司;DMEM、胎牛血清、胰酶均购自Gibico公司;脂质体2000购自Invitrogen公司;质粒提取试剂盒、胶回收试剂盒、DNA纯化试剂盒均购自Omega公司;全蛋白提取试剂盒购自凯基生物技术有限公司;蛋白Marker为Fermentas产品,内参抗体为Anti-β-actin-HRP-conjugated,购自康成;Anti-Ceramide synthase 2抗体、Anti-p27 kip 1抗体购自Abcam公司。
1.2方法
1.2.1人源CerS2基因的扩增 从Genebank检索人源基因序列即NM_181746,送公司化学合成CDS区全长片段。取1 μL作为模板,用PrimerSTAR进行目的片段PCR扩增,上游引物:5′-CGT AGA ACG CAG ATC GAA TTC GCC ACC ATG CTC CAG ACC TTG TAT GA-3′;下游引物:5′-CCA TGG TGG CAA GCT TGT CAT TCT TAC GAT GGT TGT TAT T-3′。
1.2.2穿梭质粒pDC315-CerS2-GFP的构建及重组质粒的筛选与鉴定 采用1.0%的琼脂糖电泳PCR产物,对PCR产物进行回收、纯化,同时将pDC315-绿色荧光蛋白(GFP)、PCR产物线性化,并经In-Fusion交换酶连接、转化、选取阳性克隆经PCR鉴定且送大连宝生物测序。
1.2.3重组腺病毒pDC315-CerS2的包装 将穿梭质粒pDC315-CerS2与Admax系统中pBHGloxpΔE1,3cre载体共转染293细胞,观察细胞状态,第14天左右出现细胞病变(cytopathic effect,CPE),待所有细胞都变圆并大部分开始脱落时,收集上清液和细胞,离心后保留细胞和2 mL上清液,用液氮和37 ℃水浴锅反复冻融样品3次,离心去沉淀。加入10% 无菌甘油,过滤后得到病毒毒种,保存在-80 ℃。
1.2.4Adv-CerS2-GFP的扩增、纯化与滴度鉴定 待293细胞接近长满时,加入毒种1 mL,当大部分细胞出现CPE且脱落时,收集病毒上清液,再次扩增,重组腺病毒经Adeno-X Virus Purification Kit纯化试剂盒纯化,保存在-80 ℃。采用终点稀释法,计算病毒滴度。
1.2.5Adv-CerS2-GFP在肝癌细胞HepG2中的表达及亚细胞定位 在6孔板中细胞爬片,将Adv-GFP(空载组)、Adv-CerS2-GFP(实验组)分别感染HepG2细胞,并设HepG2空白对照组,感染48 h后,PBS洗涤3次,4%多聚甲醛固定30 min,并采用DAPI染核,激光扫描共聚焦显微镜观察与拍照,蓝光激发和发射波长分别为340 nm/488 nm,GFP激发和发射波长为488 nm/525 nm。
1.2.6RT-qPCR和Western blot法检测各组细胞CerS2、p27的表达 感染48 h后采用Trizol分别提取各组细胞的总RNA,逆转录合成cDNA,采用SYBR GreenⅠ荧光染料RT-qPCR二步法检测CerS2 mRNA表达水平,以β-actin基因作为内参,用2-△△CT值表示基因相对表达量。所用引物β-actin上游:5′ -TTG CGT TAC ACC CTT TCT T-3′,下游:5′ -GTC ACC TTC ACC GTT CCA-3′;CerS2上游:5′-ATC GTC TTC GCC ATT GTT-3′,下游:5′-CGG TCA CTG CGT TCA TCT-3′;p27 kip1上游:5′-GGC TAA CTC TGA GGA CAC-3′,下游:5′-TTC TTC TGT TCT GTT GGC-3′。采用全蛋白提取试剂盒提取各组细胞总蛋白,BCA法蛋白定量,取蛋白30~50 μg行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)转移至PVDF膜、封闭、一抗(分别为anti-CerS2 antibody、anti-p27 kip1 antibody)4 ℃孵育过夜、洗膜,二抗室温孵育1~2 h,洗膜并显色成像,比较条带灰度值与灰度比。
1.2.7流式细胞术PI法检测各组细胞周期的改变 腺病毒转染48 h后,收集、调整细胞浓度约1×106个/mL,70%冷乙醇500 μL、4 ℃下固定2 h,100 μL RNase A 37 ℃水浴30 min,再加入400 μL PI染色混匀,4 ℃避光30 min;上机检测,记录激发波长488 nm处红色荧光。

2 结 果
2.1CerS2目的基因扩增的PCR产物及重组穿梭质粒pDC315-CerS2-GFP的鉴定 将PCR扩增得到的产物回收、经EcoRⅠ与KpnⅠ双酶切后取2 μL电泳鉴定,所得到的片段大小约为1 142 bp左右,与目的片段cDNA大小一致。重组穿梭质粒pDC315-CerS2-GFP测序结果显示,所克隆片段与NM_18746序列CDS区完全一致(图1)。病毒滴度为1.0×109PFU/mL。
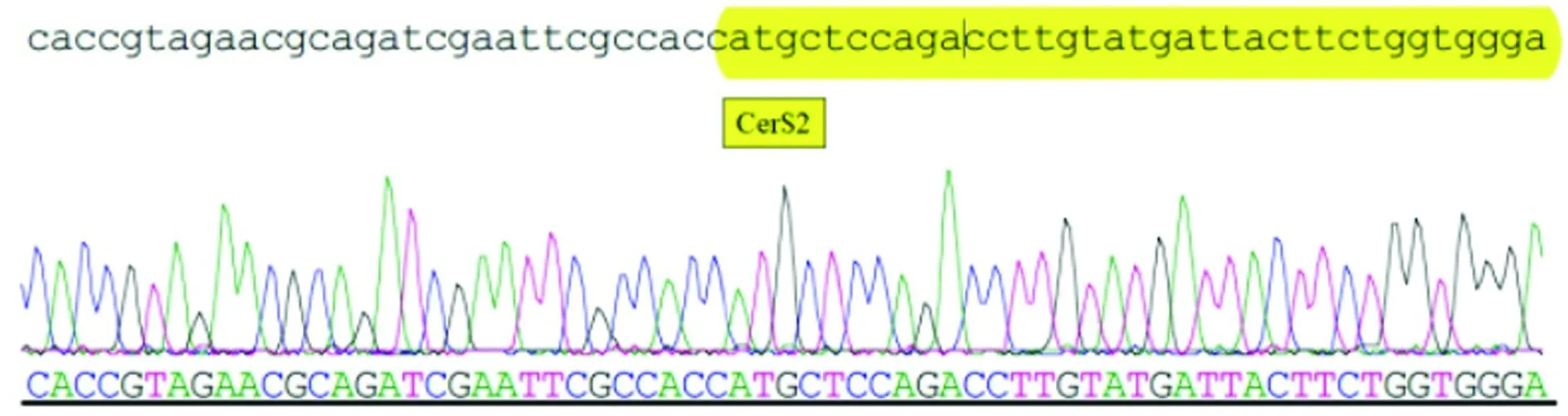
图1 Lass2重组腺病毒测序结果(仅展示部分)
2.2Cers2亚细胞定位 激光扫描共聚焦结果显示,在细胞核周围呈现蓝、绿色重叠,少量分布在细胞质内,见图2。
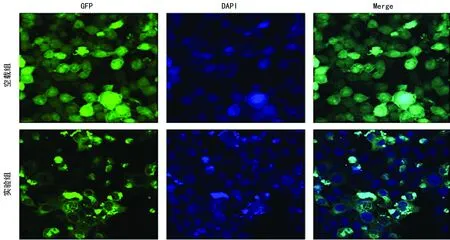
图2 CerS2在HepG2肝癌细胞中的表达(亚细胞定位)
2.3各组HepG2肝癌细胞GerS2表达水平比较 对照组、空载组CerS2表达比较,差异无统计学意义(P>0.05);感染48 h的实验组比对照组CerS2 mRNA相对表达量增加了129.79倍(P<0.01),蛋白表达水平也明显增加(P<0.01),见图3。
2.4各组细胞周期的变化 流式细胞仪PI法结果显示,与对照组、空载组比较,实验组细胞G0/G1期百分比明显增加,G2/M、S期百分比均明显减少(P<0.01),见表1、图4。
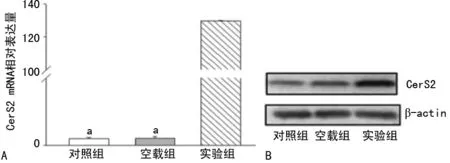
a:P<0.05,与实验组比较
图3各组HepG2肝癌细胞CerS2表达水平比较
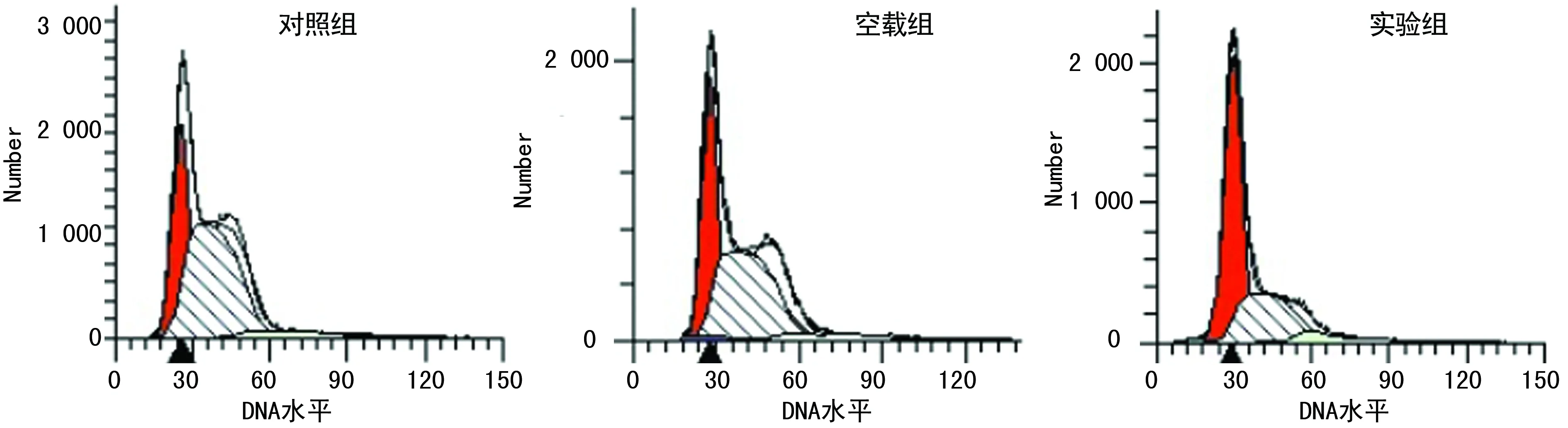
图4 各组细胞周期分析结果
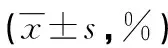
表1 各组细胞周期百分比比较
a:P<0.01,与实验组比较
2.5各组HepG2细胞p27 kip1表达水平比较 实验组p27 kip1 mRNA表达水平较对照组、空载组明显上调(P=0.026、0.019),且p27 kip1蛋白表达水平也明显高于对照组及空载组(P<0.01),见图5。
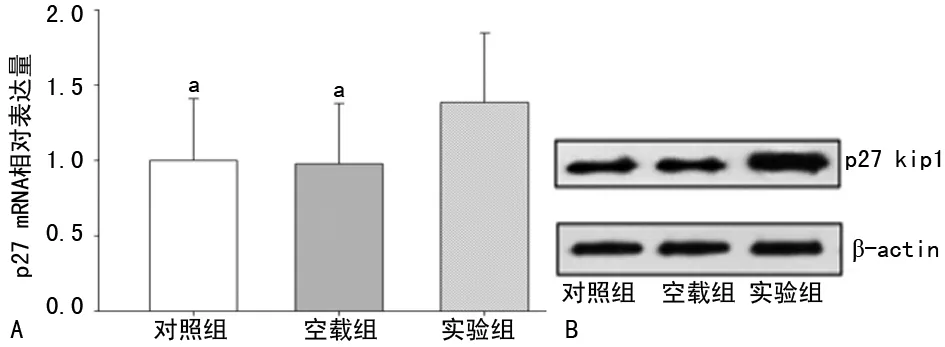
a:P<0.05,与实验组比较
3 讨 论
CerS2基因是在肝癌相关基因大规模功能筛选时发现的与肿瘤转移相关的新基因,研究表明其含保守的TLC功能域和特定的HOX功能域,HOX作为序列特异性DNA结合转录调节因子,在调控基因转录方面有着非常重要的作用,其对神经酰胺的合成是必需的,早期研究发现HOX域与细胞周期调控密切关联,通过细胞周期影响细胞生长[6]。此外,CerS2在结构上包含了一个看家基因的典型特征,这是该家族其它成员所没有的,其在各类肿瘤中抗肿瘤的具体机制仍不清楚。
本研究应用Admax系统构建重组腺病毒表达载体,该包装系统利用了重组酶系统(Cre-loxP和FLP-frt),操作简单且重组效率高、获得的病毒产率高、目的基因的表达水平高,采用的增强型绿色荧光强度较普通荧光强度提升且保留了荧光蛋白功能的同时能快速有效的对融合的目的基因进行报告。经酶切、测序鉴定,CerS2重组腺病毒构建成功,并在HepG2肝癌细胞中形成高效过表达,亚细胞定位结果提示CerS2融合蛋白在细胞核周围表达,少量在细胞质。该重组腺病毒的构建为本课题进一步研究CerS2在肿瘤代谢中的作用及机制奠定了基础。
几乎所有肿瘤细胞的生物学特性都是由于细胞周期紊乱所导致的失控性生长,即肿瘤细胞的生长依赖于细胞周期的正常更替[11]。G1/S期是细胞周期的主要限制点,其中细胞在G1期完成必要的生长和物质准备,在S期完成其遗传物质--染色体DNA的复制, G2期进行必要的检查及修复,以确保DNA复制的准确性,然后在M期完成遗传物质到子细胞中的均等分配,并使细胞一分为二,而G0期是指细胞处于阻滞的状态,是脱离细胞周期、暂时停止分裂的一个阶段。本研究中流式细胞仪分析细胞周期各时相的百分比结果显示CerS2基因抑制了肝癌细胞的生长,使细胞大量处于G0/G1期,阻滞肝癌细胞HepG2进入下一阶段的增殖及分裂。
为进一步探讨其可能的作用机制,本实验观察了上调的CerS2对细胞周期调节蛋白p27表达的影响。p27蛋白是CIP/KIP家族成员之一,是细胞增殖一个主要的负调控因子,通过结合及调控各种细胞周期素(Cyclin)-细胞周期素依赖性激酶(CDK)包括Cyclin D(D1,D2,D3)-CDK4/CDK6、Cyclin E-CDK2复合物[11-12],从而调控细胞进入G1期和S期[13],其调控肿瘤细胞周期的同时能抑制肿瘤细胞的分裂,是负性调控细胞周期的蛋白[14]。p27被认为是人类多种肿瘤独立的预后因子和未来可能的肿瘤治疗靶点。有研究报道,CDK抑制结构域位于p27蛋白的N-末端部分,该结构域使细胞足以停滞于G0/G1期,但p27可能在不同的细胞与不同分子相互作用,在适当的时间到达适当的细胞内位置发挥其生物学活性,呈现出对细胞周期不同的调控[15]。本研究结果提示上调的CerS2基因促进p27蛋白表达增强,这可能是肝癌细胞HepG2细胞周期G0/G1期阻滞的可能机制之一,但其具体的分子生物学机制如过表达的CerS2是通过何细胞调控因子或信号调控网络导致p27上调及p27通过抑制何种Cyclin-CDK复合物导致细胞周期的改变等等尚待后续深入研究。
