某地区7 500例农村女性HPV亚型感染情况分析
2018-11-28苏星予邓启明肖成琴
苏星予,廖 昂,邓启明,肖成琴,刘 芹
(重庆市永川区妇幼保健院检验科 402160)
宫颈癌是一种妇科恶性肿瘤,其发病率仅次于乳腺癌,位居全球第2位[1-2]。2012年全球约52.8万例宫颈癌患者,约26.6万例患者因宫颈癌而死亡[3-4]。同年,国内有61 691例新发宫颈癌病例,是全球范围的12%,有29 526例宫颈癌死亡病例,是全球范围的11%[5]。2015年中国癌症统计数据显示,我国宫颈癌的发病率在全球宫颈癌发病率中高居第2位[6]。目前,国人对人乳头瘤病毒(HPV)感染及其相关疾病与疫苗的认知情况因性别、民族和受教育程度等因素影响存在较大差异,大众普遍认知较低[3]。
近年的研究发现,HPV感染是宫颈癌发生、发展的必要非充分的因素,其感染通常表现为瞬时感染,且具有年龄差异[7-11]。目前,高危型HPV在宫颈癌病因学中的作用已得到广泛的研究[12-14]。研究发现,持续性感染高危型HPV是影响宫颈癌前病变及浸润性宫颈癌发生、发展的一个重要危险因素[8]。现已公认至少有12种高危型HPV,分别为HPV16、HPV18、HPV31、HPV33、HPV35、HPV39、HPV45、HPV51、HPV52、HPV56、HPV58和HPV59型[3]。其中,HPV16、HPV18型与宫颈癌关系最为密切,是全球最主要的致癌性基因型[8,15],但不同地区的主要致癌性HPV基因型存在地域差异,在中国、韩国和日本这些东亚国家,HPV58型在浸润性宫颈癌中更为常见[16]。
由于有效的大规模宫颈癌筛查,宫颈癌的发病率近年来明显降低[1,17]。HPV检测正在成为宫颈癌筛查的一个重要组成部分[12]。因此,检测并了解中国女性HPV的感染分布情况,将有助于我国宫颈癌防治工作的开展。本文通过对重庆市永川区7 500例农村女性HPV感染情况进行分析,为本区HPV感染的流行病学研究及疫苗研制奠定基础。
1 资料与方法
1.1一般资料 选取重庆市永川区农村户口7 500例女性为研究对象,年龄35~65岁。其中,35~45岁2 605例,46~55岁3 299例,56~65岁1 596例。由本区妇幼保健院、金龙卫生院、朱沱卫生院、临江卫生院、陈食卫生院、板桥卫生院、仙龙卫生院、双石卫生院协助收集标本。每位受试者均了解本研究内容,经受试者同意后,由医师采集标本送检。
1.2仪器与试剂 HEMA 9600 PCR扩增仪购于珠海黑马仪器有限公司,YN-H18全自动核酸分子杂交仪购于深圳亚能生物技术有限公司,宫颈脱落细胞采集器购于深圳亚能生物技术有限公司,HPV基因分型检测试剂盒(15型)购于深圳亚能生物技术有限公司。
1.3方法
1.3.1标本采集方法 以窥阴器暴露宫颈,用棉拭子擦去宫颈口过多的分泌物,按宫颈脱落细胞采集器说明书,使用宫颈刷于宫颈口单方向旋转4~5周以获取足量的宫颈脱落细胞,并立即置于洗脱管中保存,做好标识后送检。
1.3.2DNA提取 充分洗脱宫颈刷,转移0.5 mL洗脱液于1.5 mL离心管中,13 000 r/min离心10 min,弃上清液,加入100 μL裂解液悬浮沉淀,金属浴加热10 min后13 000 r/min离心10 min,保留上清液备用。
1.3.3PCR扩增 取出PCR反应液,低速离心数秒,加入5 μL已提取的待测标本DNA,使总反应体系为25 μL,再次低速离心数秒后,按以下条件扩增:50 ℃ 15 min;95 ℃ 10 min;94 ℃ 30 s,42 ℃ 90 s,72 ℃ 30 s,循环40次;72 ℃ 5 min。
1.3.4杂交 参照标本数量,在全自动核酸分子杂交仪中放入相应数量的塑料三联杂交盒,并加入足量的纯水、A液、B液和C液。用干净手套取出膜条,按顺序编号后放入杂交盒中,由仪器自动加入A液,待仪器工作温度达到杂交温度后,加入已变性PCR产物标本杂交30 min。
1.3.5洗膜与显色 B液洗膜时,按孵育液配制表,在孵育盒中加入定量POD液体,仪器自动导入相应量A液。待B液洗膜10 min后,仪器自动加入POD孵育液孵育15 min。A液洗膜5 min,C液洗膜2 min后,按显色液配制表,于显色盒中配制足量的显色液,由仪器自动加入显色液。显色15 min,纯水清洗3 min后,即可进行结果判读。
1.3.6结果判读 根据膜条上蓝色斑点显现的位置,读取相应位置上标注的基因型信息,若仅一个基因型位点出现蓝色斑点,即为相应基因型的单一感染,若多个基因型位点出现蓝色斑点,即为相应基因型的混合感染。
1.4统计学处理 采用SPSS18.0进行统计分析,计数资料以n或百分率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1各年龄段HPV感染率分析 在7 500例受检标本中,检出973例阳性标本,总感染率为12.97%。其中,35~45岁年龄组,2 605例受检,294例阳性,感染率为11.29%;46~55岁年龄组,3 299例受检,409例阳性,感染率为12.40%;56~65岁年龄组,1 596例受检,270例阳性,感染率为16.92%。3组中,56~65岁年龄组感染率最高,与35~45年龄组、46~55年龄组比较,差异有统计学意义(P<0.05)。见表1。

表1 各年龄段HPV感染率分析
2.2HPV感染亚型分布情况 35~45岁年龄组,主要感染的型别以52型为主,其次为58型和16型,45型感染者最少;46~55岁年龄组,主要感染的型别以52型为主,其次为58型,11型感染者最少;56~65岁年龄组情况与46~55岁年龄组相似,主要感染的型别以52型为主,其次为58型,11型感染者最少。在所检的7 500例标本中,低危型感染以6型为主,其感染率约为0.44%(33/7 500);高危型感染以52型感染为主,其感染率约为4.16%(312/7 500),其次为58型,其感染率约为2.05%(154/7 500),第3位为16型,其感染率约为1.52%(114/7 500),第4位为51型,其感染率约为1.33%(100/7 500),第5位为68型,其感染率约为1.28%(96/7 500)。多重感染型无重复计算。见表2。
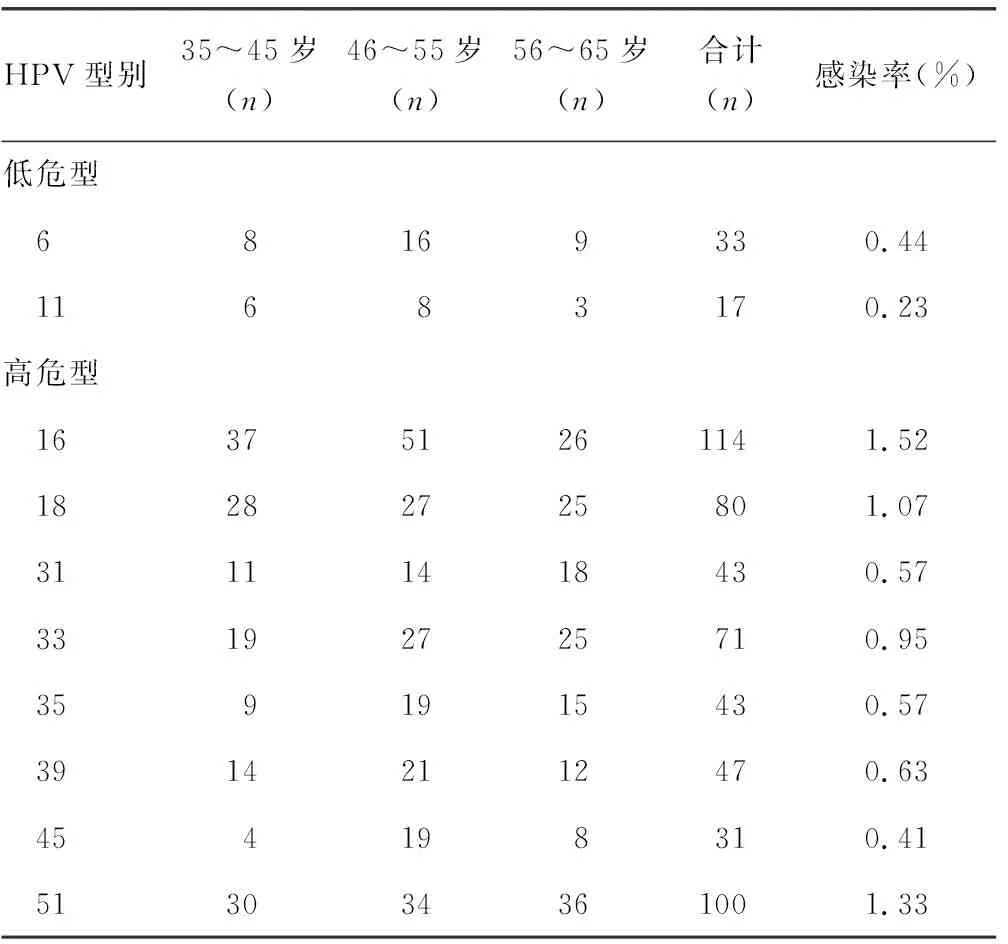
表2 HPV感染亚型分布情况
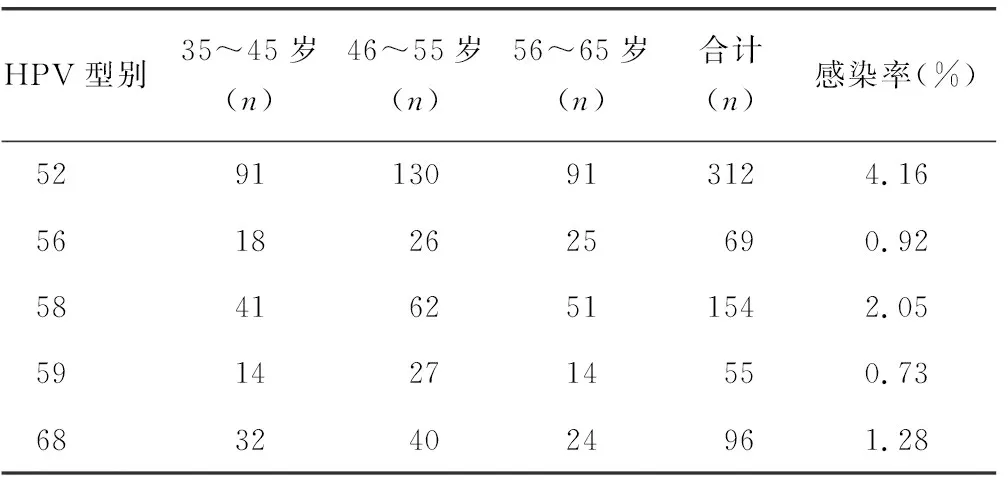
续表2 HPV感染亚型分布情况
2.3HPV多重感染情况 在7 500例受检者中,HPV感染存在单一感染、二重感染、三重感染、四重感染、五重感染和七重感染6种情况,未发现六重感染情况。以单一感染为主,其感染率约为10.11%(758/7 500);其次为二重感染,其感染率约为2.09%(157/7 500)。见表3。

表3 HPV多重感染情况
2.4HPV二重感染分布情况 在157个HPV二重感染者中,二重感染型别共有60种,以52型复合58型感染为主,感染率为0.13%(10/7 500),其次为51型复合52型感染与52型复合68型感染,感染率为0.12%(9/7 500),再次为16型复合52型感染、18型复合52型感染,以及18型复合58型感染,感染率为0.09%(7/7 500)。见表4。
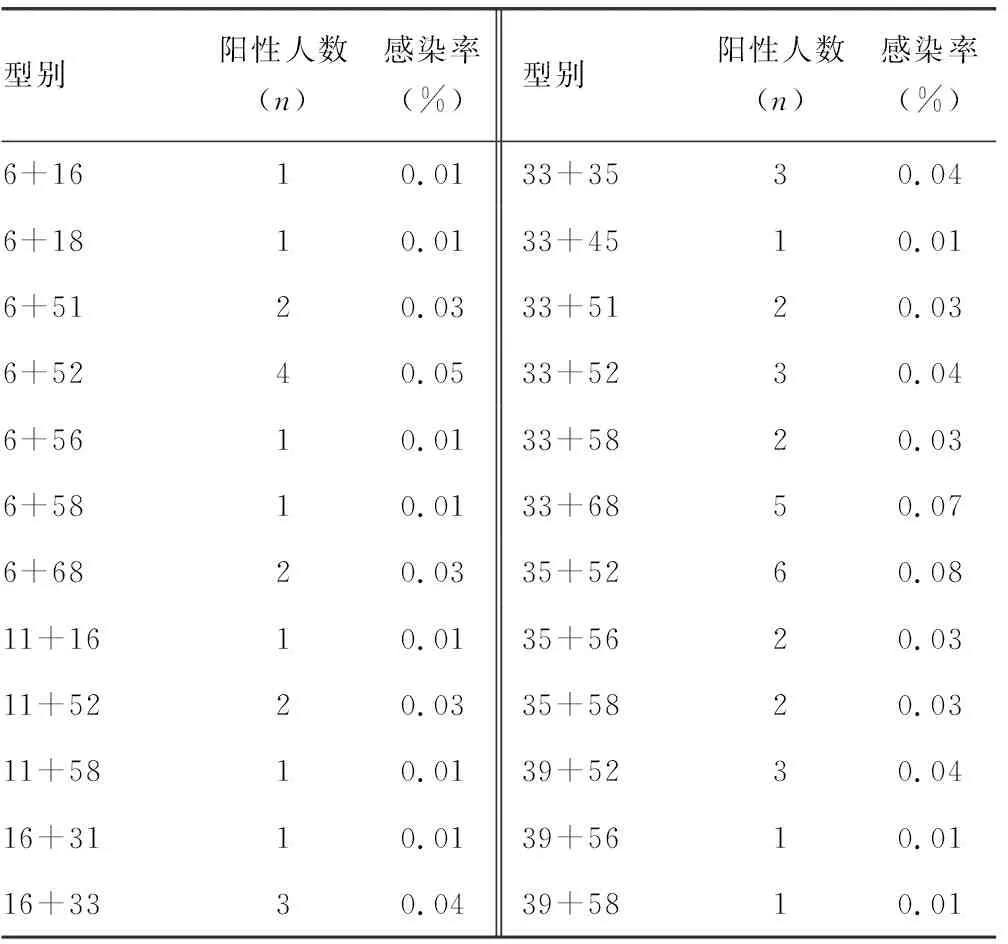
表4 HPV二重感染分布特征
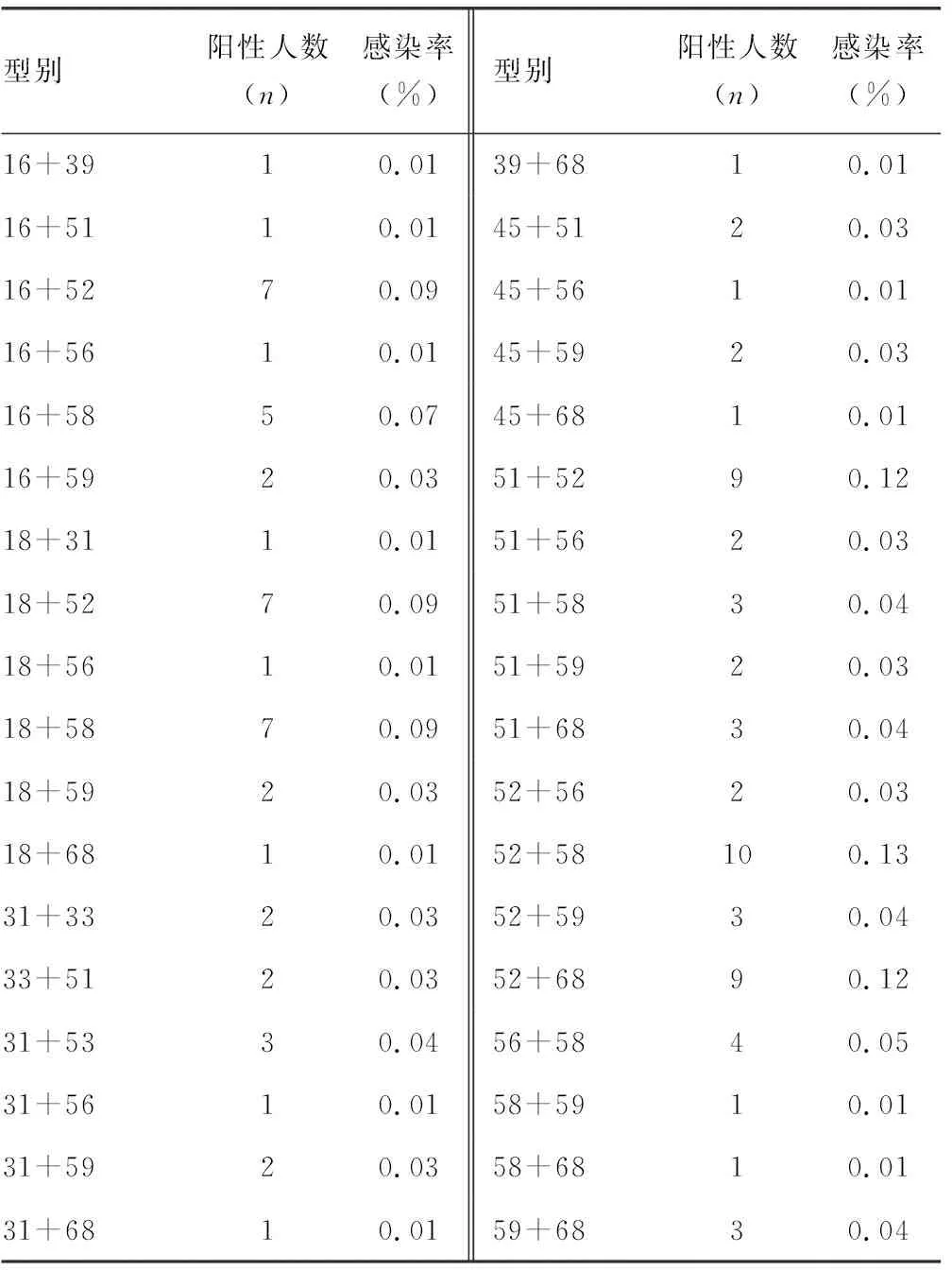
续表4 HPV二重感染分布特征
3 讨 论
宫颈癌是一种常见的女性恶性肿瘤,严重威胁着全球女性的健康[9]。相关资料显示,在宫颈癌标本中,几乎均能检测到HPV的存在,而持续性高危HPV感染已被认为是引发宫颈癌的主要致病因素[1,9,18]。通常,从HPV感染、宫颈上皮内瘤样变(CIN)、原位癌、早期浸润癌直至浸润癌,期间需要经历10年左右的时间[19]。因此,早期进行宫颈HPV筛查,可有效降低宫颈癌的发病风险,对防治宫颈癌具有重要意义[2,9,20-21]。
国内相关报道显示,我国HPV总体感染率约为25.0%,但各地区存在一定差异,其中,我国华东地区HPV感染率约为31.3%,东北地区HPV感染率约为34.6%,西北地区HPV感染率约为23.2%,西南地区HPV感染率约为24.1%[22]。为了解本区农村女性HPV的感染情况,本文对7 500例农村女性进行HPV检测,其HPV总感染率约为12.97%,明显低于文献报道的西南地区24.1%的感染率,考虑本文研究对象为筛查体检人群,而非医院门诊患者,这一结果提示不同研究人群可能由于其相应的HPV感染危险因素存在差异进而影响其HPV感染率。因此,我们将在今后的工作中深入研究本地区各人群HPV感染危险因素的情况,以期为进一步提升和改善本区HPV的防治工作提供基础。
本文中,本区35~65岁年龄段的HPV感染率随年龄呈现上升的趋势,与本地相关文献报道部分相符[23-24]。其中,35~45岁年龄组感染率为11.29%;46~55岁年龄组感染率为12.40%;56~65岁年龄组感染率为16.92%。3组中,56~65岁年龄组感染率最高,且与其他组相比差异有统计学意义。这表明在本区农村女性中,HPV感染存在一定的年龄差异,且中年女性的HPV感染率较高。
本文7 500例受检标本中,HPV感染以单一感染为主,其感染率约为10.11%(758/7 500),说明本区HPV单一型感染较为常见,与本区其他报道相符[25-26];其次为二重感染,其感染率约为2.09%(157/7 500)。在二重感染中,共有60种复合型别,以52型复合58型感染为主,感染率为0.13%(10/7 500),其次为51型复合52型感染与52型复合68型感染,感染率为0.12%(9/7 500),再次为16型复合52型感染、18型复合52型感染以及18型复合58型感染,感染率为0.09%(7/7 500)。随着感染型别的增加,其感染率也随之降低,七重感染仅检出1例,但此次并未发现六重感染者。有研究认为,高危型HPV多重感染可能更易导致宫颈瘤变的发生,因此我们除了重点关注高危HPV单一感染外,也需要对HPV多重感染引起一定的重视[27]。将单一感染和多重感染合计分析,发现本区HPV主要感染型别有HPV16、HPV52和HPV58,与本区部分报道中的前3位主要感染型别一致[26-28],但HPV感染型别的排序不同,本文HPV感染型别按感染率高低排序依次为HPV52、HPV58和HPV16。该差异构成了本区农村女性HPV单一亚型感染的流行特征,进一步说明HPV感染亚型分布存在地域差异。
有报道显示,针对性的疫苗可有效防止相应型别的HPV感染,如对HPV16和18型的疫苗可以有效地防止HPV16型和18型感染,从而降低宫颈癌的发病率,表明不同地区针对当地HPV感染特征制订相应的防治措施十分必要[29-31]。而本区农村女性HPV感染独特的亚型分布特征,提示针对HPV16、HPV52和HPV58型的疫苗可能更适合本区农村女性。但为了更加全面地了解重庆地区女性HPV的感染现状,进一步改善宫颈癌的防治工作,还需要扩大研究人群及样本量,并对其相应的HPV感染危险因素进行深入、全面、系统的研究。
