除草剂阿特拉津的免疫毒性及其对大鼠免疫功能的影响
2018-11-28赵本正陈俊宇金延泽
赵 菁,刘 剑,张 敏,吴 珊,赵本正,陈俊宇,金延泽
(1.延边大学附属医院妇产科,吉林 延吉133000;2.吉林大学第二医院妇产科,吉林 长春 130041; 3.吉林大学第二医院病理科,吉林 长春 130041)
阿特拉津(atrazine, ATR)是世界上使用最广泛的除草剂之一[1],在土壤和地表水中持续存在并具有生物蓄积作用,可能对人类健康构成重大威胁[2]。免疫系统有识别自己和异己的功能,当某些因素导致机体免疫功能失调时,常会诱发各种疾病。已有研究[3-4]表明:长时间暴露于ATR的鱼类及两栖动物免疫功能受到抑制。Nikolay等[5]研究显示:接触 ATR 14 d后C57BL/6成年小鼠的胸腺质量和脾质量减少,构成细胞持续减少。流行病学研究[6]显示:ATR暴露与肿瘤的发生发展密切相关,其可能是生殖系统肿瘤的危险因子。目前关于ATR亚急性暴露对大鼠免疫功能的影响尚需进一步研究,本实验通过探讨ATR对健康大鼠免疫功能的影响,从免疫学角度阐明ATR导致机体损伤的机制,从而为全面评价ATR毒性效应及风险评估提供科学依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器 4周龄Wistar雌性大鼠32只,购于吉林大学基础医学院实验动物中心(动物合格证号:201600014675),饲养于恒定温度(22℃~25℃)、恒定湿度(40%~50%)环境中,标准饲料和水供动物自由食用。ATR(纯度为98.99%,以橄榄油溶解)和刀豆蛋白A(concanavalin A,Con A)购于美国Sigma公司,RPMI 1640和胎牛血清购自美国Gibco公司,白细胞介素1(IL-1)和白细胞介素6 (IL-6)酶联免疫试剂盒购于美国R&D公司,CD3和CD8荧光标记抗体购于美国Ebioscience公司,以橄榄油溶解ATR并制备0.5 、2.5和12.5 g·L-1ATR溶液(4℃条件下最多保存1周)。BIO-RAD550酶标仪购于美国Biorad公司,YZ-875超净工作台购于苏州净化设备厂,自动CO2恒温培养箱购于日本ANYO公司,101A-2电热鼓风干燥箱购于上海实验仪器总厂,ss-245自动高压蒸气消毒器购于日本SONY公司。
1.2 动物分组和处理 32只Wistar雌性大鼠随机分为4组,每组8只。对照组大鼠以等体积橄榄油灌胃,低、中、高剂量ATR组大鼠分别给予5、25和125 mg·kg-1ATR灌胃,每日1次,连续给药28 d,第29天处死各组大鼠,取血及脾脏备用。
1.3 各组大鼠体质量和脾质量的测定 大鼠于ATR开始给药当天和其后每7天称体质量,第29天处死大鼠,脾脏无菌称质量,计算脾指数。脾指数=脾质量(mg)/体质量(g)。
1.4 脾单细胞悬液的制备 无菌取各组大鼠的脾组织,剪碎,置于无菌尼龙网上,滴入RPMI 1640完全培养液,轻轻研磨,采用400 μm不锈钢网去除细胞碎片。采用低渗缓冲溶液裂解红细胞,以淋巴细胞分离液密度梯度离心法(400 g、20 min)分离脾淋巴细胞,PBS洗涤并重悬于RPMI 1640培养基(含有10%FBS、100 U·mL-1青霉素、100 mg·L-1链霉素和2 mmol·L-1L-谷氨酰胺)中,采用台盼蓝排除法检测细胞活力,当细胞活力>95%时进行细胞计数。
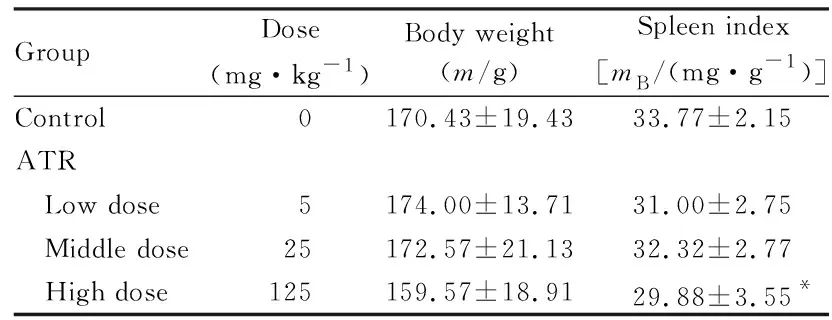
1.5 HE染色检测各组大鼠脾组织病理形态表现 收集脾脏,固定于10%甲醛缓冲液中,石蜡包埋,然后切片。切片采用苏木精溶素染色用于组织学评估和镜检。
1.6 淋巴细胞转化实验检测各组大鼠脾淋巴细胞转化率 调整淋巴细胞浓度至2×107mL-1,接种于96孔培养板,每孔100 μL培养过夜。实验孔更换为含40 mg·L-1ConA的RPMI 1460培养液,对照孔更换为RPMI 1640培养液,设3个重复孔,置于37℃、5%CO2恒温孵箱中无菌培养48 h。于分光光度仪490 nm处读取吸光度(A)值,计算脾淋巴细胞转化率。脾淋巴细胞转化率=实验孔A值/对照孔A值×100%。
1.7 各组大鼠NK细胞杀伤活性的检测 如上所述制备来自小鼠脾脏的效应细胞。NK细胞对小鼠淋巴瘤细胞(即YAC-1细胞)敏感,因此采用YAC-1细胞作为靶细胞。将1×105L-1YAC-1细胞和效应细胞分别加入96孔板中。孵育48 h后采用分光光度仪于490 nm处读取A值,计算NK细胞杀伤活性。NK细胞杀伤活性=1-(E+T的A值-E的A值)/ T的A值×100%,其中E+T=效 应细胞和靶细胞的混合物,E=效应细胞,T=靶细胞。
1.8 流式细胞术检测各组大鼠脾细胞中CD3+和CD8+T 细胞百分比 脾细胞重悬于100 μL结合缓冲液,加入10 μL CD3 PE-Cy5或CD8 PE抗体,37℃孵育15 min后PBS洗涤3次,随后于流式细胞仪上测定,以对照组为参照,通过CELL Quest 软件分析并以侧向和正向散射特征定义细胞亚型,分析 CD3+和CD8+T 细胞所占百分比。
1.9 ELISA法测定各组大鼠血清中IL-1和IL-6水平 处死各组大鼠,收集血液,3 000 g×10 min 离心收集血清,按照ELISA试剂盒说明书操作,测定各组大鼠血清中IL-1和IL-6水平。

2 结 果
2.1 各组大鼠体质量 本实验中,所有大鼠均存活到实验结束。与对照组比较,各剂量ATR组大鼠体质量差异无统计学意义(P>0.05);各剂量ATR组大鼠体质量组间比较差异无统计学意义(P>0.05)。见表1。
2.2 各组大鼠脾指数 与对照组比较,低和中剂量ATR组大鼠脾指数差异无统计学意义(P>0.05),高剂量ATR组大鼠脾指数降低(P<0.05);各剂量ATR组大鼠脾指数组间比较差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠体质量和脾指数
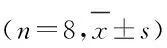
Group Dose(mg·kg-1)Body weight(m/g)Spleen index[mB/(mg·g-1)]Control 0170.43±19.4333.77±2.15ATR Low dose 5174.00±13.7131.00±2.75 Middle dose25172.57±21.1332.32±2.77 High dose 125159.57±18.91 29.88±3.55*
*P<0.05 compared with control group.
2.3 各组大鼠脾组织病理形态表现 与对照组比较,低剂量ATR组大鼠脾组织无明显变化;中剂量ATR组大鼠脾组织生发中心略减少;高剂量ATR组大鼠脾组织呈现明显退行性变,生发中心消失,白髓减少,红髓充血。说明高剂量ATR组大鼠脾脏产生了毒性反应。见图1(插页三)。
2.4 各组大鼠脾淋巴细胞转化率 与对照组比较,低和中剂量ATR组大鼠脾淋巴细胞转化率差异无统计学意义(P>0.05)。高剂量ATR组大鼠脾淋巴细胞转化率明显降低(P<0.05)。见表2。
2.5 各组大鼠NK细胞杀伤活性 与对照组比较,各剂量ATR组大鼠脾细胞中NK细胞杀伤活性差异无统计学意义(P>0.05)。见表2。
2.6 各组大鼠脾细胞中CD3+和CD8+T细胞百分比 与对照组比较,低和中剂量ATR组大鼠脾细胞CD3+和CD8+T细胞百分比差异无统计学意义(P>0.05),高剂量ATR组大鼠脾细胞中CD3+T细胞和CD8+T细胞百分比降低(P<0.05);各剂量ATR组大鼠脾细胞CD3+和CD8+T细胞亚群百分比比较差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠脾细胞中脾淋巴细胞转化率、NK细胞杀伤活性、CD3+和CD8+T细胞百分比
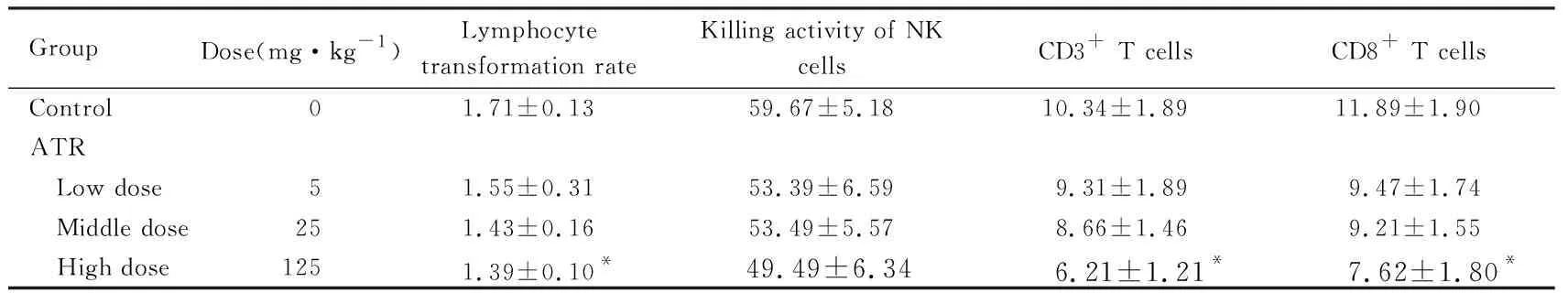
Group Dose(mg·kg-1)Lymphocyte transformation rateKilling activity of NK cellsCD3+ T cellsCD8+ T cellsControl 01.71±0.1359.67±5.1810.34±1.8911.89±1.90ATR Low dose 51.55±0.3153.39±6.599.31±1.899.47±1.74 Middle dose251.43±0.1653.49±5.578.66±1.469.21±1.55 High dose 1251.39±0.10*49.49±6.34 6.21±1.21* 7.62±1.80*
*P<0.05 compared with control group.
2.7 各组大鼠血清中IL-1和IL-6水平 与对照组比较,低和中剂量ATR组大鼠血清中IL-1和IL-6水平差异无统计学意义(P<0.05),高剂量ATR组大鼠血清中IL-1和IL-6水平升高(P<0.05);各剂量ATR组大鼠血清中IL-1和IL-6水平比较差异无统计学意义(P>0.05)。见表3。
表3 各组大鼠血清中IL-1和IL-6水平
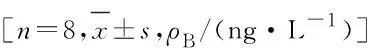
Group Dose(mg·kg-1)IL-1 IL-6Control 0660.06±127.86378.00±86.09ATR Low dose 5672.84±138.53423.93±42.74 Middle dose25670.51±107.42417.82±27.04 High dose 125754.83±130.31*467.38±37.03*
*P<0.05 compared with control group.
3 讨 论
ATR是目前世界上应用最广的除草剂之一,其广泛应用所引起的环境问题已引起了人们的关注[7]。尽管目前欧盟已经禁止使用ATR,但是中国和美国仍然大量使用ATR[8]。研究[9]显示:ATR可导致Wistar大鼠运动减少,自发性肌肉活动和全身僵硬症。研究[10-14]显示:长期与ATR接触会对心脏、肺、血液、神经及生殖系统造成损伤,甚至导致癌症。已有研究[15-17]证实:ATR可引起生物体免疫功能抑制。Chen等[15]研究显示:ATR对小鼠细胞免疫、体液免疫和非特异性免疫功能具有抑制作用,Zhao 等[16]研究显示:ATR亚急性暴露影响小鼠脾细胞功能。Karrowa等[17]发现ATR可降低雌性B6C3F1小鼠的细胞免疫及机体抗病能力。Nikolay等[5]发现:C57BL/6成年小鼠连续暴露于250 mg·kg-1ATR条件下14 d后,脾脏构成细胞持续减少,树突状细胞的成熟被抑制,胸腺中CD4+/CD8+T细胞受明显影响。ATR通过抑制脾脏树突状细胞成熟、干扰体液和细胞介导的免疫反应,由此可说明ATR处理后小鼠对肿瘤的宿主抵抗力减弱的原因[18]。Pinchuk等[19]发现ATR干扰树突状细胞成熟从而清除组织相容性抗原Ⅰ(MHC-Ⅰ)分子,ATR可能有助于免疫逃避。Karrow等[20]发现:ATR抑制小鼠胸腺指数和巨噬细胞数,减少脾CD8+细胞数和杀伤性细胞数,并剂量依赖性地降低小鼠对B16F10黑色素瘤的宿主抵抗力。可见ATR可能通过免疫抑制降低肿瘤耐受力。
本研究结果显示:与对照组比较,各剂量ATR组中大鼠体质量比较差异无统计学意义,但高剂量ATR组中大鼠脾指数降低。HE染色结果提示:高剂量ATR组大鼠脾脏出现明显退行性变,具体表现为生发中心消失,白髓减少,红髓充血,说明125 mg·kg-1ATR组可对大鼠脾脏产生毒性反应。
CD3+T淋巴细胞是外周血中代表成熟T淋巴细胞的标志物之一,本研究结果显示:与对照组比较,高剂量ATR组大鼠脾细胞中CD3+和CD8+T细胞百分比降低,提示ATR可影响脾脏中T淋巴细胞亚群的分布,减少CD3+T淋巴细胞的亚群百分比,破坏效应T淋巴细胞亚群的构成平衡和细胞免疫功能的稳定。淋巴细胞转化率是反映机体细胞免疫的基本指标[21],本实验中大鼠淋巴细胞转化实验结果显示:与对照组比较,高剂量ATR组大鼠脾淋巴细胞转化率降低,提示ATR有抑制T细胞免疫功能的作用。以上改变可能有利于肿瘤免疫耐受的形成,降低免疫系统对肿瘤免疫的应答。Lee等[22]发现:ATR促使脾脏CD3+T细胞亚群减少,而CD19+B淋巴细胞和非淋巴细胞未受影响,并进一步探讨其机制发现ATR触发了半胱氨酸天冬氨酸蛋白酶3(caspase-3)的激活和半胱氨酸天冬氨酸蛋白酶8(caspase-8)和聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase, PARP)的裂解,进而诱导内质网应激介导的T淋巴细胞凋亡。
白细胞介素是由白细胞和其他细胞产生,在细胞间发挥作用的细胞因子。细胞因子是监测动物和人类免疫系统的一个敏感指标,Xang等[23]发现:将幼年鲤鱼暴露于高浓度ATR下,其脾组织中IL-1表达水平明显升高。本研究结果显示:ATR暴露后,与对照组比较,高剂量ATR组大鼠血清中IL-1和IL-6水平均升高。IL-1的分泌可刺激免疫细胞产生IL-6,IL-6过度表达与肿瘤进展失调相关,其机制与多种信号通路特别是信号转导和转录激活因子3(Stat3)信号通路相关。研究[24]显示:患者血清中IL-6水平升高与各种癌症(如多发性骨髓瘤、非小细胞肺癌、结直肠癌、肾细胞癌、前列腺癌、乳腺癌和卵巢癌)相关,且与患者生存期缩短有关。因此ATR可能通过提高血清中IL-1水平,促进IL-6分泌,进而通过IL-6激活多信号通路,最终对肿瘤的发生发展起到促进作用。
综上所述,ATR作为一种环境污染物,具有脾脏毒性,能够降低淋巴细胞转化率,减少CD3+和CD8+T细胞数量,可能有利于肿瘤免疫耐受的形成进而影响机体的抗肿瘤能力;同时ATR通过提高IL-1水平,促进IL-6分泌,进而激活多条信号通路,从而对肿瘤的发生发展起促进作用。因此ATR的免疫毒性应该引起足够的重视。
