水氮控制对荒漠草原中小型土壤动物的影响
2018-11-28赵巴音那木拉霍利霞高海燕
叶 贺,红 梅,2*,赵巴音那木拉,2,霍利霞,高海燕
水氮控制对荒漠草原中小型土壤动物的影响
叶 贺1,红 梅1,2*,赵巴音那木拉1,2,霍利霞1,高海燕1
(1.内蒙古农业大学草原与资源环境学院,内蒙古 呼和浩特 010011;2.内蒙古自治区土壤质量与养分资源重点实验室,内蒙古 呼和浩特 010011)
为了解模拟氮沉降和降雨变化对短花针茅荒漠草原中小型土壤动物的影响,本试验设计主区为自然降雨(CK)、增雨30%(W)和减雨30%(R)3个水分处理,副区为0(N0),30(N30),50(N50)和100(N100)kg/(hm2∙a)4个氮素处理共12个处理.研究表明:在相同的水分处理中随着氮浓度的不断增高,表层土壤中中小型土壤动物的个体密度呈先上升后下降趋势.W-N30处理下中小型土壤动物个体密度高于其他处理,类群数随着氮浓度升高呈下降趋势,减雨与过量施氮对表层土壤中中小型土壤动物个体密度具有抑制作用.短花针茅荒漠草原中小型土壤动物在土层中具有明显的表聚特性.另外,冗余分析(RDA)表明,研究区内中小型土壤动物的优势类群与常见类群受环境因子影响较显著,土壤pH值、温度、含水量、有机质和植物全C、全N、C/N对中小型土壤动物个体密度影响均较大,但短期内对类群数的影响不显著.当短花针茅荒漠草原面临全球变化时,随着氮沉降量逐渐增加,表层土壤中中小型土壤动物个体密度先逐渐增加,当达到不同水分条件下氮浓度阈值时,则对表层土壤中中小型土壤动物产生抑制作用.
荒漠草原;氮沉降;降水变化;中小型土壤动物
全球变化是人类面临的一个重大问题[1],大气氮沉降增加和降雨格局变化作为全球变化的两个重要现象,其导致的一系列生态问题日趋严重[2-3], 2010年我国氮沉降总量约为7.6×103Gg[4],氮沉降绝大部分最终将进入土壤,对陆地生态系统产生影响[5-7].自20世纪以来,全球年均降雨量增加了2%, 30°~85°N地区降雨增加尤为显著,增加了7%~ 12%[8].内蒙古荒漠草原位于41°N,该地区气候干燥,降雨稀少,水资源缺乏,地上、地下生物量匮乏,生态环境极其脆弱,全球气候变化对其影响十分严重,同时对陆地生态系统生物链中最为敏感的类群之一土壤动物也具有较大影响[9-12].
土壤动物在土壤动植物残体分解、污染物降解、土壤理化性质的进化、土壤发育与物质迁移及能量转化等物理、化学过程方面都具有重要作用,是陆地生态系统的关键环节[13].研究表明,氮沉降与降雨变化通过增加植物地上生物量对土壤动物多样性产生影响[14-15].同时,氮沉降与降雨变化还会降低植物物种丰富度,即降低植食性动物食物资源的多样性,进而改变土壤动物的群落组成与结构[16-17].目前模拟水氮交互对中小型土壤动物影响的研究仍较少,但对荒漠草原的恢复与保护具有重要意义.本研究以内蒙古自治区乌兰察布市四子王旗短花针茅草原为研究对象,通过设置水氮不同梯度对短花针茅荒漠草原的中小型土壤动物进行研究,在全球变化条件下为短花针茅荒漠草原生态系统平衡与生物多样性保护提供科学依据.
1 材料与方法
1.1 研究区概况
试验区位于内蒙古自治区乌兰察布市四子王旗短花针茅草原生态系统野外科学试验基地,地理坐标41°47′N,111°53′ E,海拔1450m,研究区地处温带干旱、半干旱大陆性季风气候区,历年平均降雨量为280mm,降雨主要集中在6~9月,占全年降雨总量的70%以上,而蒸发量是降雨量的7~10倍.多年平均气温为3.4℃.试验区土壤为淡栗钙土,属短花针茅荒漠草原地带性植被,草地类型为短花针茅+冷蒿+无芒隐子草.建群种为短花针茅(),优势种为冷蒿()、无芒隐子草().
1.2 试验设计
试验于2015年12月开始进行,采用裂区设计,主区为自然降雨(CK)、增雨30%(W)和减雨30%(R)3个水分处理,增雨试验分别在每年5~8月的1~3日进行,通过多年对荒漠草原降雨量监测并做模型预测未来降雨量增减极限,增加量为近5a 5月(18.4%)、6月(17.0%)、7月(28.3%)、8月(36.3%)平均降雨量的30%,减雨试验通过减雨装置减少当地年平均降雨量的30%.副区为0(N0),30(N30), 50(N50), 100(N100) kg/(hm2∙a)4个氮素处理,其中不包括大气氮沉降,施氮处理按照施氮量换算成小区硝酸铵(NH4NO3)施用量,为能够尽可能均匀施氮,在生长季(5~9月)每月一次,将每个小区每次施用硝酸铵的量溶于30L水中(在增雨处理之后),均匀喷洒在每个小区内,CK喷洒相同量的水,非生长季(10月~翌年4月),将每月每个小区施氮量与风干土(直径<2mm)按肥土比1:10的比例充分混匀,在无风时以模拟干沉降的方式直接撒施.试验共12个处理,6次重复.每个小区面积为7m×7m=49m2,各小区间设置2m隔离带.
1.3 样品采集与土壤动物鉴定
按照季节动态即每年4月(春季)、7月(夏季)和10月(秋季)采集样品,其中4月为植物萌发期,7月为植物生长期,10月为植物衰落期,随着季节更替,中小型土壤动物对气候因子变化及不同处理会产生不同的响应.本文样品采集于2016年7月、10月与2017年4月.取样时,为了消除边界效应,在每个小区中间点采用环刀(高10cm,直径5cm)由上至下分别从0~10、10~20cm共2层土层依次取样.中小型土壤动物采用改良Tullgren漏斗经过24h分离提取,将收集到的中小型土壤动物装在盛有75%酒精的塑料瓶中,分类鉴定参考《中国土壤动物检索图鉴》[18],并在显微镜(Olympus CKX41)和体视显微镜(SZ78系列)下对标本进行鉴定,所有土壤动物鉴定到科.个体类群等级划分为:个体数占总个体数10%以上的土壤动物类群为优势类群,1%~10%之间的土壤动物类群为常见类群,1%以下的为稀有类群.
于2016年8月植物生长旺盛季采集植物样品,植物C、N采用含量元素分析仪测定;地上生物量采用收割法测定,地下生物量采用漂洗法测定.2017年4月土壤动物样品采集后,取0~20cm的混合土壤样品1kg,作为土壤理化性质指标的测试.土壤pH值采用电位法(酸度计STARTER 2100型,土:水=1:5)进行测定;土壤有机质(SOM)采用重铬酸钾-容量法测定(鲍士旦,2000);土壤含水量采用烘干法测定.
1.4 数据统计与分析
采集到的中小型土壤动物个体数量换算成密度(只/m2);对土壤动物群落特征进行分析时,采用Shannon多样性指数()、Pielou均匀度指数()、Margalef丰富度指数()和Simpson优势度指数()进行分析[19-20].采用单因素方差分析(one-way ANOVA)对不同数据进行差异显著性分析.采用冗余分析(RDA)对中小型土壤动物个体密度和类群数与环境因子之间进行分析.数据分析处理与作图采用Excel 2003,SAS 9.0与CANOCO 4.5进行.
群落多样性指数计算公式如下:

E
=
H
/In
S
(2)
D
=(
S
-1)/In
N
(3)

式中:P为第个物种的个体数占总个体数的比率;为类群数;为总个体数;n/表明各个体数占总个体数的百分数.
2 结果与分析
2.1 中小型土壤动物个体密度与类群组成
3次样品采集共在试验区分离得到中小型土壤动物46963.91只/m2,隶属于节肢动物门的4纲10目46科(表1),其中弹尾纲占总个体密度的50.64%,蛛形纲占总个体密度的33.46%,昆虫纲占总个体密度的15.54%,而唇足纲仅占总个体密度的0.36%.优势类群为疣䖴科(42.86%);常见类群有等节䖴科、球角䖴科、绒螨科、矮蒲螨科、缝甲螨科、赫甲螨科、阿斯甲螨科、真罗甲螨科、礼服甲螨科、洼甲螨科、奥甲螨科、剑甲螨科、美绥螨科、厚厉螨科、厉螨科、隐翅甲科、管蓟马科、木螱科、蚁科,共19个类群,其个体密度占总个体密度的45.93%.优势类群(42.86%)和常见类群(45.93%)个体密度占总个体密度的88.79%.其余26个类群为稀有类群,其个体密度仅占总个体密度的11.21%.以上不同类群所占比例差异较大,优势类群和常见类群构成试验区中小型土壤动物群落的主体.

表1 水氮控制下中小型土壤动物群落组成
续表1

群落组成个体密度(只/m2) 纲目科CKWR总计 N0N30N50N100N0N30N50N100N0N30N50N100 阿斯甲螨科84.93 (0.18)84.93 (0.18)--169.85 (0.36)84.93 (0.18)--84.93 (0.18)--84.93 (0.18)594.48 (1.27) 泥甲螨科--84.93 (0.18)---84.93 (0.18)-----169.85 (0.36) 鲜甲螨科84.93 (0.18)-----------84.93 (0.18) 盖头甲螨科--------84.93 (0.18)---84.93 (0.18) 四奥甲螨科--169.85 (0.36)84.93 (0.18)-169.85 (0.36)------424.63 (0.9) 真罗甲螨科84.93 (0.18)169.85 (0.36)---169.85 (0.36)----84.93 (0.18)-509.55 (1.08) 礼服甲螨科-----934.18 (1.99)84.93 (0.18)-84.93 (0.18)-84.93 (0.18)84.93 (0.18)1273.89 (2.71) 洼甲螨科--84.93 (0.18)-----254.78 (0.54)--169.85 (0.36)509.55 (1.08) 丽甲螨科-84.93 (0.18)-169.85 (0.36)84.93 (0.18)-----84.93 (0.18)-424.63 (0.9) 垂盾甲螨科-------169.85 (0.36)-84.93 (0.18)--254.78 (0.54) 奥甲螨科-84.93 (0.18)84.93 (0.18)84.93 (0.18)--84.93 (0.18)--84.93 (0.18)169.85 (0.36)84.93 (0.18)679.41 (1.45) 步甲螨科---------84.93 (0.18)--84.93 (0.18) 剑甲螨科-169.85 (0.36)254.78 (0.54)-84.93 (0.18)84.93 (0.18)84.93 (0.18)-----679.41 (1.45) 滑珠甲螨科---------84.93 (0.18)--84.93 (0.18) 尖棱甲螨科---------84.93 (0.18)--84.93 (0.18) 单翼甲螨科---------84.93 (0.18)--84.93 (0.18) 蜱螨目-中气门亚目美绥螨科84.93 (0.18)84.93 (0.18)84.93 (0.18)84.93 (0.18)254.78 (0.54)--169.85 (0.36)254.78 (0.54)84.93 (0.18)-84.93 (0.18)1188.96 (2.53) 巨螯螨科-----254.78 (0.54)84.93 (0.18)84.93 (0.18)----424.63 (0.9) 厚厉螨科169.85 (0.36)-84.93 (0.18)254.78 (0.54)-84.93 (0.18)-84.93 (0.18)---169.85 (0.36)849.26 (1.81) 寄螨科---------84.93 (0.18)84.93 (0.18)-169.85 (0.36) 植绥螨科--169.85 (0.36)-84.93 (0.18)-84.93 (0.18)-84.93 (0.18)---424.63 (0.9) 厉螨科84.93 (0.18)84.93 (0.18)84.93 (0.18)509.55 (1.08)-84.93 (0.18)-169.85 (0.36)84.93 (0.18)84.93 (0.18)339.7 (0.72)-1528.66 (3.25) 蜘蛛目逍遥蛛科-----84.93 (0.18)------84.93 (0.18) 昆虫纲鞘翅目叩甲科----------84.93 (0.18)-84.93 (0.18) 缨甲科-84.93 (0.18)-84.93 (0.18)---84.93 (0.18)----254.78 (0.54) 金龟甲科-84.93 (0.18)-84.93 (0.18)------84.93 (0.18)-254.78 (0.54)
续表1
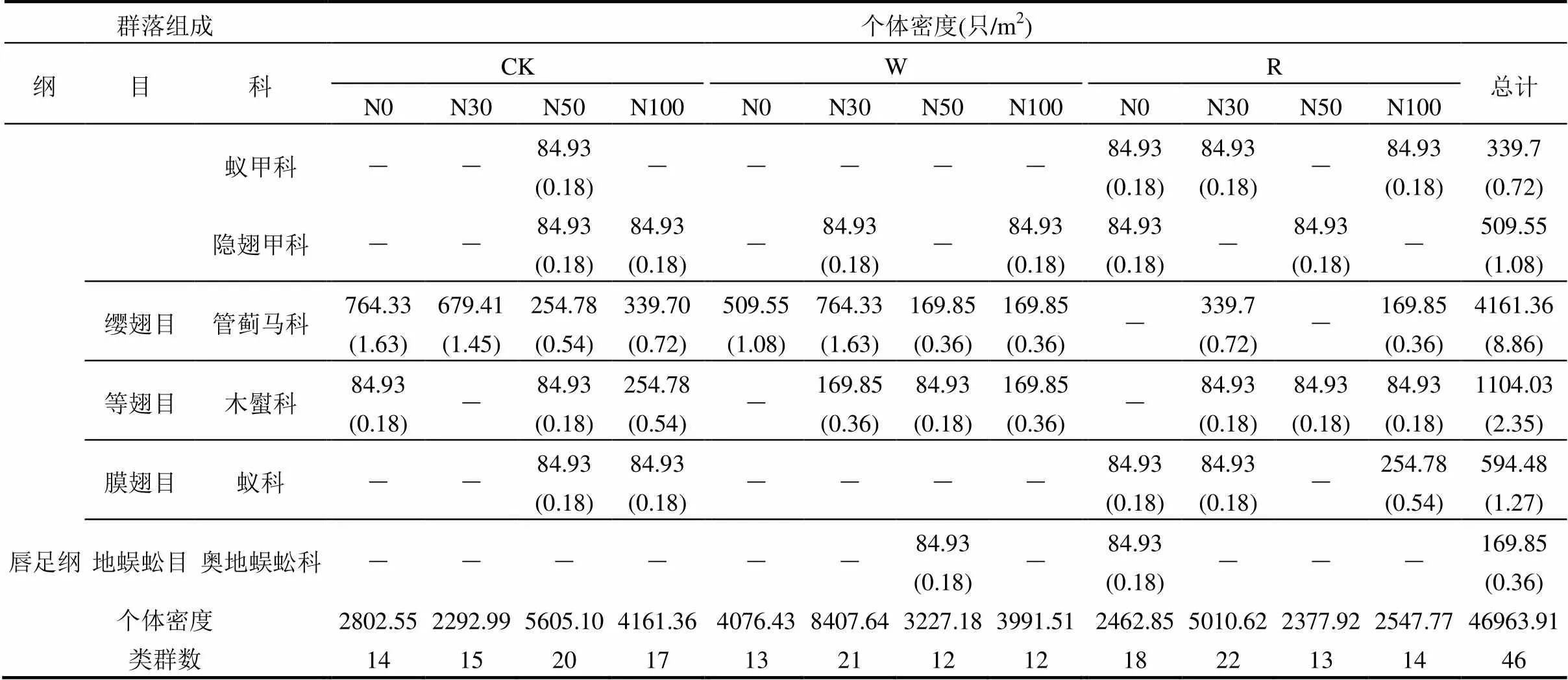
群落组成个体密度(只/m2) 纲目科CKWR总计 N0N30N50N100N0N30N50N100N0N30N50N100 蚁甲科--84.93 (0.18)-----84.93 (0.18)84.93 (0.18)-84.93 (0.18)339.7 (0.72) 隐翅甲科--84.93 (0.18)84.93 (0.18)-84.93 (0.18)-84.93 (0.18)84.93 (0.18)-84.93 (0.18)-509.55 (1.08) 缨翅目管蓟马科764.33 (1.63)679.41 (1.45)254.78 (0.54)339.70 (0.72)509.55 (1.08)764.33 (1.63)169.85 (0.36)169.85 (0.36)-339.7 (0.72)-169.85 (0.36)4161.36 (8.86) 等翅目木螱科84.93 (0.18)-84.93 (0.18)254.78 (0.54)-169.85 (0.36)84.93 (0.18)169.85 (0.36)-84.93 (0.18)84.93 (0.18)84.93 (0.18)1104.03 (2.35) 膜翅目蚁科--84.93 (0.18)84.93 (0.18)----84.93 (0.18)84.93 (0.18)-254.78 (0.54)594.48 (1.27) 唇足纲地蜈蚣目奥地蜈蚣科------84.93 (0.18)-84.93 (0.18)---169.85 (0.36) 个体密度2802.552292.995605.104161.364076.438407.643227.183991.512462.855010.622377.922547.7746963.91 类群数14152017132112121822131446
注:括号中数据为占总个体密度的比例(%).“-”表示该土壤动物类群在处理中未被发现.
2.2 水氮控制下中小型土壤动物群落分布特征
通过3次采样综合分析,在不同梯度水氮控制下W-N30处理0~10cm和10~20cm土层的中小型土壤动物个体密度显著高于其它处理(<0.05). CK-N50、W-N30和R处理N30条件下中小型土壤动物个体密度与类群数显著高于同水分处理中其它氮浓度,相同氮浓度下W处理中小型土壤动物个体密度高于CK与R处理.中小型土壤动物类群数在W-N30处理下显著高于其它处理(<0.05),在不同水分处理中随着氮浓度的不断增高,中小型土壤动物个体密度和类群数均呈现先上升后下降趋势.增雨和减雨对中小型土壤动物类群数影响不显著,但对中小型土壤动物个体密度具有显著影响,中小型土壤动物的个体密度与类群数随土壤深度增加而逐渐降低,不同处理间垂直分布情况相同.0~10cm和10~20cm土层的中小型土壤动物个体密度与类群数在不同处理之间保持相同的趋势,但在个体密度上有较大的差异,0~10cm土层中的中小型土壤动物的个体密度与类群数均大于10~20cm(图1).

图1 水氮控制下中小型土壤动物个体密度与类群数分布
不同小写字母表示不同处理之间个体密度或类群数有显著差异(<0.05)

表2 水氮控制下对中小型土壤动物影响的双因素方差分析(F值)
注:*表示差异显著(<0.05);**表示差异极显著(<0.01).
荒漠草原中小型土壤动物个体密度受水分、氮素和时间变化影响极为显著(<0.01),类群数受氮素、水氮交互影响显著(<0.05,受水分和时间变化影响极为显著(<0.01).通过双因素方差表明:水分、氮素与时间变化都会对中小型土壤动物个体密度产生较大影响,但对类群数影响不显著(表2).
2.3 水氮控制下中小型土壤动物月动态变化
温度与土壤含水量变化对中小型土壤动物活动具有关联性,在2016年10月份中小型土壤动物个体密度高于其余2个月.2016年7月W-N30处理中类群数高于其余2个月,中小型土壤动物受季节影响显著,总体表现为10月>7月>4月,季节变化与中小型土壤动物个体密度、类群数变化密切相关(图2).
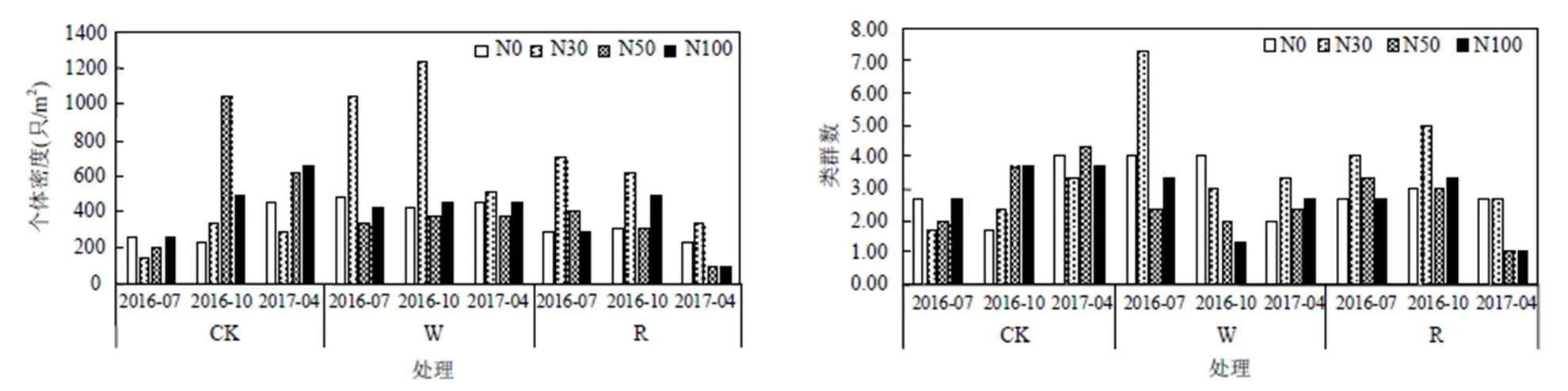
图2 水氮控制下中小型土壤动物月动态变化
2.4 水氮控制下中小型土壤动物多样性
水氮控制下中小型土壤动物在W处理中优势度指数高于R和CK处理,但无显著差异(>0.05). W-N30和CK-N100处理中多样性指数显著增高(<0.05),在W和R处理中,随着氮素含量的提升多样性指数呈先上升后下降趋势,氮素过多会对中小型土壤动物多样性指数产生抑制作用.均匀度指数差异显著(<0.05),氮素与水分均对其产生较大影响.丰富度指数在不同处理间趋势变化不明显,未到达显著水平(<0.05),水氮控制下对中小型土壤动物优势度指数与丰富度指数影响较小,对均匀度指数与多样性指数有显著影响(表3).
注:不同小写字母表示不同处理有显著差异(<0.05),:优势度指数;:多样性指数;:均匀度指数;:丰富度指数.
2.5 水氮控制下环境因子的变化
在水氮控制条件下,W-N50处理土壤pH值显著下降(<0.05),W-N50与CK-N0处理具有显著差异(<0.05),施氮降低了土壤pH值.有机质含量CK-N100处理显著高于R-N0处理(<0.05),土壤温度在W处理中显著低于R处理(<0.05).植物N与C/N变化不明显,并未达到显著水平(>0.05),植物C在R-N50与W-N50处理间有显著变化(<0.05).植物地上生物量随着水分与氮素的增多而增加,而地下生物量在CK与R处理N100浓度下均有下降趋势,整体呈先上升后下降趋势,R处理尤为明显,地上生物量在W-N100处与R-N0处理间具有显著差异(<0.05),地下生物量在增雨施氮小区与R-N100处理具有显著差异(<0.05)(表4).

表4 水氮控制下环境因子的变化
注:不同小写字母表示不同处理有显著差异(<0.05).
2.5 水氮控制下中小型土壤动物与环境因子间冗余分析
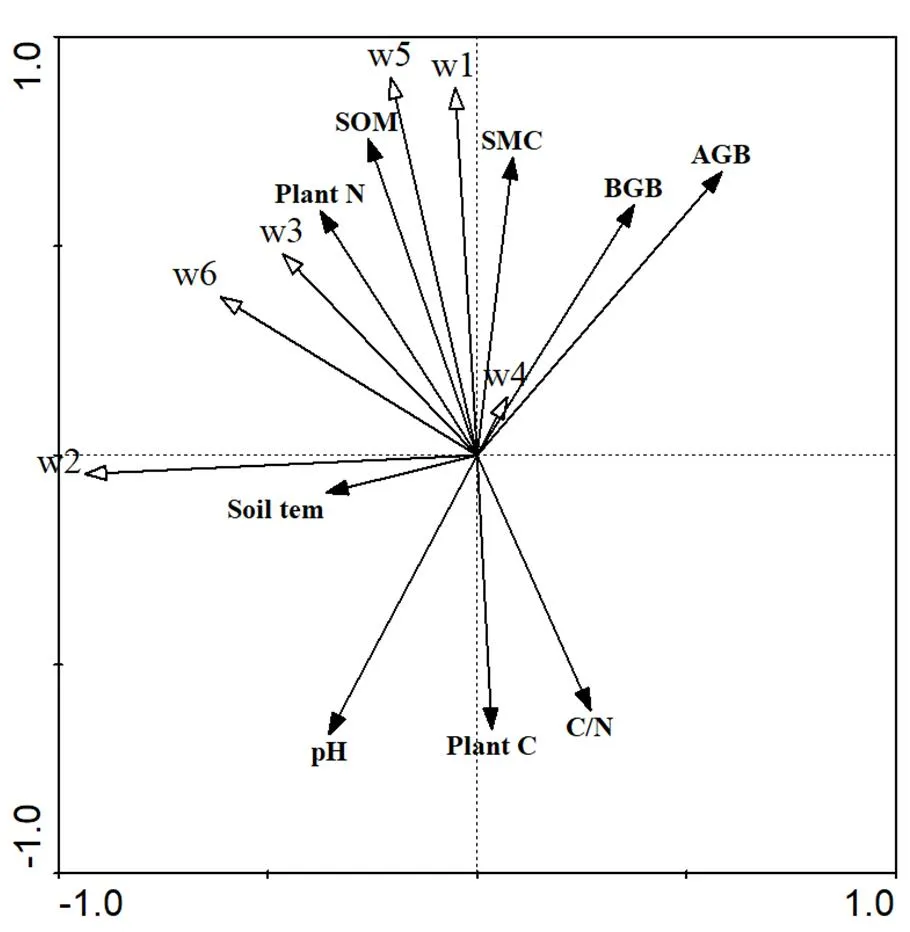
图3 中小型土壤动物与环境因子RDA分析排序图
1:弹尾目;2:前气门亚目;3:甲螨亚目;4:中气门亚目;5:个体密度;6:类群数
为进一步探讨水氮控制下中小型土壤动物与环境因子之间关系,采用冗余分析(RDA)方法进行分析,第一轴与第二轴分别累计解释了水氮控制下中小型土壤动物与环境因子总变量的63.5%和79.2%.弹尾目与土壤温度不相关,与其它环境因子均呈现显著相关性,前气门亚目与土壤温度呈显著相关性,甲螨亚目与土壤含水量呈相关性.中气门亚目与环境因子并无相关性.个体密度与pH值、土壤温度和地上、地下生物量无相关性,与土壤含水量呈极显著相关性,与其它环境因子呈显著相关性.类群数仅与土壤温度呈显著相关性(图3).
3 讨论
3.1 水氮控制对中小型土壤动物群落结构特征的影响
短花针茅荒漠草原中小型土壤动物在不同水分处理中随着氮浓度的升高,呈先下降后上升趋势,许多有关氮沉降对植物和微生物影响的研究结果证明,一定限度内的氮沉降对生物可能是有利的,但过量的氮沉降则会造成负面影响[21-22].氮沉降对土壤动物群落的影响存在阈值问题,这与徐国良等[6]的研究结果一致.但本研究在不同水分处理下分别在CK-N50、W-N30与R-N30时中小型土壤动物的个体密度与类群数达到最大值,在不同水分条件下阈值不同,徐国良等在研究氮沉降对苗圃地与南亚热带主要森林土壤动物影响时[23-24]阈值与本研究荒漠草原阈值并不相同,在不同生境条件下氮沉降量对中小型土壤动物的影响并不相同.程建伟等[25]在研究氮沉降对内蒙古典型草原土壤动物影响时与本文研究所得到阈值相同,氮沉降对土壤动物的阈值问题可能与降水量及气候存在关系,还需进一步研究.由于短花针茅荒漠草原对环境变化比较敏感,且降雨量稀少,所以在N100(100kg/(hm2∙a))时对表层土壤中中小型土壤动物产生了抑制作用.通过本研究表明短花针茅荒漠草原在W-N30(30kg/ (hm2∙a))处理条件下最适宜表层土壤中中小型土壤动物群落生存.
短花针茅荒漠草原中小型土壤动物的个体密度与类群数在垂直分布上都具有一定的表聚性,在0~10cm土层中小型土壤动物的个体密度与类群数都高于10~20cm土层,10~20cm土层中的中小型土壤动物在各处理之间没有较大差异,而0~10cm土层中的中小型土壤动物则对不同处理之间有较大的差异,这可能是由于氮素沉降到土壤中,土壤的缓冲作用,表层土壤具有最直接的处理效果,随着土层的加深,它的效应逐渐减弱[26-27].有研究表明草原生态系统地表温度变化可对中小型土壤动物的垂直分布产生影响[28].吴东辉等[29]研究发现草原生态系统的0~10cm土层是植物根系的主要分布区,土壤相对疏松,通气性好,营养丰富,因此土壤动物相对增多.本研究结果与其保持一致,短花针茅荒漠草原土壤贫瘠,10~20cm土层养分含量较低,无论在任何处理下都很少能发现中小型土壤动物,影响荒漠草原的土壤动物垂直分布的机制仍需进一步探究.
短花针茅荒漠草原中小型土壤动物的个体密度与类群数在时间变化上表现为10月>7月>4月.这与刘任涛等[30]研究中小型土壤动物个体密度表现为春季>夏季>秋季略有不同,这可能是由于两地气候与采样时间差异导致.
3.2 水氮控制对中小型土壤动物多样性的影响
氮素增加与水分变化对荒漠草原中小型土壤动物的优势度指数与丰富度指数均没有显著影响(>0.05),但对均匀度指数与多样性指数有显著影响,优势度指数越大,说明群落内物种数量分布越不均匀,优势种的地位突出,在氮素浓度过高时群落内部优势种数量增多,类群数减少,与上述结论保持一致.殷秀琴等[31]研究认为,优势度指数越大表明该群落中某个类群的土壤动物密度占该类群总数比例越高,使该类群的优势度增加而均匀度下降.本研究在CK-N100处理多样性指数显著高于W-N50处理,氮素过多对中小型土壤动物多样性指数有抑制作用.研究表明:土壤动物个体数量的增加是由于优势类群的土壤动物个体数量增加所引起的[32],所以W处理优势度指数略高于CK与R处理,但并不显著(>0.05).
3.3 水氮控制下环境因子对中小型土壤动物群落的影响
受环境因子影响较大的中小型土壤动物类群多为研究区内优势类群与常见类群,土壤pH值、温度、含水量、有机质和植物C、N、C/N对土壤动物个体密度影响较大,短期内对类群数的影响不明显.弹尾目疣䖴科做为优势类群受影响最为明显.李伟等研究表明:不同植被类型中的土壤动物对环境因子的响应不同,疣跳科受电导率的影响较大,等节䖴科与土壤有机质关系密切[33],研究结果基本保持一致.研究发现土壤pH值下降导致土壤动物无法生存,土壤酸化会使土壤动物数量减少,代谢衰弱以及生长繁殖能力减退[34-35].但由于试验区土壤属于碱性土壤,pH值较高,氮浓度的增高虽然使pH值略有降低但是对中小型土壤动物并无抑制作用,反而起促进作用.土壤动物是生态系统的重要组成要素,敏感性强,活动能力强,能对土壤环境的变化做出快速的反应[36].总体上看,荒漠草原表层土壤中中小型土壤动物对环境因子同样具有相同的反应.短花针茅荒漠草原面临全球变化时对中小型土壤动物的影响还需进一步研究.
4 结论
短花针茅荒漠草原表层土壤中中小型土壤动物群落在W-N30处理下最适宜生存.且具有表聚性,时间变化上表现为10月>7月>4月.氮素增加与水分变化对中小型土壤动物的优势度指数与丰富度指数短期内影响不显著,但对均匀度指数与多样性指数均有显著影响,在氮素浓度接近阈值时群落内部优势种数量增多,类群数减少.中小型土壤动物的优势类群与常见类群受环境因子影响较大.
[1] IPCC. Climate Change 2007: the Physical Science Basis: Summary for Policymakers. IPCC WGI Fourth Assessment Report, 2007.
[2] 常运华,刘学军,李凯辉,等.大气氮沉降研究进展[J]. 干旱区研究, 2012,29(6):972-979.
[3] Zhang W D, Yuan S F, Hu N, et al. Predicting soil fauna effect on plant litter decomposition by usingboosted regression trees. Soil Biology & Biochemistry, 2015,82:81-86.
[4] 郑丹楠,王雪松,谢绍东,等.2010年中国大气氮沉降特征分析[J]. 中国环境科学, 2014,34(5):1089-1097.
[5] 徐国良,莫江明,Brown Sandra,等.土壤动物对模拟N沉降的响应[J]. 生态学报, 2004,(10):2245-2251.
[6] Lee J A, Caporn S J M. Ecological effects of atmospheric reactive nitrogen deposition on semi-natural terrestrial ecosystems [J]. New Phytologist, 1998,139(1):127-134.
[7] Camargo J A, Alonso A. Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems: A global assessment [J]. Environment International, 2006,32(6):831-849.
[8] Houghton R A. Counting terrestrial sources and sinks of carbon [J]. Climatic Change, 2001,48(4):525-534.
[9] 黄建平,季明霞,刘玉芝,等.干旱半干旱区气候变化研究综述[J]. 气候变化研究进展, 2013,9(1):9-14.
[10] 张金凤,徐雨晴.水氮添加对内蒙古多伦县退耕还草地生物量、生产力及其分配的影响[J]. 中国生态农业学报, 2016,24(2):192-200.
[11] 杜宇凡,古 琛,王亚婷,等.放牧率对短花针茅根际和非根际土壤氮索的影响[J]. 草业科学, 2016,33(6):1021-1027.
[12] 秦建蓉,马红彬,王 丽,等.宁夏荒漠草原植物群落特征对不同轮牧开始时间的响应[J]. 草业科学, 2016,33(5):963-971.
[13] 朱立安,魏秀国.土壤动物群落研究进展[J]. 生态科学, 2007, 26(3):269-273.
[14] 刘任涛.荒漠草原土壤动物与降雨关系研究现状[J]. 生态学杂志, 2012,31(3):760-765.
[15] Van der Wal A, Geerts RHEM, Korevaar H, et al. Dissimilar response of plant and soil biota communities to long-term nutrient addition in grasslands [J]. Biology & Fertility of Soils, 2009,45(6):663-667.
[16] Cole L, Buckland S M, Bardgett R D. Relating microarthropod community structure and diversity to soil fertility manipulations in temperate grassland [J]. Soil Biology & Biochemistry, 2005,37(9): 1707-1717.
[17] Cole L, Buckland S M, Bardgett R D. influence of disturbance and nitrogen addition on plant and soil animal diversity in grassland [J]. Soil Biology & Biochemistry, 2008,40(2):505-514.
[18] 尹文英.中国土壤动物检索图鉴 [M]. 北京:科学出版社, 1998.
[19] 张雪萍,黄丽荣,姜丽秋.大兴安岭北部森林生态系统大型土壤动物群落特征[J]. 地理研究, 2008,27(27):509-518.
[20] Comet J, Gomot-D, Vauflery A,et al. The use of invertebrate soil fauna in monitoring pollutant effects [J]. European Journal of Soil Biology, 1999,35(3):115-134.
[21] Magill A H, Aber J D, Berntson G M, et al. Long-term nitrogen additions and nitrogen saturation in two temperate forests [J]. Ecosystems, 2000,3:238-253.
[22] Aber J D, McDowell W, Nadelhoffer K J, et al. Nitrogen saturation in Northern forest ecosystems, hypotheses revisited [J]. Bioscience, 1998,48:921-934.
[23] 徐国良,莫江明,周国逸,等.模拟氮沉降对苗圃地土壤动物群落的影响[J]. 生态环境, 2004,(4):487-492.
[24] 徐国良,莫江明,周国逸.模拟氮沉降增加对南亚热带主要森林土壤动物的早期影响[J]. 应用生态学报, 2005,16(7):1235-1240.
[25] 程建伟.氮添加对内蒙古典型草原土壤动物的影响[D]. 内蒙古大学, 2017.
[26] Bengtsson J. Temporal predictability in forest soil communities [J]. Journal of Animal Ecology, 1994,63:653-665.
[27] Haimi J, Siira-Pietika Einen A. Decomposer animal communities in forest soil along heavy metal pollution gradient. Anal Bioanal Chem, 1996,354:672-675.
[28] Briones M J I, Ostle N J, Mc Namara N P, et al.Functional shifts of grassland soil communities in response to soil warming [J]. Soil Biology and Biochemistry, 2008,41:315-322.
[29] 吴东辉,尹文英,卜照义.松嫩草原中度退化草地不同植被恢复方式下土壤线虫的群落特征[J]. 生态学报, 2008,(1):1-12.
[30] 刘任涛,赵哈林,赵学勇.半干旱区草地土壤动物多样性的季节变化及其与温湿度的关系[J]. 干旱区资源与环境, 2013,27(1):97-101.
[31] 殷秀琴,安静超,陶 岩,等.拉萨河流域健康湿地与退化湿地大型土壤动物群落比较研究[J]. 资源科学, 2010,32(9):1643-1649.
[32] 张庆宇,黄初女,王光达,等.秸秆还田对水田改旱田地块玉米产量及地下大型土壤动物群落的影响[J]. 延边大学农学学报, 2013,35(4):335-342.
[33] 李 伟,崔丽娟,王小文,等.太湖岸带湿地土壤动物群落结构与土壤理化性质的关系[J]. 林业科学, 2013,49(7):106-113.
[34] Xu G L, Schleppi P, Li M H, et al. Negative responses of collembola in a forest soil (Alptal, Switzerland) under experimentally increased N deposition [J]. Environmental Pollution, 2009,157(7):2030-2036.
[35] Stevens C J, Manning P, Berg L J, et al. Ecosystem responses to reduced and oxidised nitrogen inputs in European terrestrial habitats [J]. Environmental Pollution, 2011,159(3):665-676.
[36] 安 洋.松辽平原玉米带土壤动物多样性特征研究[D]. 吉林农业大学, 2011.
Effects of water and nitrogen control on soil meso- and micro-fauna communities in desert steppe.
YE He1, HONG Mei1,2*, ZHAO Bayinnamula1,2, HUO Li-xia1, GAO Hai-yan1
(1.College of Grassland, Resources and Environment, Inner Mongolia Agricultural University, Hohhot 010011, China;2.Inner Mongolia Key Laboratory of Soil Quality and Nutrient Resoures, Huhhot 010011, China)., 2018,38(11):4325~4333
An experiment with split-plot design which is water treatment as (3 levels: natural rainfall, increasing 30% of rainfall, and decreasing 30% of rainfall ) main treatment and nitrogen treatments(4 nitrogen levels: 0(N0), 30(N30), 50(N50) and 100(N100)kg/(hm2∙a) as sub-region indesert steppe, was conducted to understand the effects of simulated nitrogen deposition and rainfall changes on soil meso- and micro-fauna communities. Our results showed that soil fauna individual density in the surface soil was increased at first and then was decreased with nitrogen concentration increase in same water treatment.Soil meso- and micro-fauna communities individual density in W-N30treatment was significantly higher than that in other treatments(<0.05), and group number decreased with nitrogen concentration. Rainfall reduction and excessive nitrogen application decreased the individual density of soil meso- and micro-fauna communities in the surface soil. Soil meso- and micro-fauna individual of the surface indesert steppe was significantly higher than that of subsurface soil. In addition, redundant analysis (RDA) showed the most obvious responsive to environmental factors soil fauna was the dominant and common groups in the study area.Soil meso- and micro-fauna communities individual density, rather than group number, was greatly influenced by soil pH, temperature, water content, organic matter and total C, total N and C/N ratio in short period. Soil fauna individual density in surface soil increased with nitrogen deposition increased under future projected climate change. However, soil fauna communities in surface soil were restricted when nitrogen reached threshold under different conditions.
desert steppe;nitrogen deposition;precipitation change;soil meso- and micro-fauna communities
X174
A
1000-6923(2018)11-4325-09
叶 贺(1995-),男,内蒙古通辽人,硕士,主要从事草原土壤资源利用与保护.发表论文2篇.
2018-04-03
国家自然科学基金资助项目(31560156)
* 责任作者, 教授, nmczhm1970@126.com
