miRNA-326调控胃癌细胞活力和凋亡的机制及其在胃癌组织中的表达及临床意义*
2018-11-26刘海潮徐瑞娟刘玉荣章必成
袁 静, 周 捷△, 刘海潮, 徐瑞娟, 刘玉荣, 章必成
(1武汉理工大学医院内科, 2解放军武汉总医院呼吸内科, 3解放军武汉总医院肿瘤科, 湖北 武汉 430070)
胃癌是一种起源于胃黏膜上皮细胞的消化道恶性肿瘤,其发病率和死亡率一直位于世界恶性肿瘤的前列。近年来,全球范围内胃癌的发病率和死亡率均有下降,但在我国胃癌仍是仅次于肺癌的第2大肿瘤致死因素,是威胁人们身体健康和生活质量的重要原因[1-2]。临床上,胃癌的治疗仍是以手术为主,放疗、化疗和药物治疗等多种手段相结合的综合治疗,然而治疗效果并不乐观,患者的5年生存率不足30%[3-4]。胃癌的发生与发展是一个多因素、多步骤的复杂过程,与多种基因的调控密切相关。微小RNA(microRNA, miRNA)是一类小分子RNA,在胃癌的发生发展过程中挥发着重要作用[5-6]。miRNA-326是miRNAs中的一员,在多种肿瘤如肝癌、结肠癌和胶质瘤等组织中异常表达,参与肿瘤细胞的增殖凋亡过程[7-10],但其在胃癌中的作用机制尚不明确。因此,本研究通过收集组织标本,观察miRNA-326在胃癌组织中的表达并分析其临床意义,并在体外探究其在胃癌细胞活力和凋亡中的作用及其机制,为胃癌诊断和治疗提供一定的实验依据。
材 料 和 方 法
1 材料
1.1标本收集 自2015年7月~2017年3月收集本院确诊并接受治疗的55例胃癌患者的肿瘤组织和癌旁组织(距肿瘤边缘至少5 cm),其中,男性32例,女性23例,年龄45~71岁,中位年龄为58岁,其中,>56岁的有22例,≤56岁的有33例;淋巴结转移阴性有26例,阳性有29例;肿瘤直径>5 cm有19例,≤5 cm有36例;分化程度高分化有11例,中分化有19例,低分化有25例;参照AJCC第7版的TNM分期标准,Ⅰ期有5例,Ⅱ期有22例,Ⅲ期有28例。所参选患者术前均知情同意,并且均未接受任何放化疗。将收集到的标本组织均放入液氮罐中,保存于-80 ℃的冰箱内保存备用。
1.2细胞、试剂和仪器 胃癌细胞BGC-823和正常胃黏膜细胞GES-1购于中国科学院细胞库。10%胎牛血清购于Gibco;DMEM培养基和RPMI-1640培养基购于Bio-Rad;抗基质金属蛋白酶9(matrix metalloproteinases-9,MMP-9)(1∶1 000稀释)、p21(1∶800稀释)、细胞周期蛋白D1(cyclin D1)(1∶800稀释)、Bcl-2(1∶1 000稀释)、cleaved caspase-3(1∶800稀释)和β-actin(1∶1 000稀释)抗体及HRP标记的羊抗兔/鼠 II 抗(1∶2 000稀释)均购于Abcam;SDS-PAGE蛋白上样缓冲液购于Hyclone;CCK-8试剂和BCA蛋白定量试剂盒购于博迈德生物;逆转录试剂盒和ECL化学发光检测试剂盒购于上海碧云天公司;逆转录试剂盒购于上海浩然生物技术有限公司,miRNA-326 mimic、mimic阴性对照(mimic negative control,mimic-NC)和PCR引物均购于苏州吉玛公司;pmiR-RB-ReportTM、pmiR-CCND1-WT和pmiR-CCND1-Mut质粒购于Ribobio;Lipofectamine 2000、TRIzol试剂和PVDF膜均购于lnvitrogen。-80 ℃冰箱(海尔公司);CO2培养箱(RS Biotech);紫外分光光度计(Invitrogen);细胞培养箱(Thermo);电泳仪和凝胶成像系统(Bio-Rad);酶标仪(Biotek);流式细胞仪(Beckman)。
2 方法
2.1细胞培养 取冻存的BGC-823细胞和GES-1细胞,于37 ℃水浴锅中解冻复苏,转入离心管后,加入RPMI-1640完全培养基混匀后,离心弃上清,再加入培养基后转至培养瓶中,补加适量培养基,置于37 ℃、 5% CO2和湿度95%的培养箱内常规培养,每2 d换液,待细胞融合度在80%左右时,加胰蛋白酶(浓度为0.05%)按1∶2比例传代。收集第3代细胞进行实验。
2.2RT-qPCR检测胃癌组织和细胞中miRNA-326的表达 取粉碎的组织标本和收集到的BGC-823细胞、GES-1细胞,分别加入TRIzol 试剂提取总RNA,并采用紫外分光光度计检测总RNA的浓度,再根据逆转录试剂盒合成模板cDNA,以U6为内参照,检测胃癌组织和癌旁组织中miRNA-326的表达情况,每组样本设3个平行孔。miR-326的上游引物为5’-ACTGTCCTTCCCTCTGGGC-3’,下游引物为5’-AATGGTTGTTCTCCACTCTCTCTC-3’;U6的上游引物为5’-CTCGCTTCGGCAGCACA-3’,下游引物为5’-AACGCTTCACGAATTTGCGT-3’。PCR的扩增条件为预变性 94 ℃ 5 min;变性94 ℃ 15 s、退火62 ℃ 30 s、延伸72 ℃ 30 s,循环35次,总延伸72 ℃ 5 min。采用2-ΔΔCt法检测miRNA-326的相对表达量。
2.3细胞转染 收集对数生长期的BGC-823细胞,计数,以每孔100 μL 含4.5×106细胞的悬液进行种植,培养过夜。次日,进行脂质体转染。细胞分为:正常对照组(未做转染)、mimic-NC组(转染mimic-NC)和miRNA-326 mimic组(转染miRNA-326 mi-mic)。先配制转染液:采用RPMI-1640培养基(无胎牛血清)将miRNA-326 mimic、 mimic-NC(终浓度为 200 μmol/L)和转染试剂进行稀释,充分孵育后,将Lipofectamine 2000分别与miRNA-326 mimic和mi-mic-NC混合反应30 min。根据分组,将Lipofectamine 2000+miRNA-326 mimic混合液加入miRNA-326 mimic组中,Lipofectamine 2000+mimic-NC混合液加入mimic-NC组中,于孵箱中孵育5 h后,更换含血清的RPMI-1640培养基继续培养,48 h后收集各组细胞进行检测,参照2.2中的方法检测miRNA-326的转染情况。
2.4CCK-8法检测细胞的活力 取生长对数期的BGC-823细胞,制成浓度为5×107/L的细胞悬液,以每孔100 μL在96孔板上进行接种,实验分组及处理同2.3,并且每组实验设置5个平行复孔,每组重复3次,于培养箱中常规培养。分别在转染后24、48和72 h后收集细胞,每孔加入CCK-8溶液10 μL,充分混匀后,孵育2 h,以酶标仪进行检测,检测波长为490 nm。
2.5流式细胞术检测细胞凋亡 取转染后48 h的各组BGC-823细胞,每组细胞设置3个平行实验。先离心去上清,再以磷酸缓冲液漂洗2次,离心后,参照Annexin V-FITC/PI凋亡检测试剂盒说明书步骤进行操作,检测各组细胞的凋亡率。
2.6Western blot检测增殖和凋亡相关蛋白的水平 收集转染后48 h的各组BGC-823细胞于离心管中,加入裂解液RIPA提取总蛋白,并参照BCA试剂盒说明书检测得到总蛋白的浓度。将5×上样缓冲液与蛋白样品混合液放入100 ℃水浴中5 min变性。取50 μg变性蛋白上样至SDS-PAGE凝胶孔中,电泳结束后,转PVDF膜、封闭液封闭后,加入 I 抗过夜(4 ℃下),次日洗膜后,加入 II 抗,37 ℃下孵育2 h。滴加ECL发光显影液,以凝胶成像仪显影, Quantity One软件进行条带分析,以β-actin为内参照,目的条带与内参照的灰度比值作为目的蛋白的相对表达量。
2.7miRNA-326 靶基因的预测 采用RT-qPCR和Western blot检测正常对照组、mimic-NC组和miRNA-326 mimic细胞中cyclin D1的mRNA和蛋白表达情况,具体步骤参照2.2和2.6,其中,cyclin D1上游引物序列为5’-CCCACTCCTACGATACGC-3’,下游引物序列为5’-AGCCTCCCAAACACCC-3’;内参照β-actin的上游引物序列为5’-GGCGGCAACACCATGTACCCT-3’,下游引物序列为5’-AGGGGCCGGACTCGTCATACT-3’。构建野生型pmiR-CCND1-WT和突变型pmiR-CCND1-Mut的CCND1 3’-UTR萤光素酶报告载体。按照野生型+miRNA-326 mi-mic、突变型+miRNA-326 mimic和mimic-NC+mi-RNA-326 mimic进行分组和转染BGC-823细胞,于孵箱中常规培养48 h后,收集细胞,按照双萤光素酶报告基因检测试剂盒使用步骤检测各组细胞的萤光素酶活性。
3 统计学处理
实验中数据以均数±标准差(mean±SD)表示,运用SPSS 22.0软件对数据进行2检验、单因素方差分析(one-way ANOVA)和t检验,以P<0.05为差异有统计学意义。
结 果
1 miRNA-326在胃癌组织中的表达及临床意义
与癌旁组织相比,miRNA-326在55例胃癌组织中的平均相对表达量明显下降(P<0.05),见图1。表1显示miRNA-326的表达水平与年龄和性别无关,但与肿瘤大小、淋巴结转移、分化程度及临床分期均有显著相关性(P<0.05)。从胃癌组织中miRNA-326的表达水平分析:肿瘤直径>5 cm 的低于肿瘤直径≤5 cm的(P<0.05),有淋巴结转移的低于无淋巴结转移的(P<0.05),分化程度高的低于分化程度低的(P<0.05),临床分期Ⅲ~Ⅳ期的低于Ⅰ~Ⅱ期的(P<0.05)。进一步回顾分析和跟踪随访,发现miRNA-326表达水平与患者的总生存期存在相关性,miRNA-326低表达的患者生存率明显低于miRNA-326高表达患者(P<0.05),见图2。

Figure 1. The expression of miRNA-326 in the gastric cancer and paracancerous tissues. Mean±SD. n=55. *P<0.05.

表1 miRNA-326的表达与55例胃癌患者临床特征的关系

Figure 2.The correlation between miRNA-326 expression and total survival of gastric cancer patients. Mean±SD. *P<0.05 vs high expression of miRNA-326.
2 转染miRNA-326 mimic 后胃癌BGC-823细胞中miRNA-326表达水平升高
以BGC-823细胞为例,先确认miRNA-326在胃癌BGC-823细胞的低表达后,转染miRNA-326 mimic,以构建miRNA-326高表达的胃癌细胞株,RT-qPCR检测发现,胃癌BGC-823细胞中miRNA-326的相对表达水平明显低于正常胃黏膜GES-1细胞(P<0.05);同时,正常对照组与mimic-NC组相比miRNA-326表达差异无统计学显著性,但miRNA-326 mimic组的miRNA-326的表达水平与正常对照组和mimic-NC组相比显著升高(P<0.05),见图3。
3 上调miRNA-326表达抑制BGC-823细胞的活力
CCK-8法检测发现,转染miRNA-326 mimic后,BGC-823细胞在24、48和72 h的吸光度(A)值均明显低于正常对照组(P<0.05),而mimic-NC组与正常对照组间的差异无统计学显著性,见表2。Wes-tern blot进一步检测各组细胞中增殖相关蛋白MMP-9和p21的表达,发现与正常对照组比较,miRNA-326 mimic组中MMP-9的表达水平明显降低,p21表达水平明显升高(P<0.05);mimic-NC组中2种蛋白的表达水平与正常对照组比较差异无统计学显著性,见图4。
4 上调miRNA-326表达促进BGC-823细胞凋亡
流式细胞术和Western blot检测正常对照组、mimic-NC组和miRNA-326 mimic组细胞周期变化、凋亡率和相关蛋白的表达情况。与正常对照组相比,miRNA-326 mimic组细胞在G1期的百分比和凋亡率均明显升高,而细胞在G2期的百分比及Bcl-2蛋白水平均降低,cleaved caspase-3蛋白水平升高(P<0.05);而mimic-NC组细胞周期、凋亡率、Bcl-2蛋白表达水平和cleaved caspase-3蛋白表达水平差异均无统计学显著性,见图5、6。

Figure 3.The expression of miRNA-326 in normal gastric mucosa GES-1 cells and gastric cancer BGC-823 cells (A) and the expression of miRNA-326 in BGC-823 cells of each group after transfection (B). Mean±SD. n=3. *P<0.05 vs GES-1 cells; △P<0.05 vs normal control group; #P<0.05 vs mimic-NC group.

表2 各组BGC-823细胞不同时点A值的变化
*P<0.05vsnormal control group;#P<0.05vsmimic-NC group.

Figure 4.The protein expression of MMP-9 and p21 in the BGC-823 cells in each group. Mean±SD. n=3. * P<0.05 vs normal control group; # P<0.05 vs mimic-NC group.
5 CCND1是miRNA-326的靶基因
RT-qPCR和Westerm blot检测结果示,与正常对照组和mimic-NC组相比,miRNA-326 mimic组细胞中cyclin D1的mRNA和蛋白表达量显著降低(P<0.05),见图7A、B;双萤光素酶报告基因检测结果显示,与mimic-NC+miRNA-326 mimic组相比,转染pmiR-CCND1-WT质粒细胞的萤光素酶活性降低(P<0.05),而转染pmiR-CCND1-Mut质粒的萤光素酶活性无显著改变,见图7C。
讨 论
miRNA-326在多种疾病中异常表达,可通过多种途径参与细胞的增殖和凋亡过程,影响疾病的进程。miRNA-326在类风湿关节炎患者的外周血单个核细胞和血浆中异常高表达,与类风湿关节炎活动度关系密切[11];而其在脑胶质瘤组织中的表达水平显著低于正常脑组织,与晚期病理分级和KPS评分等有关。目前,miRNA-326在胃癌中的研究较少,其作用机制并不清晰。为了探讨miRNA-326在胃癌中的作用机制,本研究先通过观察55例胃癌组织中miRNA-326中的表达情况,结果发现,miRNA-326在胃癌组织中的表达明显低于癌旁组织。该结果与张小静等[12]发现miRNA-326在高转移胃癌细胞中表达下调的结果相一致。进一步观察miRNA-326与临床病理特征的关系,发现其表达与肿瘤直径>5 cm、有淋巴结转移、高分化程度以及Ⅲ~Ⅳ期临床分期均有显著相关性,而与患者的年龄和性别无关;同时还发现,miRNA-326低表达的患者生存率明显小于miRNA-326高表达患者,提示miRNA-326可能在胃癌的发生发展过程中发挥着重要作用。

Figure 5.The changes of cell cycle distribution in each group were analyzed by flow cytometry. Mean±SD. n=3. * P<0.05 vs normal control group; # P<0.05 vs mimic-NC group.
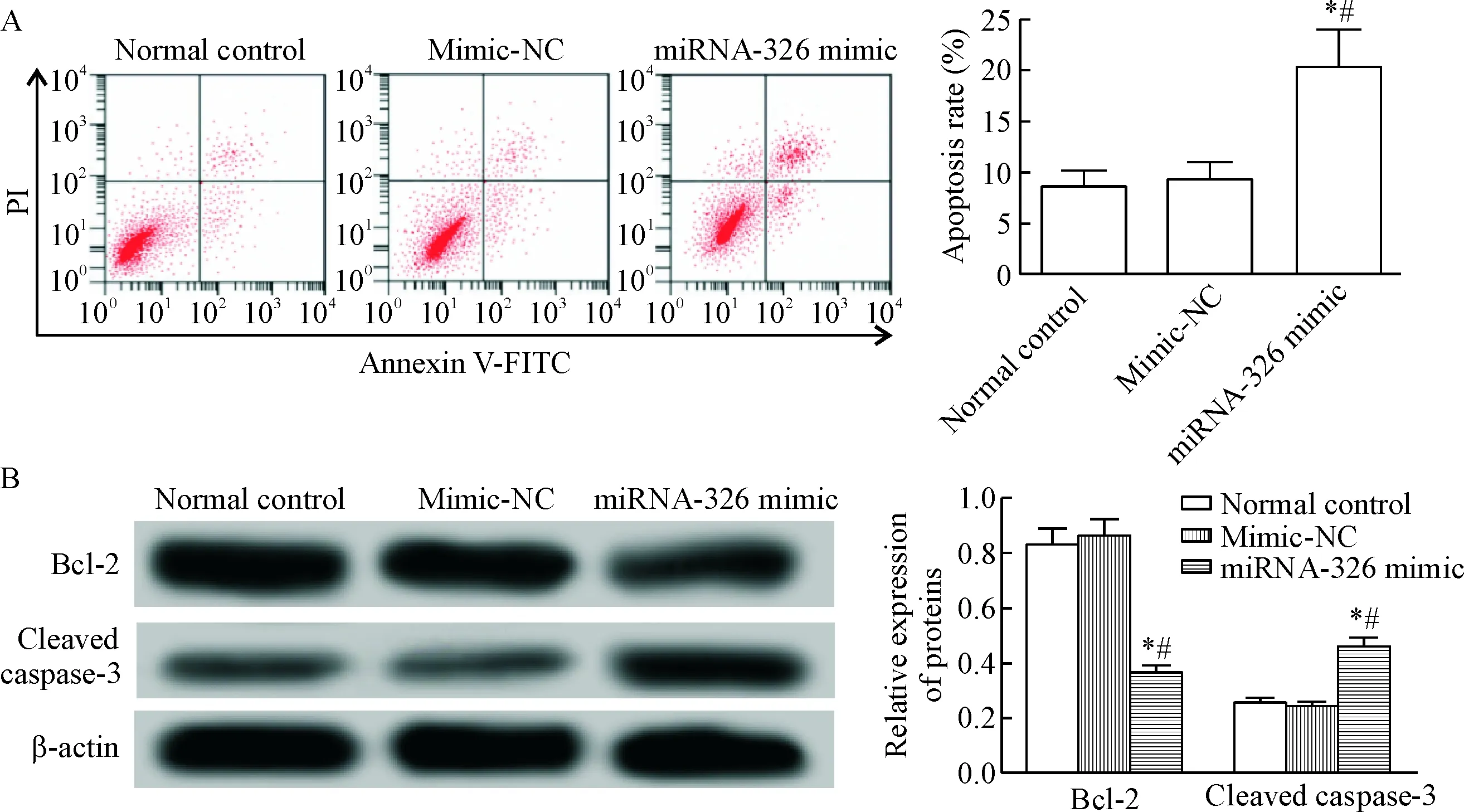
Figure 6.Apoptosis of BGC-823 cells and the protein levels of apoptosis-related proteins Bcl-2 and cleaved caspase-3 in each group. A: the results of flow cytometry analysis; B: the results of Western blot for determining the relative protein levels. Mean±SD. n=3. *P<0.05 vs normal control group; # P<0.05 vs mimic-NC group.
细胞的恶性增殖是肿瘤发生的重要机制之一,受细胞周期相关基因的调控,cyclin D1是细胞从G1期进入S期的重要正向调控基因,可调控G1/S进程;p21是细胞周期蛋白依赖激酶的直接抑制因子,抑制cyclin D1-CDK4复合物的活性,使细胞周期停滞在G1期;两者的异常表达均与胃癌的发生发展密切相关[13-14]。大量研究显示,miRNA-326在肿瘤细胞的增殖、侵袭和凋亡等过程中发挥着重要的调控作用[15-16]。本研究在成功上调胃癌BGC-823细胞中miRNA-326的表达后,采用CCK-8法检测细胞的活力,并进一步检测细胞中p21和cyclin D1的表达,结果显示转染miRNA-326 mimic的细胞活力下降,细胞中cyclin D1表达水平下降,而p21表达升高。这一结果可能与Zhou等[17]所报道的通过上调miRNA-326诱导胶质瘤细胞G1期阻滞的内在机制有关。同时,肿瘤细胞的侵袭和转移也在肿瘤的生长中发挥着重要作用。MMP-9是一种与肿瘤细胞分化、侵袭和转移密切相关的基质金属蛋白酶,可通过降解基底膜,影响新血管的生成和血管内皮细胞的迁移,进而影响肿瘤的生长。MMP-9与胃癌浸润深度、淋巴结转移及TNM分期均有关[18]。本研究进一步检测发现,转染miRNA-326 mimic的细胞中MMP-9表达水平明显降低,提示在胃癌中,低表达miRNA-326可能通过上调MMP-9表达促进胃癌细胞的侵袭和转移,进而促进肿瘤的生长。

Figure 7.The expression of cyclin D1 at mRNA and protein levels in the BGC-823 cells of each group and the identification of miRNA-326 target gene by determining the luciferase activity. A: the relative mRNA expression of cyclin D1; B: the Western blot detection of cyclin D1 protein expression; C: the luciferase activity. Mean±SD. n=3. * P<0.05 vs normal control group; # P<0.05 vs mimic-NC group; &P<0.05 vs mimics-NC+miRNA-326 mimic group; △P<0.05 vs Mut+miRNA-326 mimic group.
肿瘤细胞的恶性增殖又往往是细胞凋亡受抑的结果。Bcl-2是公认的抗凋亡蛋白,caspase-3是重要的凋亡执行蛋白,两者均在胃癌的发生发展中具有重要作用[19-20]。本研究通过流式细胞仪检测转染miRNA-326 mimic后,BGC-823细胞的凋亡情况,并检测Bcl-2和cleaved caspase-3蛋白的表达以评估细胞凋亡。结果发现,miRNA-326 mimic组细胞的凋亡率较正常对照组明显升高,并且Bcl-2蛋白表达下降,而cleaved caspase-3表达升高。提示,在胃癌的发生发展中,低表达miRNA-326可能通过上调Bcl-2和下调cleaved caspase-3 表达抑制胃癌细胞凋亡。查阅文献发现,Sun等[21]在非小细胞肺癌中指出CCND1是miRNA-326的靶基因。本研究结果也发现,miRNA-326从蛋白水平和mRNA水平均对cyclin D1有明显的调控作用。为了探讨在胃癌中,CCND1是否也是miRNA-326的靶基因,本研究采用双萤光素酶报告基因检测的方法进行确认。结果发现,在转染pmiR-CCND1-WT质粒的细胞中萤光素酶活性降低,而转染pmiR-CCND1-Mut质粒的萤光素酶活性无显著改变。因此,认为miRNA-326在胃癌的发生发展过程中,可能通过靶向CCND1而调控肿瘤细胞的生长。
综上所述,miRNA-326在胃癌中低表达,可能通过靶向调控CCND1而促进细胞增殖,抑制细胞凋亡。该实验结果进一步丰富了miRNA-326在胃癌发生和发展中的作用机制,为胃癌以miRNA-326为靶点的诊断和治疗提供了新的参考依据。
