Ang(1-7)减轻棕榈酸诱导的Min6细胞损伤*
2018-11-26陆春丽胡东辉褚加成周夏利陈巍巍孙明谨
陆春丽, 胡东辉, 褚加成, 周夏利, 陈巍巍, 孙明谨
(湖北医药学院附属随州医院内分泌科, 湖北 随州 441300)
胰腺局部肾素-血管紧张素系统(renin-angiotensin system,RAS)的活性对胰岛β细胞的存活与正常功能的维持有重要的调控作用,而维持其功能的正常有赖于RAS内2条通路的自稳平衡。本课题组前期研究发现在糖尿病前期及糖尿病期的动物模型中,胰腺局部RAS系统的血管紧张素转换酶(angiotensin-converting enzyme,ACE)-血管紧张素II(angiotensin II,Ang II)-血管紧张素II 1型受体(angiotensin II type 1 receptors,AT1R) 及ACE2-Ang(1-7)-Mas轴失衡,参与了胰岛局部的炎症、氧化应激和凋亡反应[1-3]; 敲除小鼠ACE2基因加重了长期高脂饮食喂养诱导的糖耐量减低,增加了胰岛β细胞功能损害[2],但其涉及机制尚待进一步研究。本研究拟探讨Ang(1-7)对棕榈酸(palmitic acid,PA)培养的小鼠胰岛β细胞的影响及其相关机制,为糖尿病的早期防治和β细胞功能的保护提供新思路。
材 料 和 方 法
1 主要材料
小鼠胰岛β细胞(Min6细胞)购自中南大学湘雅中心实验室。细胞培养基和胎牛血清均购自Gibco;雷帕霉素(rapamycin,Rap)购自Sigma;活性氧簇(reactive oxygen species,ROS)检测试剂盒购自碧云天公司;Ang(1-7)和 A779均购自上海吉尔生化有限公司;小鼠胰岛素ELISA试剂盒购自Cusabio;抗GAPDH和微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)抗体购自Abcam。
2 方法
2.1细胞培养 Min6细胞于含12%胎牛血清的培养基中,置于37 ℃、5% CO2条件的细胞培养箱中培养。每2 d换液1次,细胞融合至80%时用0.25%胰酶消化传代。
2.2棕榈酸的配制 将棕榈酸溶于浓度为100 mmol/L的NaOH中,用不含脂肪酸的BSA溶液调节至10 mmol/L,过滤并加入到无血清培养基中以达到0.5 mmol/L棕榈酸/1% BSA的终浓度。
2.3细胞干预 将对数生长期细胞按每孔1×106的密度接种至6孔板,随机分为:(1)对照(control)组:加入生理盐水;(2)PA组:0.5 mmol/L棕榈酸干预48 h;(3)PA+Ang(1-7)组: 10-8mmol/L Ang(1-7)+0.5 mmol/L棕榈酸;(4)PA+Ang(1-7)+A779组:10-8mmol/L Ang(1-7)+0.5 mmol/L棕榈酸+10-6mmol/L A779;(5)PA+Ang(1-7)+Rap组: 10-8mmol/L Ang(1-7)+0.5 mmol/L棕榈酸+5 μmol/L rapamycin;(6)Ang(1-7)组:10-8mmol/L Ang(1-7);(7)A779组:10-6mmol/L A779。细胞贴壁后更换培养基,按分组分别给予不同干预,干预完成后收集细胞培养上清和细胞待测。
2.4葡萄糖刺激的胰岛素释放实验 收集经过不同处理后的Min6细胞,用不含糖的KRBH缓冲液于37 ℃孵育30 min后去上清;再分别加入0.5 mL含2.8 mmol/L和16.7 mmol/L葡萄糖的KRBH液于37 ℃孵育1 h,取上清离心按试剂盒说明书检测胰岛素。
2.5ROS水平的检测 收集经过不同处理后Min6细胞,按试剂盒说明书操作,使用荧光酶标仪检测ROS水平。
2.6流式细胞术检测细胞凋亡 0.25%的胰酶消化细胞后,收集培养基内及消化后脱落的细胞于10 mL的离心管内,PBS冲洗2次。弃去上清,PBS重悬细胞沉淀,300×g离心5 min,重复3次。收集细胞沉淀,加入Binding Buffer 300 μL,重悬细胞,加入5 μL Annexin V-FITC,混匀后避光孵育10 min,加入5 μL PI,混匀后避光孵育5 min后上流式细胞仪检测。
2.7Western blot实验 取处理完成的细胞用TBS缓冲液润洗3次,加入RIPA裂解液裂解3~5 min。用细胞刮刀将细胞及试剂刮下,收集至离心管中。冰浴30 min。4 ℃、13 000×g离心5 min,收集上清,即为总蛋白溶液。BCA蛋白质浓度测定试剂盒测定样品蛋白浓度。SDS-PAGE电泳,每孔上样40 μg蛋白,后转膜、封闭,分别加入 I 抗和II抗孵育后,显影、定影并分析目标带的吸光度(A)值。
3 统计学分析
所有数据用SPSS 16.0软件进行统计分析。计量数据以均数±标准差(mean±SD)表示,多个样本的均数比较采用单因素方差分析。以P<0.05 为差异有统计学意义。
结 果
1 各组Min6细胞分泌功能的变化
与对照组相比,棕榈酸培养后Min6细胞基础胰岛素分泌均升高(P<0.05),而葡萄糖刺激后胰岛素分泌均显著降低(P<0.05)。与棕榈酸干预组相比,棕榈酸培养的Min6细胞同时给予Ang(1-7)干预后,Min6细胞基础胰岛素分泌无明显改变,但葡萄糖刺激后胰岛素分泌明显增加(P<0.05),PA+Ang(1-7)+A779组葡萄糖刺激后胰岛素分泌与PA+Ang(1-7)组比较差异无统计学显著性,PA+Ang(1-7)+Rap组葡萄糖刺激后胰岛素分泌较PA+Ang(1-7)组明显减少(P<0.05)。Ang(1-7)组和A779组的基础胰岛素分泌和葡萄糖刺激后胰岛素分泌与control组比较差异均无统计学显著性,见图1。
2 各组Min6细胞凋亡的改变
为了研究Ang(1-7)对棕榈酸诱导的Min6细胞存活状态的影响,我们检测了各组Min6细胞的凋亡水平。结果显示,与control组相比,PA组的Min6细胞凋亡率明显增加(P<0.05);而PA+Ang(1-7)组的凋亡率较PA组显著减少(P<0.05);而加入A779后,Ang(1-7)改善棕榈酸诱导Min6细胞凋亡的作用被阻断。Ang(1-7)组和A779组的Min6细胞凋亡与control组比较差异无统计学显著性,见图2。
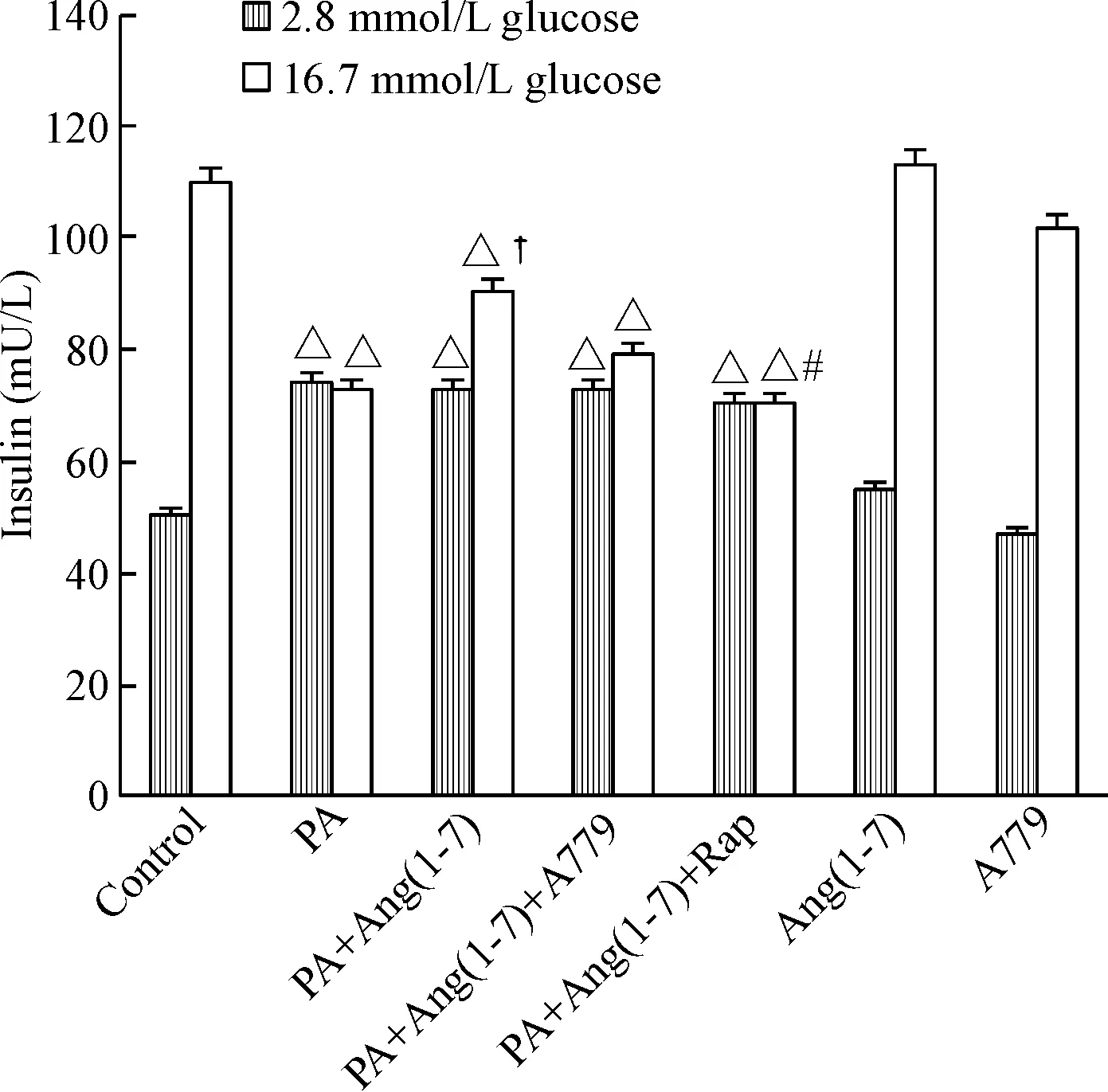
Figure 1.The comparison of secretion function in each group. Mean±SD. n=3. △P<0.05 vs control group; †P<0.05 vs PA group; #P<0.05 vs PA+Ang(1-7) group.
为进一步验证Ang(1-7)对棕榈酸培养的Min6细胞的保护作用是否通过抑制自噬活性介导,PA+Ang(1-7)+Rap组在给予Ang(1-7)干预同时加入自噬诱导剂rapamycin,结果显示,PA+Ang(1-7)+Rap组的Min6细胞凋亡较PA+Ang(1-7)组明显增多(P<0.05),提示Ang(1-7)可明显减弱棕榈酸诱导的Min6细胞凋亡,rapamycin可部分削弱Ang(1-7)对Min6细胞这一保护作用,见图2。
3 Ang(1-7)抑制棕榈酸诱导的Min6细胞氧化应激反应
与control相比,棕榈酸干预后PA组的Min6细胞内ROS水平显著升高(P<0.05),提示氧化应激水平明显增加;而PA+Ang(1-7)组的Min6细胞内ROS水平较PA组显著降低(P<0.05),提示Ang(1-7)减轻了棕榈酸诱导的氧化应激反应。PA+Ang(1-7)+Rap组的ROS水平较PA+Ang(1-7)组亦显著升高(P<0.05),提示Ang(1-7)抑制Min6细胞中棕榈酸诱导的氧化应激作用部分可被rapamycin阻断,见图3。

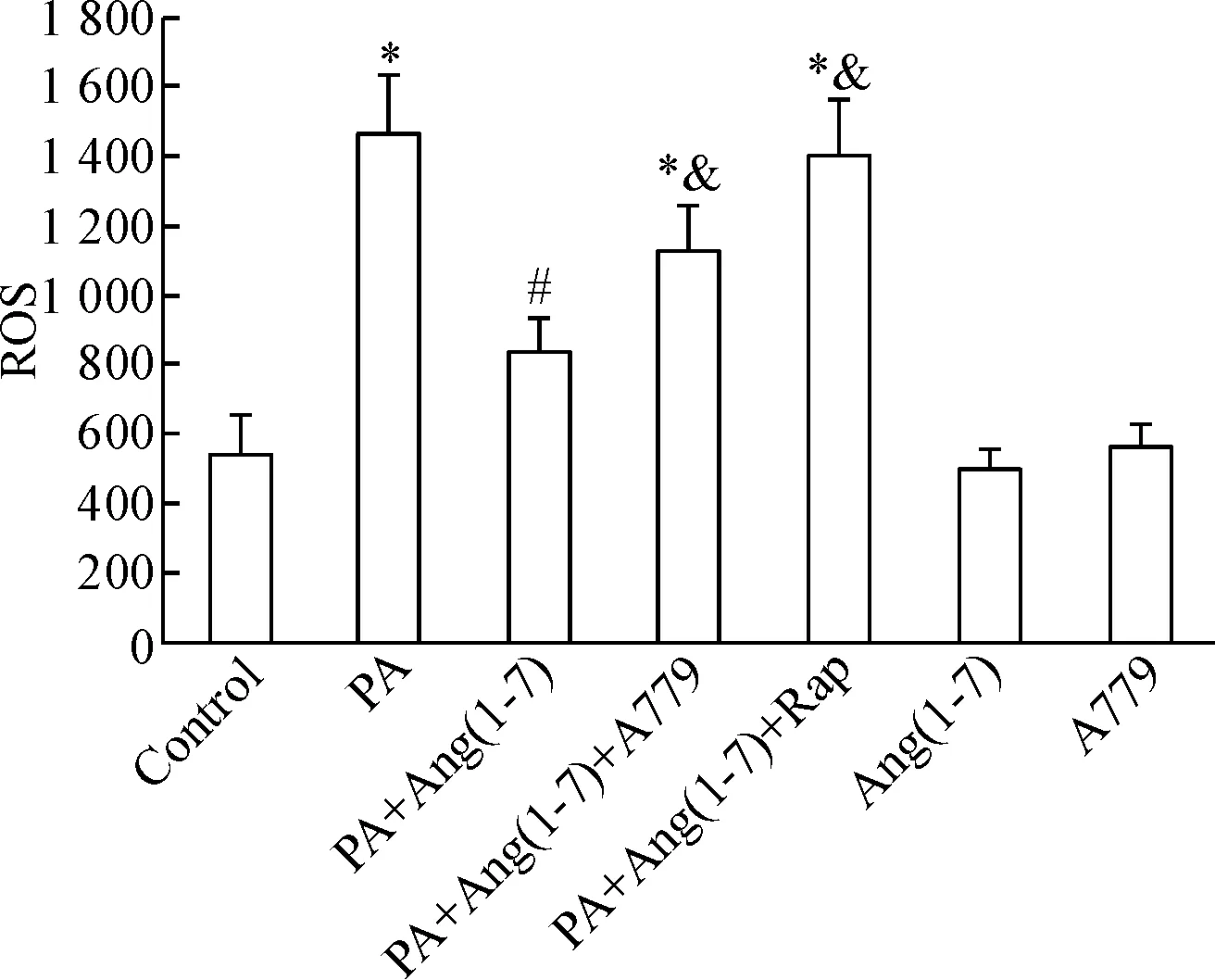
Figure 3.The comparison of ROS in different groups. Mean±SD.n=4.*P<0.05vscontrol group;#P<0.05vsPA group;&P<0.05vsPA+Ang(1-7) group.
图3各组细胞ROS水平的比较
4 Ang(1-7)抑制Min6细胞中棕榈酸诱导的自噬
与control组相比,PA组Min6细胞的LC3-II/LC3-I比值显著升高(P<0.05),提示棕榈酸干预引起Min6细胞自噬活性增强;PA+Ang(1-7)组的LC3-II/LC3-I较PA组明显降低(P<0.05),提示Ang(1-7)抑制了棕榈酸诱导的自噬活性;PA+Ang(1-7)+Rap组的LC3-II/LC3-I较PA+Ang(1-7)组明显升高(P<0.05),提示rapamycin可明显削弱Ang(1-7)对棕榈酸诱导的自噬相关蛋白表达的影响,见图4。

Figure 4.The comparison of LC3-II/LC3-I ratio in each group. Mean±SD. n=7. *P<0.05 vs control group; #P<0.05 vs PA group; &P<0.05 vs PA+Ang(1-7) group.
5 Mas受体拮抗剂对Ang(1-7)介导的Min6细胞保护作用及自噬活性的影响
为检测Ang(1-7)对棕榈酸培养的Min6细胞的保护作用是否通过G蛋白偶联受体Mas介导,我们同时给予选择性Mas受体拮抗剂A779干预,结果表明A779阻滞了Ang(1-7)对棕榈酸诱导的Min6细胞的有益作用及对自噬活性的影响,见图1~4。
讨 论
Ang(1-7)是ACE2-Ang(1-7)-Mas轴的主要活性成分,是ACE2水解Ang I和Ang II的主要产物,通过与特异性受体Mas结合,在体内外起到拮抗AngⅡ活性的作用[4]。最新研究表明,Ang(1-7)可减少H2O2诱导的INS-1细胞的ROS生成,增加线粒体膜电位和葡萄糖刺激的钙水平,减轻H2O2诱导的INS-1细胞的氧化应激反应[5];并在体内外均有改善小鼠胰岛胰岛素分泌的作用[6]。本课题组的前期研究也发现,通过基因敲除手段下调ACE2-Ang(1-7)-Mas活性后,加重了高脂饮食诱导的胰岛功能损害及胰岛局部炎症和氧化应激反应[3],但其涉及的具体机制尚不明确。本研究结果显示,棕榈酸干预可明显诱导Min6细胞功能损伤,细胞内ROS水平升高,氧化应激反应增强;经Ang(1-7)干预后可明显降低ROS水平,并有效改善Min6细胞分泌功能及存活状态,提示Ang(1-7)可能通过减少细胞内ROS形成而发挥抗棕榈酸诱导的Min6细胞损伤作用。
近年来,自噬被认为是调节β细胞功能和死亡的新机制。自噬为细胞的一种自我保护机制,可清除胞内受损线粒体和异常折叠的蛋白质,对于维持β细胞数量和功能、防止细胞凋亡、调节胰岛素分泌起重要作用[7]。在应激情况下,自噬被过度激活则会加速β细胞死亡。从2型糖尿病的患者胰腺中分离出来的胰岛内自噬活性受损,自噬泡和自噬体的密度体积显著高于正常的β细胞[8]。
在氧化应激状态下,ROS升高可通过多种分子信号通路诱导自噬发生,而自噬激活后也可通过清除被ROS损伤的细胞器或蛋白质等途径来降低ROS对细胞的毒性作用[9]。ROS介导的细胞自噬活性增强并不是持续发挥积极作用,当ROS水平超出自噬范围,自噬会被过度激活,诱导细胞进入自噬性细胞死亡[10]。从本研究结果分析,在经Ang(1-7)干预后,棕榈酸诱导的Min6细胞分泌功能受损明显改善,凋亡减少,细胞内ROS水平降低,自噬相关蛋白表达下降,推测Ang(1-7)可能通过减少ROS形成,抑制ROS诱导的过度自噬,从而减少过度自噬带来的不良后果。
为进一步验证Ang(1-7)对Min6细胞保护作用与自噬活性关系,我们运用自噬诱导剂rapamycin干预发现,rapamycin可明显削弱Ang(1-7)对棕榈酸损伤Min6细胞的保护作用,并有效地干扰了Ang(1-7)对自噬相关蛋白表达的影响。由此我们推测在棕榈酸干预下,Ang(1-7)对Min6细胞的保护作用与自噬活性抑制存在一定关联。
综上所述,我们的研究首次报道Ang(1-7)对棕榈酸损伤的Min6细胞具有保护作用,其保护机制可能部分通过抑制ROS介导的自噬活性来实现。这为以ACE2-Ang(1-7)-Mas轴介导的胰岛β细胞自噬作用为干预靶点保护β细胞功能提供新的理论依据。
