大鼠急性心肌梗死后NLRP3炎性体-IL-1β信号轴激活与End-MT的关系*
2018-11-26汤石林刘一剑彭良善赵正亮谭一清王桥生
汤石林, 刘一剑, 彭良善, 赵正亮, 谭一清, 王桥生
(1南华大学附属第一医院重症医学科, 湖南 衡阳 421001; 2长沙市第三医院心内科, 湖南 长沙 410015)
急性心肌梗死(acute myocardial infarction,AMI)是指在冠状动脉发生病理性变化基础上所引发的冠脉血流急剧减少,从而导致心肌局部持续性缺血坏死,作为心血管领域常见的危重急症之一,严重威胁人类健康。目前,随着冠脉介入、溶栓及搭桥等技术及药物治疗的不断完善,AMI的猝死风险显著降低,但其引发的心力衰竭(heart failure,HF)仍无有效治疗手段。心肌纤维化作为HF晚期病变的共同特征,对其发生机制的深入探讨,将有效改善AMI后HF进程。
核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎性体(inflammasome)作为细胞内模式识别受体的重要组成部分,由NLRP3、接头蛋白 ASC (apoptosis-associated speck-like protein containing a caspase activation and recruitment domain)和pro-caspase-1组成,可被多种内源性和外源性物质激活,包括微生物成分及晶体物质如胆固醇晶体、单钠尿酸盐(monosodium urate,MSU)晶体、硅石等[1],其激活后促进pro-caspase-1的自我剪切,形成具有活性的caspase-1,活化的caspase-1进一步促进白细胞介素1β前体(pro-interleukin-1β,pro-IL-1β)和白细胞介素18前体(pro-IL-18)水解为成熟的IL-1β和IL-18,从而发挥其对细胞功能的调控,在机体固有免疫系统发挥重要的调节作用[2]。近来研究发现,NLRP3炎性体介导的炎症反应在AMI引发的心肌纤维化过程中发挥重要的调节作用[3],但其具体机制仍有待进一步研究。
内皮-间充质转化(endothelial-mesenchymal transition,End-MT)是指内皮细胞在受到多种因素的作用下逐步失去其形态和功能,并获得间充质细胞或肌成纤维细胞表型的生物学过程[4]。在AMI大鼠模型中,抑制End-MT过程,心肌纤维化程度得到明显改善[5],提示End-MT可调节AMI后心肌纤维化的发生发展。研究发现IL-1β作为机体内炎症级联反应的起始因子,在细胞水平促进成纤维细胞生长因子2的持续性产生与激活,后者通过触发细胞内的相关信号通路,促进End-MT[6-7]。然而,在AMI后心肌纤维化过程中,NLRP3炎性体作为IL-1β的主要来源,其持续性激活与End-MT的发生发展是否存在同一性尚未明确。本研究拟在动物水平探讨AMI后心肌纤维化过程中NLRP3炎性体-IL-1β信号轴和End-MT之间的关系,为进一步改善 AMI后心肌纤维化及HF的发生发展提供新的研究思路及治疗靶点。
材 料 和 方 法
1 材料与试剂
10~12周龄雄性SD大鼠购自南华大学医用动物实验中心;羊抗大鼠ASC多克隆抗体和大鼠IL-1β ELISA试剂盒购自Sigma;小鼠抗大鼠CD31单克隆抗体、兔抗大鼠NLRP3多克隆抗体及兔抗大鼠caspase-1多克隆抗体购自Abcam;兔抗大鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和成纤维细胞特异性蛋白1(fibroblast-specific protein 1,FSP1)多克隆抗体购自北京博奥森公司;小鼠抗大鼠GAPDH 单克隆抗体购自爱必信(上海)生物科技有限公司;其它试剂均为进口或国产分析纯。
2 方法
2.1动物模型的构建 30只SD大鼠随机分为假手术对照(sham)组及急性心肌梗死(AMI)组(n=15)。急性心肌梗死组大鼠空腹12 h,称重,固定,备皮,腹腔注射2%戊巴比妥钠(40 mg/kg)麻醉。调整呼吸机参数(呼吸频率45次/分,呼吸比1 ∶1),测试大鼠疼痛反应,深度麻醉后行气管插管。插管成功后,切开大鼠腹部皮肤(剑突下至左侧腋下),钝性分离肌肉及肋间肌,暴露心脏,可见心脏搏动,利用手术镊缓慢分离心包膜,暴露心前壁,穿线结扎冠脉左前降支。结扎后肉眼可见心率减慢,结扎区域因缺血呈现苍白色。假手术组按上述手术步骤进行至前降支穿线,不结扎。依次缝合肋间切口、肌肉及皮肤。术后3 d连续肌肉注射青霉素预防感染。
2.2动物取材 28 d后,大鼠空腹12 h,称重,固定,备皮,腹腔注射2%戊巴比妥钠(40 mg/kg)麻醉。深度麻醉后,切开大鼠腹部皮肤,钝性分离肌肉及肋间肌,暴露心脏,将心脏取出并用生理盐水(4 ℃)反复冲洗,直至无积血流出,分离梗死区域,取出一部分进行蛋白提取,剩余部分固定于4%甲醛溶液,行石蜡包埋,切片。
2.3Masson染色 将心肌切片常规脱蜡至水,Weigert苏木素染液染核10 min;蒸馏水充分水洗3次,每次5 min,镜下观察(如过染,用盐酸乙醇分化);丽春红染液染色10 min;2%冰醋酸水溶液冲洗2 min;1%磷钼酸水溶液分化2 min;苯胺蓝染色液中染色3 min,2%冰醋酸水溶液冲洗2 min;脱水透明,中性树胶封片,镜下观察,拍照。
2.4Western blot实验 将收集好的组织裂解;用BCA蛋白定量试剂盒进行蛋白定量;加入SDS-PAGE(5×)蛋白上样缓冲液,沸水煮5~8 min,冷却, -20 ℃保存备用。进行SDS-PAGE(80 V, 30 min; 120 V, 90 min);转膜(200 mA, 2 h);TBST 封闭液(5%脱脂奶粉)封闭2 h;按比例用TBST配制抗NLRP3、ASC、caspase-1、α-SMA和GAPDH抗体,4 ℃孵育过夜;TBST洗3次,每次10 min;加入相对应的辣根过氧化物酶标记的 II 抗,室温孵育2 h,TBST 洗3次,每次10 min;免疫印迹荧光检测试剂盒显影检测,采用自动化学发光系统拍摄分析。
2.5ELISA实验 收集组织样品,按试剂盒提供的方法,在含有IL-1β抗体的微孔板中加入100 μL待测样品及标准品,室温孵育2 h;倾除板孔内液体,洗板3次;加入100 μL生物素标记抗体,室温孵育2 h;倾除板孔内液体,洗板3次;加入HRP标记的 II 抗,室温孵育30 min,倾除板孔内液体,洗板3次;加入显色剂,室温孵育15~20 min,终止反应后,测定450 nm处的吸光度(A)值,计算IL-1β浓度。
3 统计学处理
以GraphPad Prism 6.0 软件进行统计分析。所有实验数据均采用均数±标准差(mean±SD)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1 AMI促进心肌纤维化
为进一步验证AMI对心肌纤维化的影响,采用Masson染色检测心肌纤维化水平。结果显示,AMI组心肌纤维化水平明显增加(P<0.05),见图1。

Figure 1. AMI aggravated myocardial fibrosis. Myocardial fibrosis was detected by Masson staining. Mean±SD. n=15. *P<0.05 vs sham group.
2 AMI促进心肌End-MT
Western blot结果显示,与假手术组相比,AMI显著下调内皮细胞标志物CD31和VE-Cadherin的表达,上调间充质细胞标志物α-SMA和FSP1的表达,见图2。
3 AMI后,NLRP3炎性体-IL-1β信号通路激活与End-MT具有同一性
28 d后采用Western blot检测受损心肌中NLRP3炎性体活性,ELISA检测IL-1β的表达。发现AMI组的NLRP3、ASC、pro-caspase-1、caspase-1及IL-1β的表达明显高于假手术组(P<0.05),提示在AMI大鼠心肌发生End-MT的同时,NLRP3炎性体-IL-1β信号途径被显著激活,两者进程具有同一性,见图3。
讨 论
AMI作为冠心病的严重类型,常伴有心律失常、HF和心源性休克等一系列并发症,具有较高的发生率及病死率,严重影响患者的生活质量[8]。AMI后,缺血坏死区域纤维化反应明显增加,并累及未受损区域,最终导致HF。我们研究发现,在AMI大鼠模型中,心肌纤维化程度明显增加。因此,控制和改善心肌纤维化进程成为治疗HF的关键靶点。
大量研究证实End-MT与心肌纤维化程度呈正相关,抑制End-MT可显著改善心肌纤维化进程[9-10]。Western blot结果显示,随着AMI大鼠心肌纤维化水平的提高,其内皮细胞正常表型逐渐丢失,并获得间充质细胞表型,End-MT进程加速,但在本研究中并未采用免疫组织化学染色的方法在组织中检测End-MT的变化,存在一定局限性。同时,AMI可导致局部炎症反应增加,持续性的炎症反应又可进一步促进End-MT的发生发展,加速心肌纤维化及HF进程[11]。在AMI大鼠EndMT进展过程中,我们发现NLRP3炎性体及其下游产物caspase-1和IL-1β的表达也被显著上调。NLRP3炎性体介导IL-1β的成熟与分泌作为启动细胞内炎症级联反应的重要环节,在调节AMI后心肌纤维化及重塑过程中发挥关键作用[12]。虽然在AMI 28 d后, NLRP3炎性体激活与EndMT进展具有同一性,其下游产物IL-1β又被证实参与了对End-MT调控因子的调节,但两者的相互作用方式仍有待进一步证实。
本实验研究结果表明在AMI后心肌纤维化过程中,NLRP3炎性体-IL-1β信号轴激活与End-MT的上调同时发生,两者之间的潜在作用将为AMI后HF的防治提供新靶点。
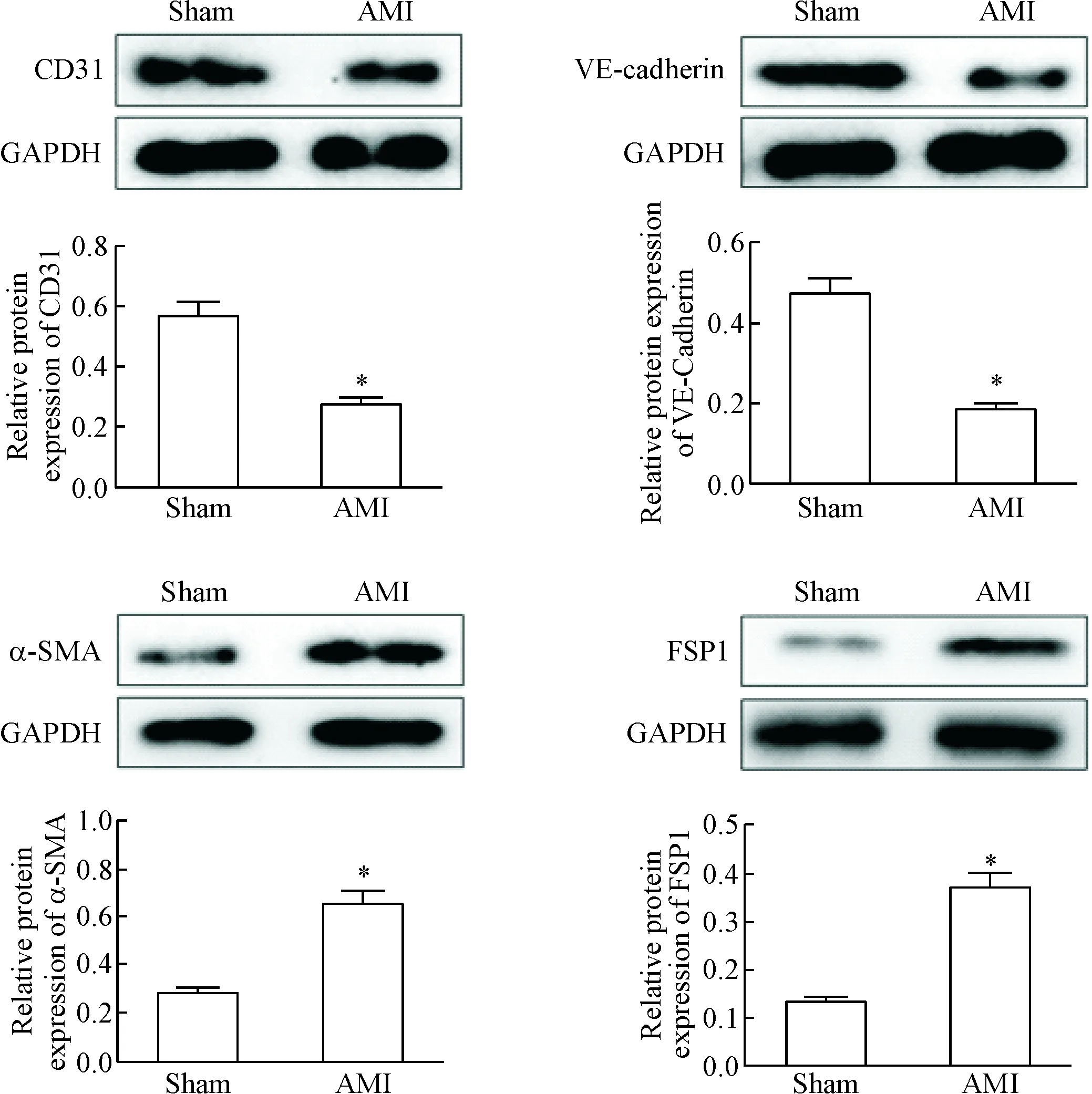
Figure 2.AMI promoted End-MT. The protein expression of CD31, VE-cadherin, α-SMA and FSP1 was determined by Western blot. Mean±SD. n=15. *P<0.05 vs sham group.
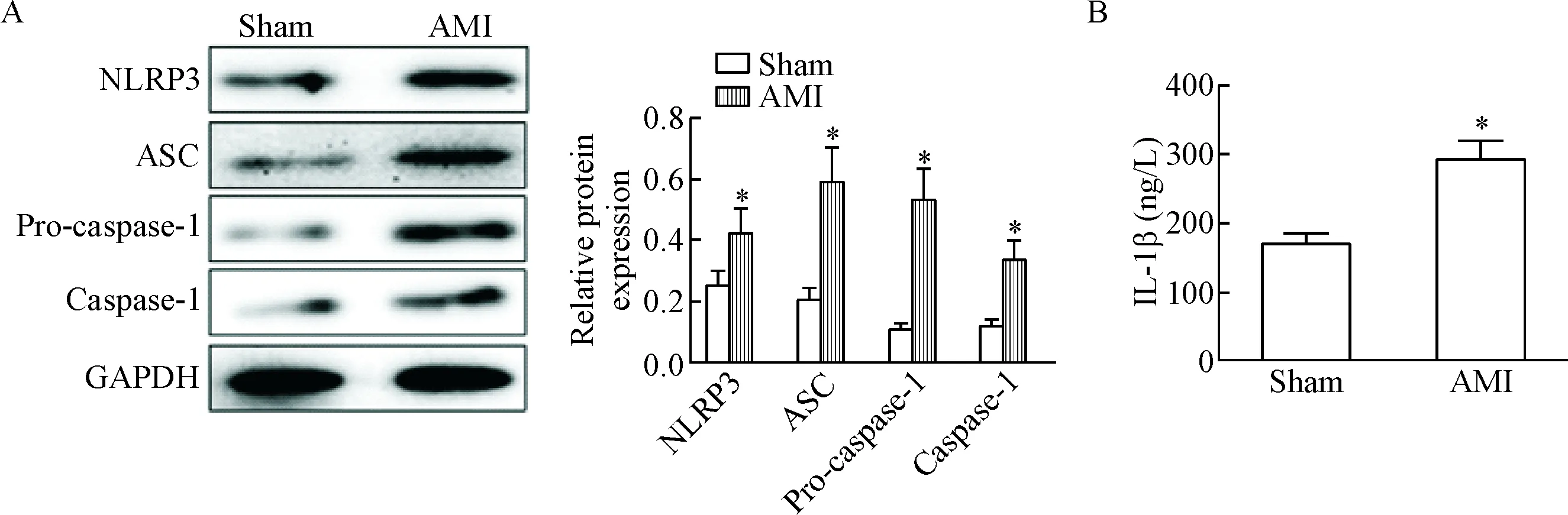
Figure 3.AMI activated NLRP3 inflammasome-IL-1β signaling axis. A: the results of Western blot for determining the protein expression of NLRP3, ASC, pro-caspase-1 and caspase-1; B: the level of IL-1β was measured by ELISA. Mean±SD. n=15. *P<0.05 vs sham group.
