叠氮化铵(NH4N3)的合成研究
2018-11-22刘玉存荆苏明王国栋申清芳
赵 帅,刘玉存,荆苏明,李 欣,王国栋,申清芳
叠氮化铵(NH4N3)的合成研究
赵 帅1,刘玉存1,荆苏明1,李 欣2,王国栋3,申清芳4
(1.中北大学环境与安全工程学院,山西 太原,030051;2.陕西应用物理化学研究所,陕西 西安,7100653;3.陆军工程大学石家庄校区,河北 石家庄,050003;4.航天科工集团第六研究院210所,陕西 西安,710065)
为获得高产率的叠氮化铵,并缩短反应时间以及保证实验安全性,提出以叠氮化钡和硫酸铵为原料,N,N-二甲基甲酰胺作为催化剂制备叠氮化铵的新方法。通过测定叠氮化铵在水中溶解性随温度的变化规律,并利用该特性以及硫酸钡在水中的不溶特点从反应体系中提取高纯度叠氮化铵产物。采用缓慢降温法培养叠氮化铵晶体,通过测定叠氮化铵晶体的分子结构以及晶胞堆积结构表征了产物。同时,对制备工艺进行优化,获得了最佳反应温度为85℃,反应时间为15min。
叠氮化铵;溶解度;晶体培养;晶胞结构;产气药
产气药已被广泛应用于汽车、军事航天、应急救援等领域[1]。早期的产气药多以NaN3为主,其具有高燃速、低燃温以及产气主要为清洁的N2的优点[2];但叠氮化钠具有吸湿、剧毒和固体残渣多等明显缺点。目前,新型产气药的研究以唑类和胍类为主[3-4],其优点在于固体残渣少,且产气清洁;但唑类和胍类均含有大量的C,单位质量摩尔产气率较低,且需氧量较大;同时吸湿性也使得其在应用过程中受到很大的影响。叠氮化铵作为目前含氮量(93%)最高的产气药,具有产气清洁、燃温低、燃速快和非吸湿性等优点,而且对人体的毒性较低,属于较为理想的产气药剂。目前国内外叠氮化铵的相关研究多停留在理论阶段,而叠氮化铵的制备是实际性能研究的基础,因此其制备研究具有重要的意义[5-10]。
目前,叠氮化铵的制备方式主要有以下几种:(1)以气态饱和氨和偶氮-苯甲酰胺基乙酰胺的酒精溶液,然后加入乙醚来沉淀出纯的叠氮化铵[5]。(2)催化法:以叠氮化钠和硫酸铵为原料,经二甲基酰胺催化,挥发冷凝法获得叠氮化铵,实验产率为30%~ 40%[6]。(3)高温升华冷凝法:将硝酸铵与叠氮化钠固体升温至200℃,叠氮化铵升华冷凝收集产物;产率约80%以上,产物纯度很高[7-9]。然而这几种方式弊端较为明显:第1种方法实验原料不容易获取,且产率较低。第2种方式提取叠氮化铵的方式效率较低,且整个实验过程时间较长。第3种方式反应温度过高,且产量较低,无法进行扩大试验。本实验以叠氮化钡和硫酸铵为原料,以N,N-二甲基甲酰胺溶剂(HCON(CH3)2)为催化剂,对实验进行改进,获得更高的产率。通过晶体培养并测定晶体的晶胞结构对其表征[11-12]。
1 实验与表征
1.1 试剂与仪器
试剂:硫酸铵,分析纯,天津市凯通化学试剂有限公司;叠氮化钡,分析纯,市售;N,N-二甲基甲酰胺,分析纯,天津市凯通化学试剂有限公司。
仪器:磁力搅拌恒温水浴锅;真空泵;恒温烘箱;自定控温水浴锅。
1.2 叠氮化铵的制备与表征
叠氮化铵制备的反应原理如图1所示。其制备过程为:取50mL N,N-二甲基甲酰胺(HCON(CH3)2)液体、22.1g(0.1mol)Ba(N3)2和13.2g (0.1mol) (NH4)2SO4,加入至250mL烧瓶中;加热至85℃并磁力搅拌,保温20min;取40mL去离子水加入反应容器,温度调节至65℃,保温15min;停止加热迅速滤出反应液,加入一定量乙醚液体,冷却至0℃,过滤出析出固体,并反复用乙醚冲洗,之后将产物放置于50℃恒温烘箱烘干,获得产物10.2g,产率85%。IR (KBr,/cm-1) : 3 440,2 025,1 635,1 377;对比文献[9]IR图谱,数据接近,可以初步认定产物正确。
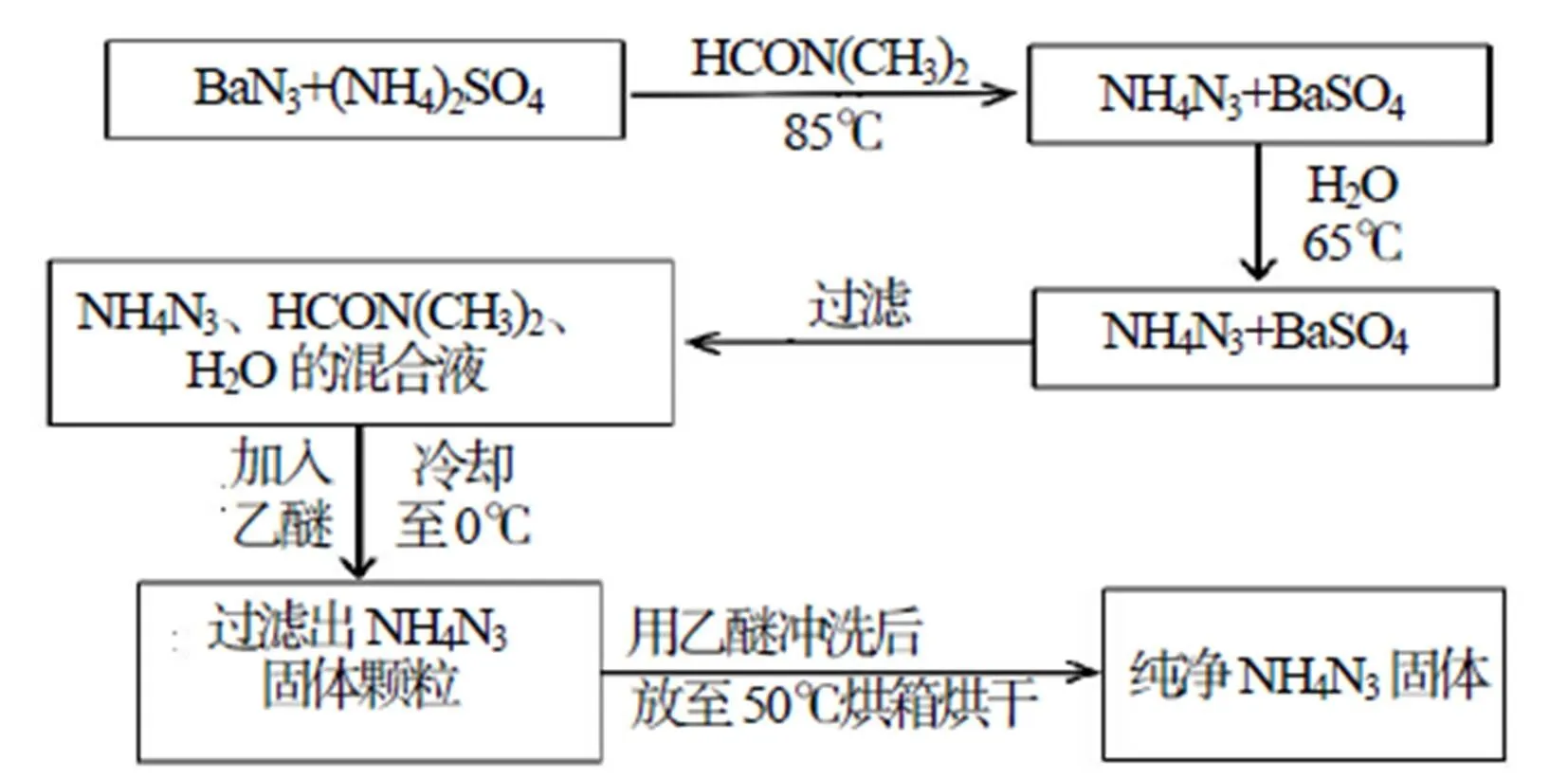
图1 反应流程图
1.3 溶解度测定
本研究通过升温-降温的方法测定叠氮化铵的溶解度曲线,其实验过程为:取去离子水40mL至100mL广口烧瓶中,将烧瓶放置磁力搅拌恒温水浴锅中磁力搅拌,转速为200r/min;取8g NH4N3药品加入烧瓶中,并用保鲜膜封口,减少水分蒸发对实验结果的影响;加热至固体完全溶解,关闭加热装置,静置自然冷却,冷却至有固体析出迅速读取温度。以此方式逐次增加0.5g药品统计溶解温度,至溶解温度超过60℃时完成溶解度测定实验。其溶解曲线图如图2~3所示。
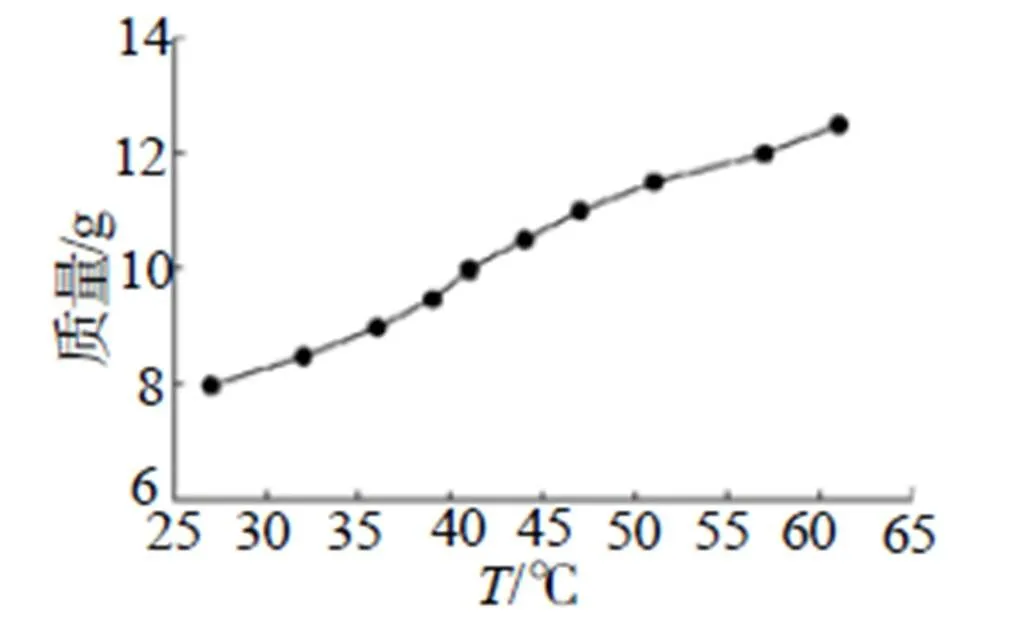
图2 溶解度实测图
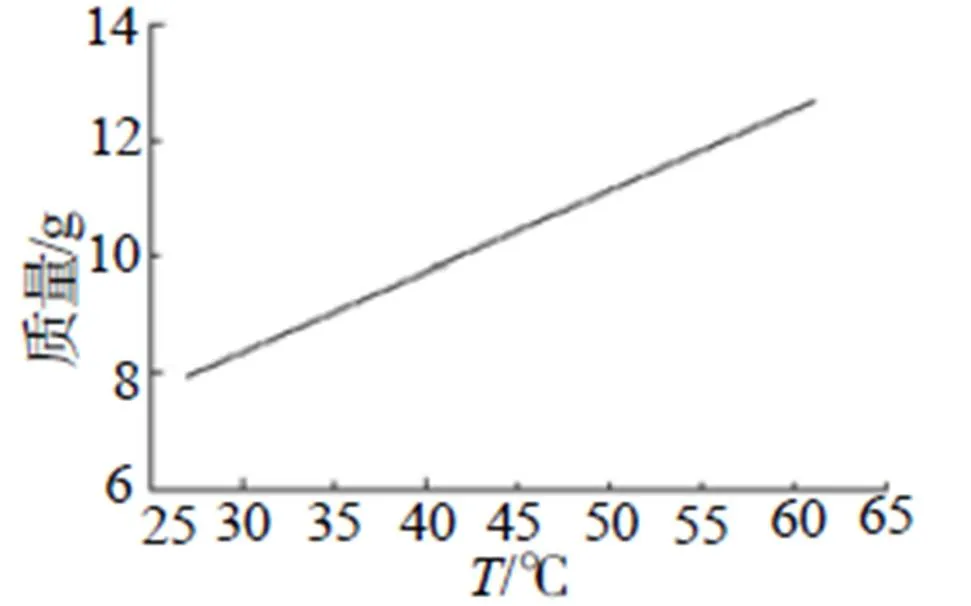
图3 溶解度拟合图
依图2可以看出,NH4N3的溶解度随温度的变化成接近成一定斜率稳定上升。通过拟合曲线,得到图3中拟合曲线,其40mL水中NH4N3的溶解度拟合方程为:=0.153+3.67 (1)
式(1)中:为100mL水中叠氮化铵的溶解质量,g;为水溶液温度,℃。
1.4 晶体培养
本实验采用降温法培养晶体;依据溶解度曲线可知NH4N3的溶解度随温度变化较为稳定,因此在降温过程中不需要进行多梯度降温。实验过程如下:依据拟合方程算出40mL的60℃水可溶解约12.85g的NH4N3;取12.8g药品,放至水中,用脱脂棉封口,加热至60℃,保温10min,之后以0.6℃/h的降温速率降至25℃。降温完成之后取出晶体,用乙醚冲洗,50℃恒温烘箱烘干,得到棒状晶体颗粒。
1.5 结构测试
选取尺寸为0.125mm×0.175 mm×0.155mm的单晶在X射线单晶衍射仪上,用经石墨单色器单色化的MoKα射线辐射,波长=0.710 73,在296(2)K环境下用/2方式扫描。2.70°≤≤26.00°,-8≤≤10,-4≤≤4,-10≤≤10范围内共收集到1 287个衍射点,其中独立衍射点277个(int=0.021 1)。其中> 2() 的277个可观察点用于结构测定和修正。晶体结构的解析和结构修正分别用 SHELXS- 97( Sheldrick,1990)和 SHELXL-97 ( Sheldrick,1997) 程序完成。
1.6 结果分析
通过对测试结果的分析可知,晶体颗粒的化学式H4N4,进一步验证了产物的正确性;NH4N3属于正交体系,P2(1)n 空间群,=8.913 6(11),=3.797 3(7),=8.630 4(12),=4,=292.12(8),=1.366g/cm3,(000)=128,=1.088;最终偏离因子=0.031 3(250),2=0.068 5(277);其分子结构及其晶胞堆积图如图4和图5所示。
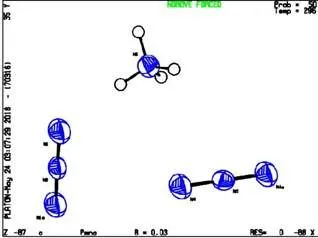
图4 分子结构图
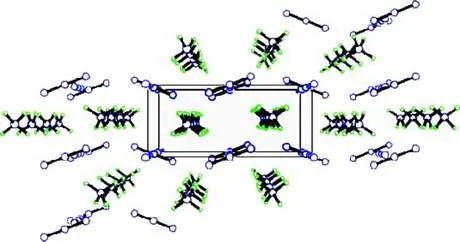
图5 晶胞堆积图
依图4可以看出N3-与NH4+交替排列,每个NH4+周围围绕4个NH4+。
2 叠氮化铵的制备工艺优化
2.1 实验反应过程分析
本实验以叠氮化钡和硫酸铵为原料,以N,N-二甲基甲酰胺溶剂(HCON(CH3)2)为催化剂制备叠氮化铵。由于叠氮化铵本身的挥发特性,通常很难通过旋蒸的方式从叠氮化铵水溶液中获得叠氮化铵固体,所以传统的叠氮化铵制备方式通常不在水中进行反应。本实验利用叠氮化铵在水中随温度溶解度的变化规律,通过高温溶解提升溶解度,滤出非溶物质,降温获得叠氮化铵固体。用乙醚作为反溶剂,进一步降低叠氮化铵在水中的溶解度。该方法与传统方法相比,大幅度缩短了反应时间,且综合了高产率和低温度的特点。
2.2 温度对收率的影响
反应条件:50mL N,N-二甲基甲酰胺液体、22.1g (0.1mol)Ba(N3)2、13.2g(0.1mol)(NH4)2SO4,磁力搅拌并加热至一定温度,保温20min;取40mL去离子水加入反应容器,温度调节至65℃,保温15min;停止加热迅速滤出反应液,加入一定量乙醚液体,冷却至0℃,过滤,用乙醚冲洗,50℃烘箱烘干。其收率结果如图6所示。
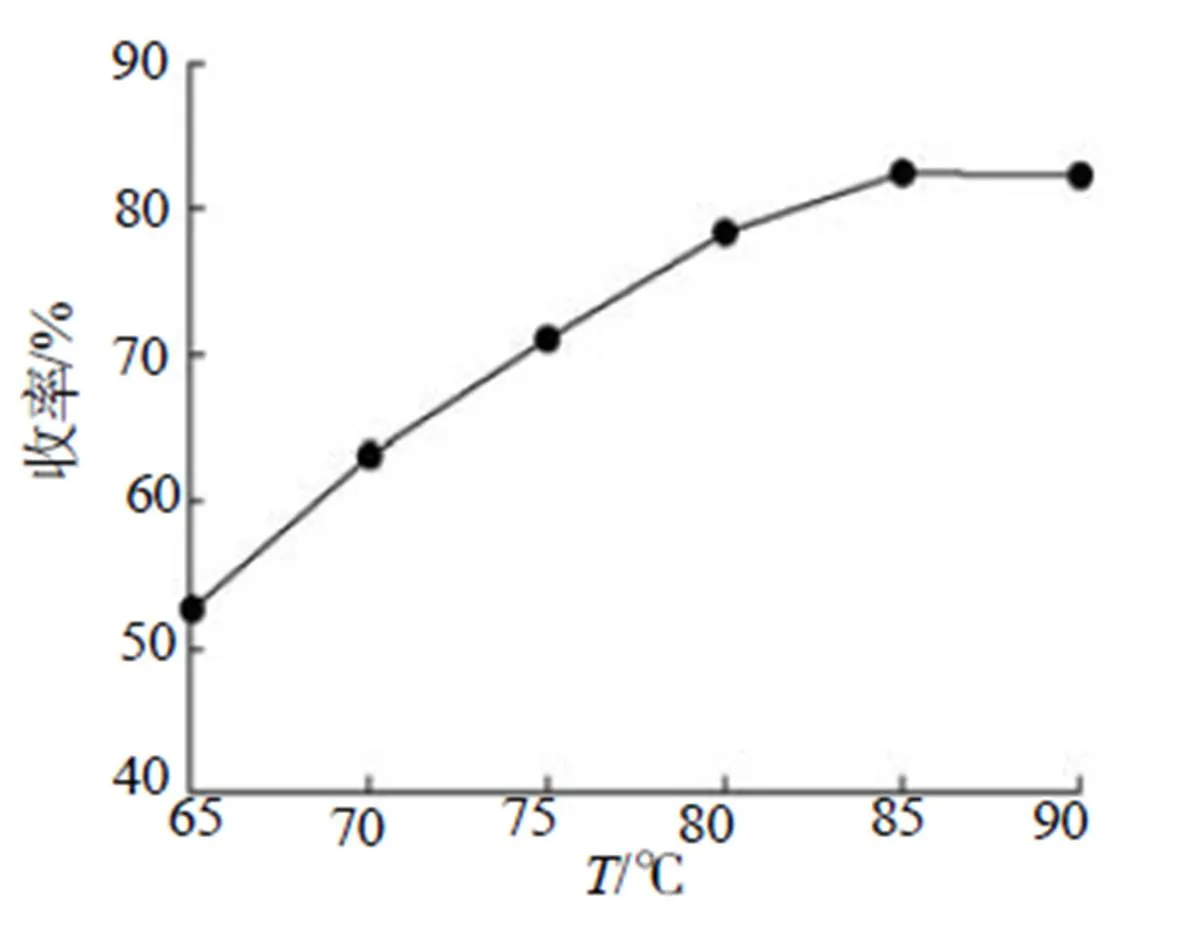
图6 收率随温度的变化图
加水后的保温温度依据产物溶解度曲线设定,本实验不做讨论。依图6可知,在规定时间20min内,实验产物收率随温度上升不断升高,加热至85℃收率趋于稳定(82.5%),温度低于85℃时,存在反应不完全的情况。
2.3 反应时间对收率的影响
反应条件:50mL N,N-二甲基甲酰胺液体、22.1g(0.1mol)Ba(N3)2、13.2g(0.1mol)(NH4)2SO4,磁力搅拌并加热至85℃,保温一定时间;取40mL去离子水加入反应容器,温度调节至65℃,保温15min;停止加热迅速滤出反应液,加入一定量乙醚液体,冷却至0℃;过滤,用乙醚冲洗,50℃烘箱烘干。其收率结果如图7所示。
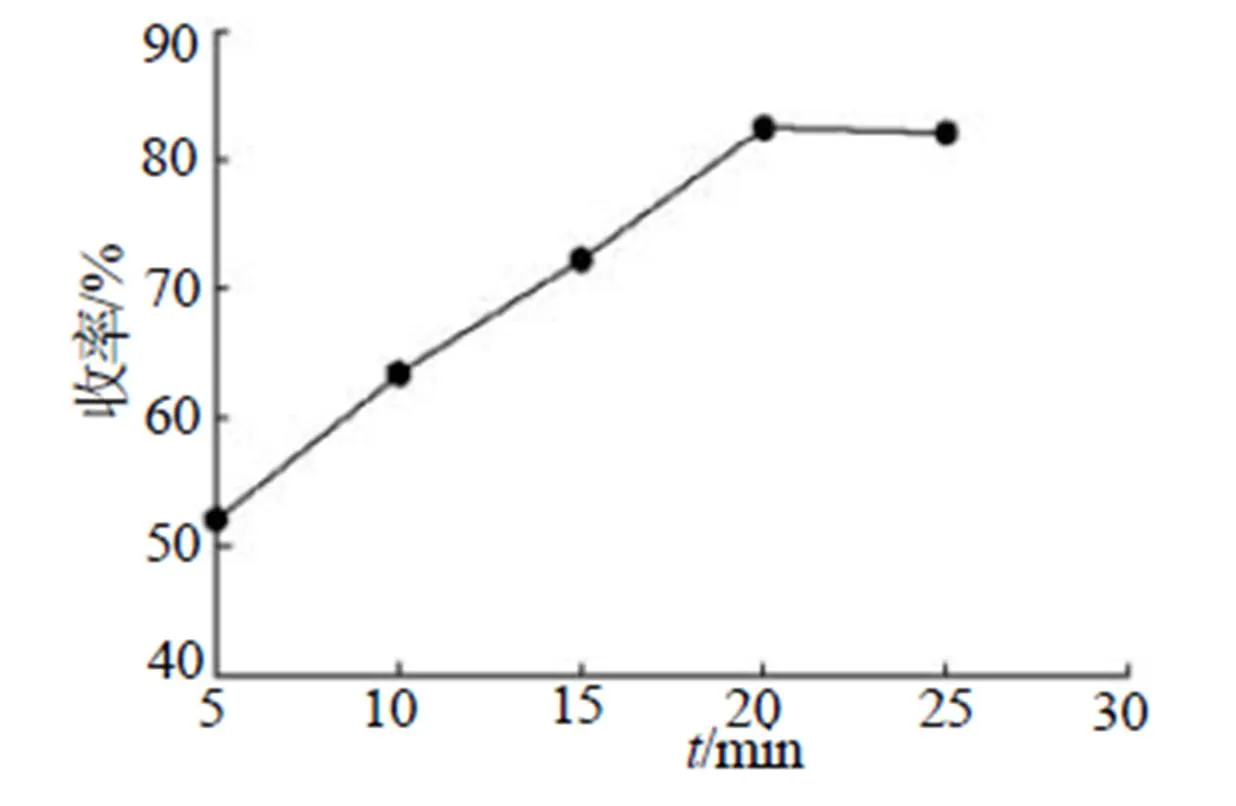
图7 收率随时间的变化图
加水后的保温时间依据产物的溶解速度设定,本实验不做讨论。由图7可知,在规定温度85℃状态下,实验产物收率随反应时间延长不断升高,反应时间至20min时收率趋于稳定(82.5%),时间继续延长,有略微下降趋势,分析可能长时间保温叠氮化铵会随N,N-二甲基甲酰胺共沸挥发所致;反应时长低于15min时,存在反应不完全的情况。
3 结论
本研究旨在寻求一种更加安全可靠地叠氮化铵制备方法。介绍了以叠氮化钡和硫酸铵为原料,N,N-二甲基甲酰胺作为催化剂制备叠氮化铵的新方法。相较传统的催化法(6~7h)制取叠氮化铵,反应时长缩短70%以上,得到以下结论:(1)通过升温降温法掌握药品的溶解规律,设置降温规律获得高质量晶体,结果表明叠氮化铵在20~60℃区间范围内溶解度近线性增长,通过集合曲线获得叠氮化铵的溶解度随温度变化的拟合方程。(2)通过单晶衍射技术了解晶体内部结构,同时验证制备产物的分子组成,测得晶体密度为1.366 g/cm3。(3)设置反应条件梯度,对比分析确定最佳反应时间(15min)以及反应温度(85℃)。
[1] 陈军. 低温气体发生剂的点火研究[D].南京:南京理工大学, 2017.
[2] 陈守文,成一.叠氮化钠气体发生剂的研究[J].火工品,2001 (04): 37-39.
[3] 刘影,冯长根,杨利.非叠氮类气体发生剂的研究进展[J].科技导报,2012,30(22):73-79.
[4] 黄寅生,戴实之,沈瑞琪,叶迎华.正交试验确定汽车安全气囊用气体发生剂配方的研究[J].火炸药学报,1999(01):15-17 +10.
[5] David A.Dows, Eric Whittle, etc. Infrared spectrum of solid ammonium azide a vibrational assignment [J].The Journal of Chemical Physics,1955,23(8):1 475- 1 479.
[6] Chen Jangkang. Development and application of the pyro- technic gas generator propellant on automobile airbag[J]. Huaxue, 1997,55(2):115-122.
[7] Kazuo HASUE, Kazuya YOSHITAKE, etc. Mixtures of pha- sestabilized ammonium nitrate and tetrazoles as new gas- generating agent compositions[J]. Central European Journal of Energetic Materials, 2016,13(1): 247-260.
[8] (美)S.Y.Jr.小狄瑞主编.无机合成[M].张允什,译.北京:科学出版社,1977.
[9] 王静.火药燃烧催化剂的制备及其应用研究[D].南京:南京理工大学,2009.
[10] A. Eslami, S.G. Hosseini, S.H.M. Shariaty. Stabilization of ammonium azide particles through its micro- encapsulation with some organic coating agents[J]. Powder Technology, 2011 (208):137-143.
[11] 贾欢庆,胡炳成,金兴辉.1,2-二硝基胍的合成及热性能[J].含能材料,2013,21(06):730-733.
[12] 张家荣,毕福强,王伯周,张俊林,贾思媛. 3,3′-双(2,2-二甲基-5-硝基-1,3-二氧杂环己烷-5-ONN-氧化偶氮基)氧化偶氮呋咱(BDDAF)的合成、晶体结构与热行为[J].火炸药学报,2017, 40(05):45-50.
Study on Synthesis of Ammonium Azide(NH4N3)
ZHAO Shuai1,LIU Yu-cun1, JING Su-ming1,LI Xin2,WANG Guo-dong3,SHEN Qing-fang4
(1.School of Environment and Safety Engineering, North University of China, Taiyuan, 030051;2.Shaanxi Applied Physics and Chemistry Research Institute,Xi’an,710065;3.Army Engineering University;Shijiazhuang,050003;4.The 210th Institute of the Sixth Academy of CASIC, Xi’an, 710065)
To obtain high productive rate of ammonium azide, and shorten the reaction time, as well as ensure the safety of experiment, a new method for the preparation of ammonium azide using N,N-dimethylformamide as catalyzer, and barium azide and ammonium sulphate as raw materials, was described. The solubility of ammonium azide in water was measured as a function of temperature, and the high purity azide product was extracted from the reaction system, using this characteristic and the incompatibility of barium sulfate in water. Ammonium azide crystals were cultured by slow cooling, and the product was characterized by measuring the molecular structure and cell stacking structure of ammonium azide crystals. Meanwhile, the preparation process was optimized, which obtain the best reaction temperature of 85℃ and reaction time of 15min.
Ammonium azide; Solubility; Crystal culture; Cell structure;Gas generator
1003-1480(2018)05-0033-04
TQ567.9
A
10.3969/j.issn.1003-1480.2018.05.009
2018-07-05
赵帅(1993-),男,在读硕士研究生,主要从事产气药研究。
国家自然科学基金委员会和中国工程物理研究院联合基金(NO.U1330135)。
