“盐类水解”的教学设计
2018-11-21张迎文
张迎文
(甘肃省金昌市第一中,甘肃 金昌)
一、设计背景
新课程教学的目的就是要在教学中创设各种情境,盐类的水解承接了化学平衡和电离平衡的原理,也是对这些原理的具体运用,同时还是学习难溶电解质的溶解平衡及电化学的理论基础。所以,它有承前启后的作用,也是化学反应原理的教学重点和难点之一。
在前面的学习中,学生虽然认识了溶液酸碱性的本质,但对溶液酸碱性的原因还不十分清楚,这就为《盐类的水解》教学提出了问题、制造了悬念,也使学生有了渴求新知的愿望。
二、设计意图
1.通过分组实验,培养学生动手、动脑的习惯,激发学生在质疑中探究强酸弱碱盐和强碱弱酸盐的水解过程,理解盐类水解的实质。
2.通过分组讨论,互动交流,对盐类水解的原理进行分析,归纳总结出盐类水解的规律。
3.通过用化学原理对日常生活中的现象解释,使学生认识到化学与生活的联系,从而激发学生的学习兴趣,培养学生的探究意识和创新能力。
4.通过实验探究与合作交流,让学生体验知识的形成过程,培养学生的科学思想。
三、教学程序设计
1.创设情境,引入新课
用NH4Cl溶液清洗铁锈,用Na2CO3溶液清洗油污。
2.实验探究,突破难点
探究一:盐的类型与盐溶液酸碱性的关系
活动1:提供用品,设计方案
食盐(NaCl)、硫酸钠(Na2SO4)、氯化铵(NH4Cl)、氯化铝(AlCl3)、碳酸钠(Na2CO3)、醋酸钠(CH3COONa)、蒸馏水、酚酞、石蕊、pH试纸。
活动2:动手实验,分析结果。

盐溶液 N a C l N a 2 S O 4 N H 4 C l A l C l 3 N a 2 C O 3 C H 3 C O O N a酸碱性p H形成盐的酸碱类型盐类型总结规律
探究二:探究不同类型的盐溶液呈酸碱性的原因(以醋酸钠为例)
活动1:合作学习,提出猜想
猜想Ⅰ:水显碱性。
猜想Ⅱ:醋酸钠显碱性。
猜想Ⅲ:醋酸钠与水反应的生成物显碱性。
活动2:设计方案,验证猜想——猜想Ⅲ正确
方案Ⅰ:H2O+酚酞
方案Ⅱ:CH3COONa的乙醇溶液+酚酞
方案Ⅲ:CH3COONa的水溶液+酚酞
活动3:问题质疑,寻找原因——分析CH3COONa溶液显碱性的原因

化学方程式:CH3COONa+H2O⇌CH3COOH+NaOH
离子方程式:CH3COO-+H2O⇌CH3COOH+OH-
活动4:变式训练,强化思维
(为了强化思维,让学生自主分析)试分析氯化铵溶液显酸性,氯化钠溶液显中性的原因,并写出相应的化学方程式和离子方程式。
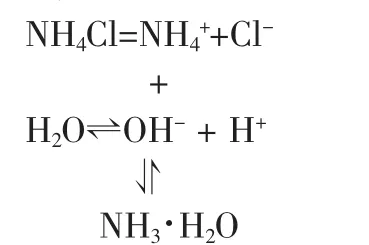
化学方程式:NH4Cl+H2O⇌NH3·H2O+HCl
离子方程式:NH4++H2O⇌NH3·H2O+H+
3.合作交流,形成结论
结论1:盐类水解的概念
在溶液中,盐电离出的离子跟水电离出的H+或OH-结合生成弱电解质的反应。
结论2:盐类水解的实质
盐电离出的离子跟水电离出的H+或OH-结合,生成弱电解质,从而促进水的电离。
结论3:盐类水解的规律
有弱才水解,无弱不水解;谁弱谁水解,谁强显谁性;两强不水解,溶液显中性。
4.效果测评,内化知识
分析下列溶液的酸碱性,并写出水解的离子方程式。
(1)NH4NO3(2)NaClO (3)FeCl3(4)Na2CO3
归纳总结:水解离子方程式书写时应注意的问题
1.盐类水解是可逆反应,水解方程式中通常用“⇌”表示,而不使用等号。
2.盐类水解程度一般较小,水解产物较少,通常不生成沉淀或气体,不标“↓”“↑”符号,生成物如(H2CO3、NH3·H2O)也不写成分解产物(即CO2和H2O、NH3和H2O)。
3.多元弱酸的酸根离子水解是分步进行的,且第一步水解程度比第二步水解程度大。
4.多元弱碱的阳离子水解过程较为复杂,通常一步完成。
四、课后反思
本节课的教学体现了“要我学”向“我要学”的转变,使学生在学习知识的同时体验了化学知识的形成过程,理解了知识的本质,在探究、合作、交流中学会了归纳总结规律,梳理知识体系的方法,同时也为学生的学法构建打下了坚实的基础,使其“有能力在自己的一生中抓住各种机会去更新、深化和进一步充实最初获得的知识,适应不断变革的世界”。
