WWOX对胆囊癌细胞侵袭及迁移能力的影响
2018-11-20魏莉娟
薛 杨, 魏莉娟, 徐 航
1.资阳市第一人民医院消化内科,四川 资阳 641300; 2.西南医科大学附属中医医院消化内科
胆囊癌发生于胆囊体部、颈部及底部,并且以胆囊管侵犯为特征,是一种恶性肿瘤,在我国,胆囊癌在西北和东北部的发病率最高,在消化道恶性肿瘤中排名第6位,且胆囊癌的发病率呈逐年上升的趋势[1]。胆囊癌易转移、易复发,预后差,其发病机制较为复杂,是多基因经过多阶段共同作用产生的,与肿瘤细胞的侵袭、迁移和上皮细胞间质转型等有关[2-3]。WWOX是一种抑癌基因,含有脆性位点,其编码的蛋白可以调控癌细胞的生长、转移等过程[4]。在卵巢癌、肺癌、胃癌等组织中均发现了WWOX基因的表达下调甚至缺失[5-7]。本研究以胆囊癌细胞为研究对象,通过细胞转染的方法过表达细胞中WWOX,探讨WWOX对胆囊癌细胞生长、侵袭、迁移的影响,以期为研究胆囊癌的发病机制提供参考。
1 材料与方法
1.1材料胆囊癌细胞株GBC购自中科院上海细胞库;过表达WWOX的真核表达载体(pcDNA3.1-WWOX)由四川大学生物治疗国家重点实验室构建保存;WWOX引物由生工生物工程上海(股份)有限公司合成;转染试剂Lipofectamine 2000(美国Thermo公司);二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度检测试剂盒、RNA提取试剂盒(北京TIANGEN公司);WWOX一抗(美国Cell Signaling公司);基质金属蛋白酶-2(matrix metalloprotease 2,MMP-2)一抗、基质金属蛋白酶-9(matrix metalloprotease 9,MMP-9)一抗(美国Stanta Cruz公司);波形蛋白(Vimentin)一抗、上皮钙黏附素(E-cadherin)一抗(美国R&D Systems公司)。
1.2细胞培养及转染GBC细胞用含有100 U/ml青霉素、100 μg/ml链霉素、质量浓度为100 g/L的胎牛血清的RPMI1640培养液,培养条件为37 ℃,体积分数为5%的 CO2培养箱。细胞培养至密度超过80%,用含质量浓度为25 g/L的胰蛋白酶消化传代。GBC细胞分为Control、pcDNA3.1、pcDNA3.1-WWOX,用Lipofectamine 2000脂质体转染法将pcDNA3.1、pcDNA3.1-WWOX转染至GBC细胞中,步骤参照转染试剂说明书。
1.3qRT-PCR检测细胞中WWOX水平Control、pcDNA3.1、pcDNA3.1-WWOX细胞转染后72 h,加入磷酸缓冲盐溶液(phosphate buffered saline,PBS)将细胞洗涤3次,在细胞中加入含质量浓度为25 g/L的胰蛋白酶消化,收集细胞沉淀,按照106ml-1的Trizol,将细胞裂解后,放在室温条件下孵育10 min,按照每1 ml的Trizol加入200 μl的氯仿,剧烈震荡15 s,放置于室温条件下静置3 min。4 ℃,12 000 r/min离心10 min,此时溶液分为3层,取最上层的溶液转移到EP管中,加入500 μl的异丙醇,在-20 ℃孵育10 min,4 ℃,12 000 r/min离心10 min,将上清液吸除后,加入1 ml 75%的乙醇洗涤3次,置于室温条件下干燥,用20 μl的无Rnase 的双蒸水溶解。取2 μl的RNA用微量核酸定量仪检测OD260/OD280的值为1.8~2.1。逆转录合成cDNA(20 μl体系,4 μl RNA模板)。qRT-PCR检测WWOX水平。WWOX上游引物:5′-CACGCATTTTAGAAGAATGG-3′,下游引物:5′-GACAGCAGCACAGTACACG-3′。β-actin上游引物:5′-CGGGAAGGCTTGTGATCAATGG-3′,下游引物:5′-GGCAGTGATGGCATGGACTG-3′。循环参数为:95 ℃预变性3 min;(95 ℃变性15 s,60 ℃退火30 s)×40个循环。
1.4Westernblotting检测WWOX、MMP-2、MMP-9、Vimentin、E-cadherin水平Control、pcDNA3.1、pcDNA3.1-WWOX细胞转染后72 h,用PBS洗涤细胞3次,加入含有苯甲基磺酰氟(phenylemthanesulfonyl flyoride,PMSF)的裂解液,放在冰上裂解30 min,4 ℃,12 000 r/min离心10 min,收集上清溶液,保存温度为-20 ℃。BCA法对蛋白进行定量。蛋白变性:将蛋白样品与5×Loading buffer混合煮沸。蛋白电泳:用12%的分离胶和4%的浓缩胶,100 V电压电泳。转膜:400 mA转膜60 min。免疫反应:含质量浓度为50 g/L的牛血清白蛋白室温孵育90 min;与1∶500稀释的WWOX、1∶800稀释的MMP-2、1∶800稀释的MMP-9、1∶500稀释的Vimentin、1∶500稀释的E-cadherin于4 ℃孵育过夜,加入1∶2 000稀释的辣根过氧化物酶标记的二抗室温孵育90 min。转移到暗室中,ECL发光,以β-actin为内参,分析蛋白表达水平。
1.5CCK8检测细胞增殖Control、pcDNA3.1、pcDNA3.1-WWOX细胞以5×105个细胞/ml接种到96孔细胞培养板中,每孔中加入100 μl,培养72 h后,把培养液吸除,加入10 μl的CCK8,锡箔纸包好,避光孵育3 h,检测450 nm的吸光度值(Absorbance,A值)。
1.6Transwell小室检测细胞侵袭把Transwell小室置于培养板,在小室的上室中加入不含血清的培养液300 μl将基质胶水化,室温条件下孵育2 h。将Control、pcDNA3.1、pcDNA3.1-WWOX细胞用不含血清的培养液制成5×105个细胞/ml浓度的细胞悬浮液。在Transwell小室的上室加入300 μl细胞悬浮液,在下室中加入含有胎牛血清的细胞培养液500 μl,培养24 h,在24孔板中加入500 μl的结晶紫染液,染色20 min,用水漂洗后,在显微镜下随机选5个视野(200×),计数细胞。
1.7细胞划痕检测细胞迁移Control、pcDNA3.1、pcDNA3.1-WWOX细胞接种在6孔细胞培养板中,接种密度为5×105个/孔,过夜培养后,细胞完全铺满。用枪头垂直的划出细痕,用PBS将划落的细胞吸掉,加入不含血清的细胞培养液培养。分别在0 h和24 h测量划痕宽度。细胞迁移率=[(0 h划痕宽度-24 h划痕宽度)÷0 h划痕宽度×100%]。

2 结果
2.1转染后细胞中WWOX水平pcDNA3.1细胞中WWOX mRNA和蛋白水平与Control相比,差异无统计学意义(t=0.316、0.243,P>0.05)。pcDNA3.1-WWOX细胞中WWOX mRNA和蛋白水平与Control相比明显升高,差异有统计学意义(t=14.626、11.035,P<0.05)(见图1、表1)。提示pcDNA3.1-WWOX可以提高胆囊癌细胞中WWOX水平。
2.2WWOX抑制胆囊癌细胞增殖pcDNA3.1细胞A值与Control相比,差异无统计学意义(t=0.521,P>0.05)。pcDNA3.1-WWOX细胞A值与Control相比明显降低,差异有统计学意义(t=4.866,P<0.05)(见表2)。提示提高胆囊癌细胞中WWOX水平后,胆囊癌细胞增殖能力降低。

图1 Western blotting检测细胞中WWOX水平 Fig 1 WWOX level detected by Western blotting
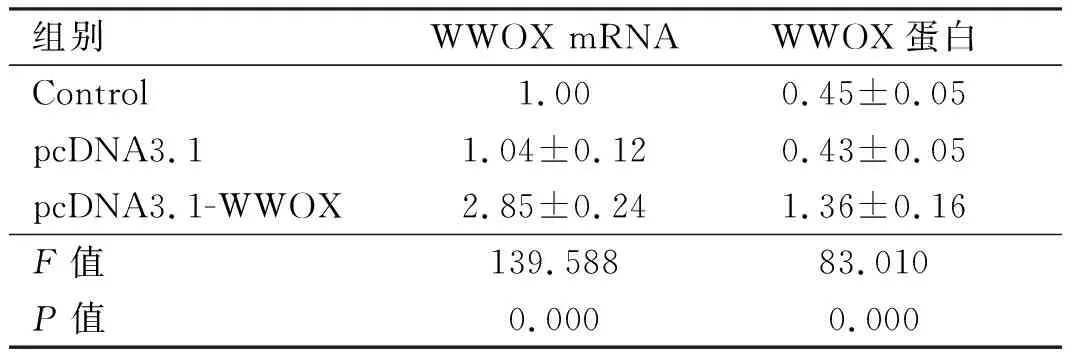
组别WWOX mRNAWWOX蛋白Control 1.000.45±0.05pcDNA3.11.04±0.120.43±0.05pcDNA3.1-WWOX2.85±0.241.36±0.16F值139.58883.010P值0.0000.000
表2 各组细胞A值变化Tab 2 The change of A value in each
2.3WWOX抑制胆囊癌细胞侵袭和迁移pcDNA3.1细胞迁移率、侵袭细胞数目与Control相比,差异无统计学意义(t=0.571、0.227,P>0.05)。pcDNA3.1-WWOX细胞迁移率、侵袭细胞数目与Control相比明显降低,差异有统计学意义(t=6.280、3.339,P<0.05)(见表3)。提示提高胆囊癌细胞中WWOX水平后,胆囊癌细胞侵袭和迁移能力降低。
2.4WWOX抑制胆囊癌细胞中MMP-2、MMP-9、Vimentin、E-cadherin表达pcDNA3.1细胞MMP-2、MMP-9、E-cadherin、Vimentin水平与Control相比,差异无统计学意义(P>0.05)。pcDNA3.1-WWOX细胞MMP-2、MMP-9、Vimentin与Control相比明显降低,E-cadherin水平与与Control相比明显升高,差异有统计学意义(P<0.05)(见表4、图2)。提示提高胆囊癌细胞中WWOX水平后,胆囊癌细胞中MMP-2、MMP-9、Vimentin表达水平下降,细胞中E-cadherin水平升高。
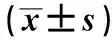
组别迁移率/%侵袭细胞数目Control52.82±4.65115.25±14.05pcDNA3.151.17±3.69117.47±13.26pcDNA3.1-WWOX34.68±1.5282.64±7.48F值24.1177.974P值0.0010.020
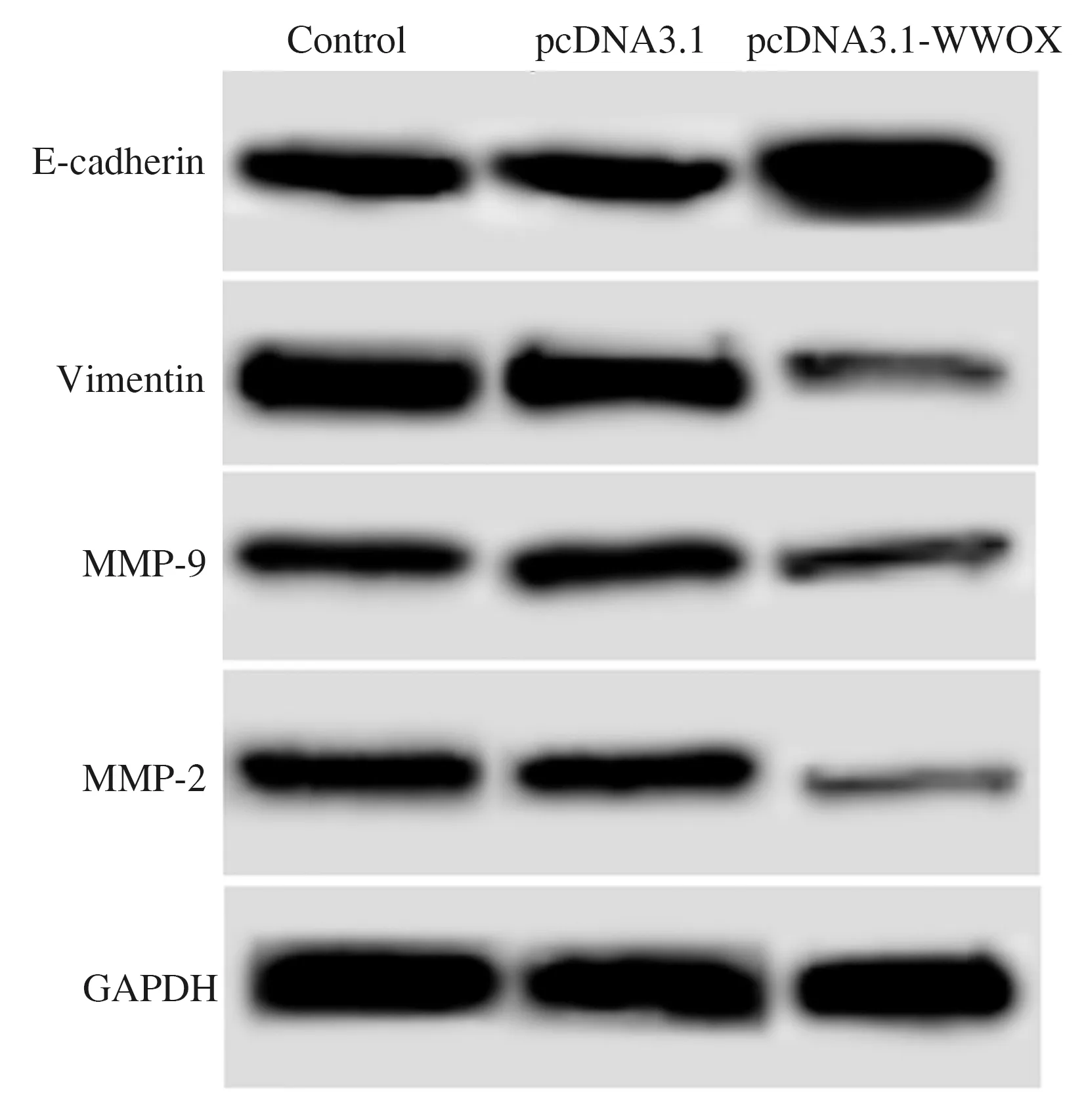
图2 Western blotting检测MMP-2、MMP-9、E-cadherin、Vimentin蛋白水平 Fig 2 MMP-2, MMP-9, E-cadherin, Vimentin protein

组别MMP-2MMP-9E-cadherinVimentinControl0.68±0.080.62±0.040.82±0.091.05±0.11pcDNA3.10.69±0.05#0.60±0.07#0.81±0.07#1.02±0.12#pcDNA3.1-WWOX0.25±0.04*0.41±0.03*1.45±0.12*0.42±0.08*F值54.08616.33844.15734.550P值0.0000.0040.0000.001
注:与Control相比,t1=0.207,t2=0.493,t3=0.128,t4=0.351,#P>0.05;与Control相比,t1=8.902,t2=5.179,t3=8.074,t4=7.368,*P<0.05。
3 讨论
WWOX基因定位于染色体16q23.3,含有9个外显子,其内显子5和8是染色体脆性位点,也是转移和断裂发生最多的位置,WWOX蛋白含有WW结构域和氧化还原结构域,WW结构域能够与富含脯氨酸的结构域结合,从肝癌中扩增出来的Hep27蛋白也含有氧化还原结构域,该结构域均与肿瘤密切相关[8-9]。研究[10]显示,WWOX在多种癌症中表达下调。BEDNAREK等[11]在卵巢癌、多发性骨髓瘤等细胞中发现WWOX基因外显子丢失,其mRNA中有异常的剪切体。WWOX基因能够调控癌细胞的生长、凋亡、侵袭及迁移能力[12]。有研究[13]报道称,WWOX基因可以诱导胆囊癌细胞凋亡,抑制胆囊癌细胞生长,在胆囊癌中发挥抗肿瘤作用。本研究结果显示,WWOX基因过表达后的胆囊癌细胞增殖能力下降,与上述报道相符合。
肿瘤细胞恶性增殖,分化异常,浸润至周围或向远处转移是肿瘤的特点,肿瘤的迁移和侵袭是一个复杂过程,细胞外基质降解、细胞黏附、基底膜等均参与其中[14]。细胞脱落是肿瘤转移的第一步;肿瘤细胞因其黏附性下降,从原发部位脱落,细胞表面的细胞因子可以与细胞外基质或是基底膜结合,分泌胶原酶,进入循环系统;在循环系统中,肿瘤细胞可以与血小板结合,进入血管或者淋巴管中,到达新的组织后继续增殖形成转移灶[15]。本研究显示,WWOX基因过表达后的胆囊癌细胞侵袭和迁移能力均下降,说明WWOX除了可以抑制胆囊癌细胞生长外,还可以抑制肿瘤细胞的侵袭和迁移。
基质金属蛋白酶是一类需要依赖金属离子如钙离子、锌离子等的蛋白水解酶类,具有降解细胞外基质的作用[16]。肿瘤组织中基质金属蛋白酶的水平与肿瘤细胞的侵袭能力具有相关性,基质金属蛋白酶水平越高,肿瘤的侵袭能力也越强[17]。在人类中目前已经发现有23种基质金属蛋白酶,这些蛋白酶成员一般都含有前肽区、疏水信号肽序列、与锌离子结合的催化活性区、与酶特异性底物有关的羧基末端、含有大量脯氨酸的铰链区共5个功能结构域,这些结构域在维持蛋白酶结构、活性及蛋白功能发挥过程中发挥重要作用[18]。MMP-9和MMP-2是研究最多的基质金属蛋白酶家族成员,具有破坏基底膜、降解外基质的作用,在肿瘤细胞迁移和侵袭中发挥促进作用[19]。上皮细胞间质转型是肿瘤侵袭和迁移的前提,其可以使上皮细胞标志物E-cadherin表达下调,从而获得间质细胞特性,而Vimentin是间质细胞的标志物[20]。研究[21]显示,E-cadherin在肿瘤组织中表达下调,Vimentin在肿瘤组织中表达升高。本研究结果显示,WWOX可以降低胆囊癌细胞中MMP-2和MMP-9表达水平,提高细胞E-cadherin表达水平,减弱细胞中Vimentin的表达,说明WWOX可以阻碍胆囊癌降解细胞外基质的能力,抑制上皮细胞间质转型。
综上,WWOX抑制胆囊癌细胞增殖、侵袭和迁移能力,降低胆囊癌细胞中MMP-2、MMP-9、Vimentin水平,促进细胞中E-cadherin表达,WWOX可以抑制基质金属蛋白酶介导胆囊癌细胞侵袭和迁移,抑制上皮细胞间质转型。本研究结果为探讨WWOX在胆囊癌发生、发展和转移中的作用奠定了基础,对于胆囊癌的治疗具有重要意义。
