FDA批准的首个PD-1/PD-L1抑制药阿特珠单抗
2018-11-20雷兵团张雅琳白秋江
雷兵团,张雅琳,白秋江
(开滦总医院,河北 唐山 063000)
转移性尿路上皮癌(mUC)在膀胱癌(UBC)中占比不到10%,但超过50%的肌层浸润性UBC患者最终发生转移,预后差,对铂类联合化学治疗(简称化疗)总体反应率约为50%,且应答持续时间短,平均生存期为14个月,5年生存率仅为10% ~20%。约有50%该类型的膀胱癌患者无法耐受基于顺铂或联合顺铂的化疗方案,替代治疗带来的持续缓解作用却十分有限[1]。
美国食品药物管理局(FDA)批准新药阿特珠单抗(atezolizumab)用于既往未接受治疗(一线治疗)及不适合顺铂为基础的化疗的局部晚期或转移性尿路上皮癌。阿特珠单抗是FDA批准的首个用于局部晚期或转移性尿路上皮癌的程序性细胞死亡受体1(PD-1)及其配体1(PD-L1)抑制剂,同时又是最新型靶向人源化单克隆抗体,因其全新的作用机制,可使24%的mUC患者肿瘤体积缩小30%,且有显著的临床疗效[2],完全或部分缓解率高,中位总生存期长,依从性及耐受性好,获评FDA突破性药物,享受加速审批、优先审批待遇。在此就阿特珠单抗的作用机制、药代动力学(简称药动学)、临床研究及其不良反应等进行介绍。
1 作用机制
PD-1最初是在凋亡的T细胞杂交瘤中由消减杂交法发现,因其和细胞凋亡相关而被命名为程序性死亡受体1。PD-1配体被证实包括PD-L1(又称B7-H1)和PD-L2(又称 B7-DC),PD-1为主要表达在活化T细胞上的抑制性受体,与其配体PD-L1结合,显著抑制T细胞活化和增殖。PD-1/PD-L1已被证实广泛参与自身免疫、抑制免疫和肿瘤免疫等机体免疫,通过传递负性调控信号,导致肿瘤抗原特异性T细胞的诱导凋亡和免疫无效,使肿瘤细胞逃避机体的免疫监控和杀伤[2]。
阿特珠单抗基于以PD-L1为靶点设计的人源化单克隆抗体,是首个PD-1/PD-L1抑制剂,通过抑制PD-L1与T细胞表面的PD-1及B7.1结合,解除后两者介导的T细胞免疫抑制作用,进而诱导T细胞活化,重建机体对肿瘤细胞的监测和攻击能力[3]。
2 药动学
剂量范围 1~20 mg/kg,包括固定剂量 1 200 mg,每 3周 1次。基于一项群体(472例)药动学研究[3],典型的群体清除率为每天0.20 L,稳态分布容积为6.9 L,末端半衰期为27 d。群体药动学数据显示,在重复给药6~9周(2~3疗程)后血药浓度达稳态。药时曲线下面积、峰浓度和谷浓度时的全身积蓄率分别为1.91,1.46和2.75倍。
一项基于老年人群体药动学研究结果显示[3],59%的受试者为65岁或以上,药动学数据无显著变化。该项研究同时显示,轻度肝功能损伤者药动学数据无显著变化,使用时不需要调整剂量。
3 临床试验及其临床评价
一项单中心、开放、两队列试验[4]结果显示,310例有局部晚期或转移尿路上皮癌患者,平均年龄66岁(59~72岁),78%为男性,91%为高加索人;26%有非膀胱尿路上皮癌,78%有内脏转移;依美国东部肿瘤协作组(ECOG)评分标准,评1分者占62%,且35%基线肌酐清除率(CCr)< 60 mL /min;19% 为既往经含铂辅助化疗后;41%有在转移情况下接受既往全身治疗方案。所有患者分为2个队列:队列1为既往未接受治疗但又不适合顺铂化疗的UBC患者,队列2为含铂方案化疗(二线或多线)的患者,73%既往接受顺铂,26%既往接受卡铂,1%既往接受其他铂类方案。在接受1个含铂化疗方案期间或之后有疾病进展,或用1个含铂辅助化疗方案治疗的12个月内疾病进展,开始使用本品治疗,1 200 mg静脉滴注,每3周1次,直至不可耐受毒性出现,或任一放射影像或临床证据显示疾病进展(队列1)或失去临床收益(队列2)。
排除自身免疫疾病史,活动或皮质类激素依赖性脑转移瘤,纳入前28 d内给予活减毒疫苗,或给予全身免疫刺激药物或全身免疫抑制药物者。
肿瘤标本经中央实验室前瞻性采用Ventana PDL1(SP142)分析,依据分析结果划分为2个表达亚组。表达亚组1(100例):32%为PD-L1表达≥5% [PDL1染色的肿瘤浸润免疫细胞(ICs)覆盖 ≥5%肿瘤面积];表达亚组 2(210例):68%为 PD-L1表达 <5%(PD-L1染色的肿瘤浸润ICs覆盖<5%肿瘤面积)。
主要疗效终点测量经独立审查机构(IRF)使用实体瘤疗效评价标准(RECIST,v1.1)评估确证,主要终点是总缓解率(ORR),次要终点包括缓解持续时间(DOR)、总生存期(OS)、无进展生存期(PFS)和安全性等。
研究结果显示,患者ORR为14.8%,完全缓解率(CR)为 5.5% ,部分缓解率(PR)为 9.4%,应答反应持续时间为 2.1~3.8个月,12 个月内总生存率(OSR)为48%,治疗相关不良事件总发生率为96%。队列1疗效:患者ORR为24%,CR为7%,PR为75%,应答反应持续时间为2.1~16个月,12个月内OSR为57%,治疗相关不良事件总发生率为66%。队列2疗效:患者ORR为16%,CR为7%,PR为75%,应答反应持续时间为4.5~17.5个月,12个月内OSR为37%,治疗相关不良事件总发生率为70%。亚组1与亚组2疗效比较:ORR 为 26.0%比 9.5%,CR 为 12.0%比 2.4%,PR为14.0%比7.1%,应答反应持续时间为14.2个月比12.7 个月,12 个月内 OSR 为 63.0%比 45.0%,治疗相关不良事件总发生率为82.0%比79.0%。
亚组疗效显示,本品疗效与PD-L1的表达密切相关,其中PD-L1高表达(≥5%)则疗效显著。
4 不良反应
本品的安全性临床评价试验[4],共纳入310例患者,其中0.9%的患者可疑因脓毒血症、肺炎或肠梗阻导致死亡。不良反应大多可耐受,详见表1。
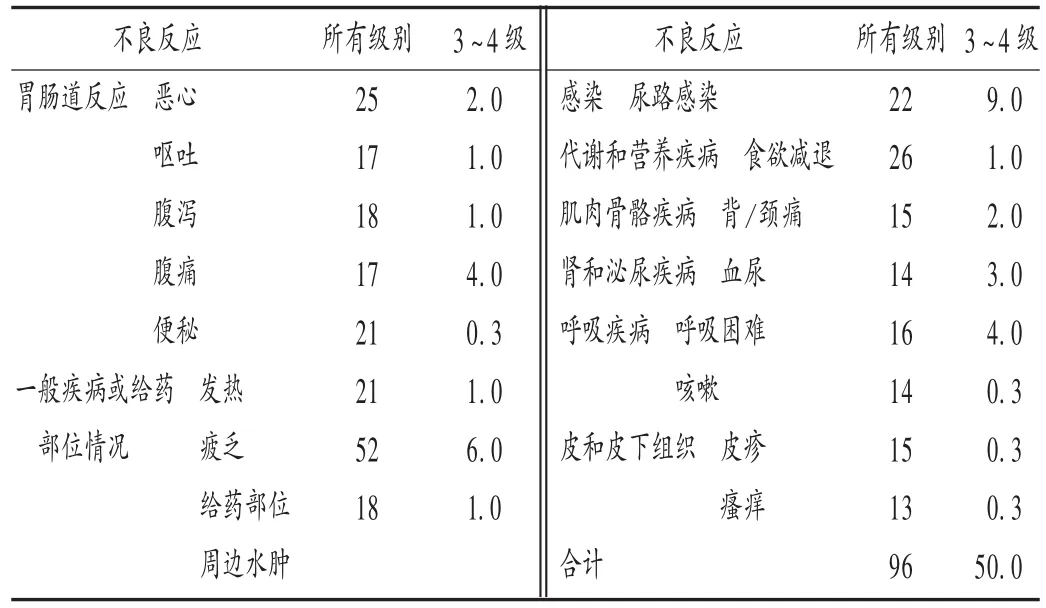
表1 发生率≥10%的所有级别不良反应(%)
实验室测试异常,且发生率>1%的所有3~4级不良反应分别为低白蛋白血症(1%),天门冬酸氨基转移酶(AST)升高(2% ),丙氨酸氨基转移酶(ALT)升高(2% ),肌酐升高(3% ),碱性磷酸酶升高(4%),高血糖(5% ),贫血(8% ),低钠血症(10% ),淋巴细胞减少(10% )。
5 小结
阿特珠单抗的获批,使其成为FDA批准的治疗晚期或转移性尿路上皮癌的首个PD-1/PD-L1免疫疗法,每3周给药1次,患者依从性好,临床研究证实其获益明显,不良反应大多可耐受[5],最重要的是本品为不适合铂类或不能耐受铂类的晚期或转移性尿路上皮癌患者提供了新的治疗选择。另因本品全新的作用机制,使其在其他领域如食管癌[6]、乳腺癌、胃癌、肠癌、肺癌[7]、卵巢癌、宫颈癌、肾癌[6]、胰腺癌[8]、神经胶质瘤、黑色素瘤[9]等领域应用潜力巨大,目前在乳腺癌和肾癌治疗方面也取得了可喜的成绩[10],在靶向免疫新疗法方面更是具有里程碑式的重大意义[11]。
