2种城市绿化树种根系分泌物对芘胁迫的响应
2018-11-20闫文德王姣龙李际平
章 帆 ,闫文德 ,王姣龙 ,李际平
(1.中南林业科技大学,湖南 长沙 410004;2.深圳市深港产学研环保工程技术股份有限公司,广东 深圳 518057;3.南方林业生态应用技术国家工程实验室,湖南 长沙 410004)
多环芳烃(PAHs)是一类广泛存在于自然界中、具有“三致”( 致癌、致畸、致突变)效应的持久性有机污染物(Persistent Organic Pollutants,POPs)[1-2],主要来源于煤炭、石油、汽油等有机高分子化合物的不完全燃烧。近年来,人类的生产活动导致了环境中多环芳烃含量大幅度增加,直接危害人体健康和国土生态环境安全。因此研究如何去除土壤中多环芳烃,以达到修复被污染土壤的目的,具有重大的现实意义。
植物修复是指利用植物来消除土壤中的有机毒物和无机废物[4],根系分泌物是指植物在生长过程中由根系分泌产生的无机离子或小分子有机物的统称,它具有改善根际周边的微环境,协调土壤中微生物种群结构、加快有机质矿化等独特作用[4-5]。研究表明,不同类型的植物根系分泌的物质不同,不同的根系分泌物对多环芳烃的降解效果也各不相同。杨艳[6]研究了以芘、菲、萘、苊对黑麦草根系分泌效应的影响,结果在多环芳烃污染物胁迫下,黑麦草根系分泌物中可溶性有机酸的含量均高于对照组,随着培养液中污染物浓度的升高,可溶性有机酸等分泌量也随之增加。谢明吉[7]等通过对菲处理下黑麦草的根系分泌物中几种低分子有机酸的监测,发现黑麦草根系分泌中有机酸及氨基酸等含量随菲浓度的升高而变化。王姣龙[8-9]通过对芘胁迫下4种绿化树种的根系分泌物成分进行分析,得出在不同浓度的芘胁迫下,植物根系分泌物有着不同程度的变化。
本试验采用栾树Koelreuteria paniculata和樟树Cinnamomum camphora为研究对象,以芘为PAHs代表物测定在不同芘浓度胁迫下2种城市绿化树种的根系分泌物的组成成分变化、根系活性及其生长形态的变化。目前植物修复的综述文章较多,具体探讨植物根系分泌物对土壤中污染物的修复机理的报告还较少。本研究将探究植物根系分泌物对土壤中多环芳烃污染的响应作用,也为进一步探讨根系分泌物在多环芳烃污染物降解过程的机理提供基础数据。
1 材料与方法
1.1 试验设计
本研究于2015年9月在中南林业科技大学生态应用技术国家工程实验室进行。栾树和樟树2个树种是我国南方城市常见的绿化树种,栾树(阔叶落叶树种)喜光耐寒,对环境适应性较强[10]。樟树(阔叶常绿树种)枝叶茂盛,树形优美常被作为绿化行道及防风林[11]。污染物选取南方城市环境中常见的芘为多环芳烃代表物。将芘试剂(>97%)溶于丙酮溶液中,与石英砂按照一定比例均匀混合。配置完成后,置于通风厨内待丙酮挥发完全。共设置3个芘浓度(L0:0 mg/kg对照处理;L1:500 mg/kg低浓度处理;L2:2 000 mg/kg高浓度处理;浓度参考土壤中多环芳烃浓度[12-14]),每组3重复。
选取1年生樟树实木苗,苗高,地径基本保持一致(栾树苗高约43.7 cm,地径约0.35 cm;樟树苗高约为55.7 cm,地径约0.49 cm),将植物根系整理后浸入0.15%的福尔马林溶液中灭菌,用蒸馏水冲洗根部表面(不破坏根),移植到装有1 kg石英砂的Φ8 cm塑料盆中。每盆1株,共18盆。定期浇水,移动盆栽位置,保证每盆植株生长环境基本一致。
1.2 根系分泌物收集
培养50 d后,用清水冲洗幼苗根部(不损坏根部结构),再用去离子水浸泡大约3 min(加少量百里酚溶液抑制微生物活动)。以3株幼苗为单元置于1 000 mL 0.5 mmol/L CaCl2的烧杯中,滴3~5滴百里酚抑菌,再用锡箔纸包裹烧杯,保持烧杯口通气状态,培养24 h,过滤后保存到冰箱,待测。
1.3 根系分泌物成分GC-MS分析
将收集的1 000 mL待测液减压至50 mL,加入100 mL CH2Cl2,振荡6 h,重复3次,将3次溶剂合并,减压浓缩至干,滴加2 mLCH2Cl2(过0.45 μm膜),移液至玻璃取样瓶中(保存在-20℃冰箱)。测定仪器:GC-MS型号为GC6890/MS5973气相色谱质谱联用仪,毛细管柱DB-5 ms,进样口温度为 280 ℃,柱温为 50 ℃,保持时间为 3 min,以 10 ℃·min-1程序升温至290 ℃,保持时间为20 min,使用的载气为He,以0.2 s速度扫全程,离子源温度为200 ℃,接口温度为250 ℃,使用面积归一化法测定。
1.4 根系分泌物中TC、TN含量
取30 mL待测液使用岛津TOC-500测定仪测定。
1.5 根活力的测定
采用甲稀蓝法[15]测定。用排水法测量根体积,用滤纸吸干根系表面水分,浸入根体积10倍的甲稀蓝溶液(0.000 2 mol/L)中1.5 min取出,吸取1 mL甲基蓝溶液,稀释10倍。选择波长为660 nm,以纯水为参照对比在分光光度计下比色,读出光的密度。
总吸收面积 (m2) = [(C1-C1′)×Vl]+[(C2-C2′)×V2]×l.l;
活跃吸收面积 (m2) = [(C3-C3′)×V3]× l.l。
式中:C为溶液原来的浓度mg·mL-1;C′为浸提后的浓度mg·mL-1;1,2,3为离心管编号。
1.6 酸性磷酸酶活性的测定
根系酸性磷酸酶活性的测定采用Mclanchlan法[16]。将植物根系侵入约为其体积10倍的以醋酸钠缓冲液(0.2 mol·L-1,pH值约5.8)为溶剂的对硝基苯磷酸二钠(0.5 g·L-1)酶反应液,用锡箔纸包裹。常温培养60 min,取出加入1 mL NaOH溶液终止酶促反应,空白处不放植物根系,以空白为对比,波长660 nm分光光度。
酶活性 nmol·g-1min-1= 试样A/(0.019×T×W)×V总。
式中:A为试样的吸光度,0.019为pH值为14时,对硝基酚的μmol吸光系数。

式中:V1为反应液体积;V2为NaOH体积;T为时间;FW为根鲜质量。
1.7 根系生长指标的测定
直尺及游标卡尺计算栾树、樟树的苗高和地径(地面以上20 cm处直径)
1.8 数据处理及分析
数据用Excel 2010软件处理,使用SPSS19.0进行单因素方差分析(P<0.05,差异性显著)。
2 结果与分析
2.1 根系分泌物的成分分析
由表1、2可见,对照组,栾树根系分泌物中共检测到15种化合物,其中包括7种烷烃类、4种烯烃、3种杂环类化合物以及1种酚醛类。经L1处理下,根系分泌物中共检测到20种化合物,其中9种烷烃、3种烯烃、2种杂环类、3种苯类、1种酯类以及芘类。经L2处理下,根系分泌物中共检测到19种化合物,其中6种烷烃、3种硅氧烷、3种烯烃、2种杂环类、1种酯类及芘类。空白组,樟树根系分泌物中共检测到7种化合物,其中3种烷烃类、2种杂环类、1种酚醛类和1种烯烃。经L1处理,樟树根系分泌物中共检测到14种化合物,其中包括7种烷烃、2种烯烃、2种杂环类化合物、1种酚醛类以及芘。经L2处理,根系分泌物中共检测到10种化合物,其中包括5种杂环类、2种烷烃、1种酯类、1种硅氧烷以及芘类。

表1 3种不同水平处理栾树根系分泌物中化学成分的对比分析Table 1 Comparison of component analysis of root exudate of Koelreuteria paniculata under three levels

续表1Continuation of table 1
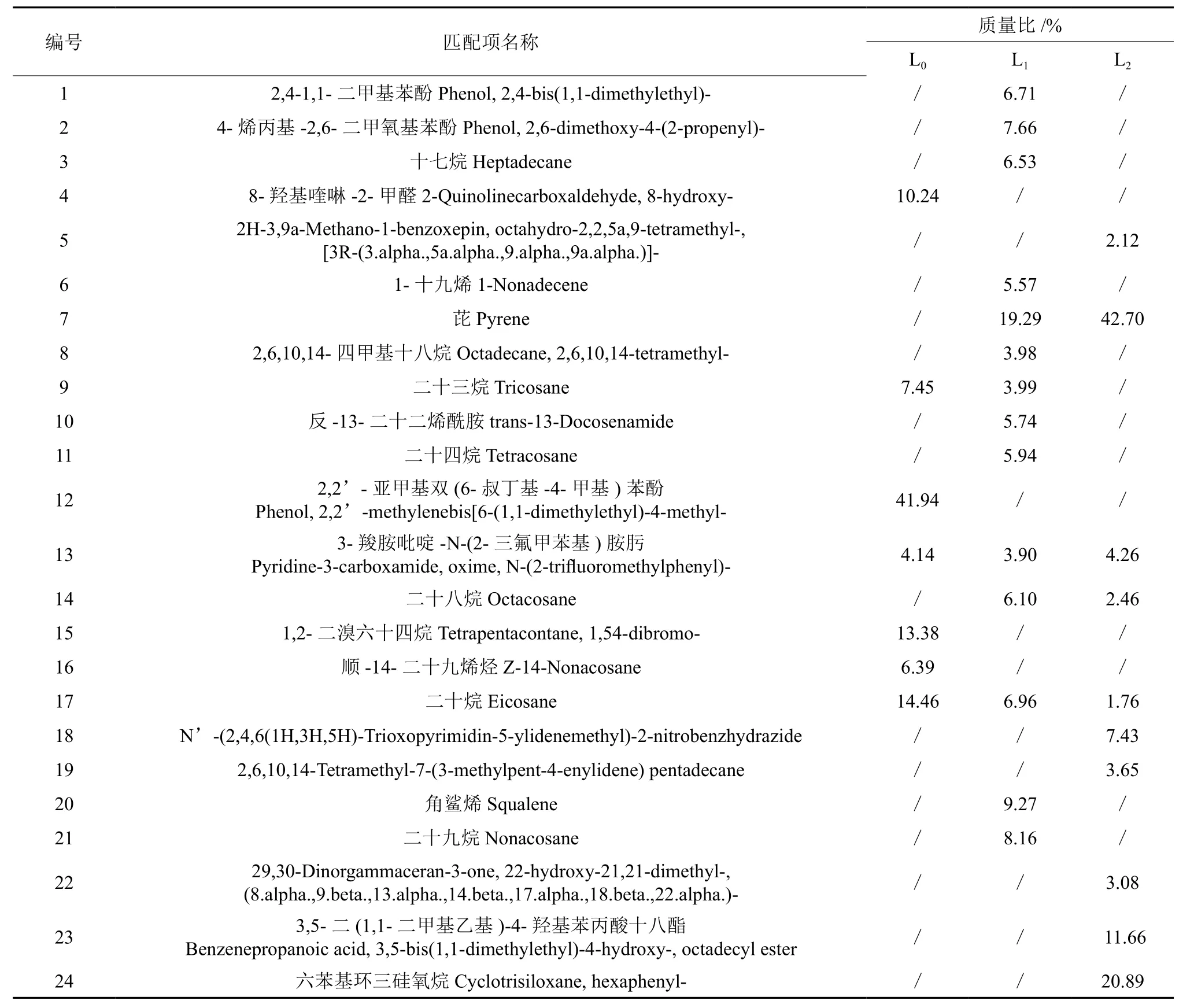
表2 3种处理水平下樟树根系分泌物中化学成分的比较Table 2 Comparison of component analysis of root exudate of Cinnamomum camphora under three levels
经L1处理,从栾树、樟树根系分泌物中检测到含量较高的为烷烃类、杂环类及芘类,其中检测到芘类的质量比分别为:13.62%、19.50%,烷烃类质量比分别为:33.71%、41.68%,杂环类化合物质量比分别为:12.21%、9.64%。十七烷、二十烷、1-十九烯、二十三烷、3-羧胺吡啶-N-(2-三氟甲苯基)胺肟这5类化合物在栾树樟树根系分泌物中均检测到。经L3处理,从栾树、樟树根系分泌物共检测到含量较高的有芘类、硅氧烷类,芘类质量比分别为:17.65%、42.71%,检测到硅氧烷类质量比分别为:30.89%、20.90%。
2.2 根活力分析
如图1-a,栾树根系总吸收面积范围为5.24~6.57 m2(见图1-a),樟树根系总吸收面积范围为3.90~5.26 m2。经L1和L2处理下栾树和樟树的根系总吸收面积均大于对照组,栾树经L2处理后吸收面积达到最大,L0处理与L1、L2处理之间差异性显著(P<0.05),樟树经L1处理吸收面积达到最大,L0处理与L1、L2处理之间差异性显著(P<0.05)。
栾树根活跃吸收面积范围为2.74~3.43 m2(见图1-b),樟树根活跃吸收面积范围为2.67~3.04 m2(见图1-b),栾树和樟树经L0处理下根系活跃总吸收面积最小,栾树根活跃吸收面积经L2处理下达到最大,L0处理与L1、L2处理下差异性显著(P<0.05),樟树经L1处理后根活性总吸收面积为最大,不同处理水平之间无显著差异(P>0.05)。

图1 不同芘处理根系总吸收面积、根活跃吸收面积Fig.1 Root acid absorption area and root acid phosphates activity in different pyrene treatments
栾树根系磷酸酶活性范围为62.96~69.56 nmol·g-1min-1,樟树根系磷酸酶活性范围为8.80~10.46 nmol·g-1min-1(见图2),栾树根系磷酸酶活性吸收面积经L1、L2处理后均大于对照组,L2处理后吸收面积最大,不同水平处理之间无显著差异(P>0.05)。樟树经L1处理下吸收面积最小,L2处理后吸收面积达到最大,不同处理之间没有显著差异(P>0.05)。栾树根系磷酸酶活性随着芘浓度升高吸收面积逐渐增大,樟树呈先下降后上升规律。
2.3 根系分泌物的TC、TN含量
如图3-a所示,栾树根系分泌物中测得总碳含量为9.80~28.78 mg/L, 大小为L0>L1>L2,总碳含量随芘浓度的升高,逐渐下降,各处理水平之间均存在显著性差异(P<0.05);樟树根系分泌物中测得总碳含量范围为4.86~9.44 mg/L,大小顺序为:L2>L0>L1,总碳含量随污染物浓度升高,出现先下降后上升的趋势,各处理水平之间存在显著性差异(P<0.05)。
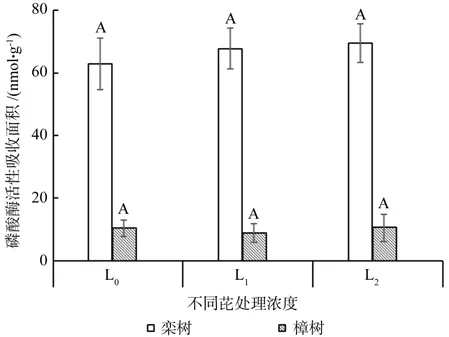
图2 不同浓度处理磷酸酶活性吸收面积Fig.2 The influence of the phosphatase activity in different pyrene treatments
图3-b可见,栾树根系分泌物中总氮含量范围为4.42~7.59 mg/L,大小顺序为:L1>L0>L2,随芘浓度的升高,总氮含量先上升后下降。L0处理与L1处理之间不存在显著差异性(P>0.05),L2处理分别与L0处理和L1处理之间存在显著差异(P<0.05)。樟树根系分泌物中总氮含量范围为1.59~5.55 mg/L(见图3),随芘浓度的上升,根系分泌物中总氮含量呈先下降后上升趋势,大小顺序为:L0>L2>L1,各处理之间均存在显著差异(P<0.05)。
2.4 植物苗高地径分析
如图4-a,栾树在不同浓度芘处理下苗高范围为43.7~63.93 cm,地径范围为0.35~0.48 cm。图4-b樟树苗高范围为55.7~69.63 cm,地径范围为0.49~0.62 cm(见图4)。栾树苗高及地径在L1处理下达到最大值,且L1处理水平下的苗高与其余处理水平间存在显著差异(P<0.05)。樟树苗高和地径经L1处理下为最大,苗高经L0处理与L1、L2处理差异性显著(P<0.05),地径经L1处理下与L0、L2处理之间存在显著差异(P<0.05)。

图3 不同芘浓度处理下根系分泌物中TC、TN含量Fig.3 Contents of TC and TN in root exudates treated with different pyrene concentrations

图4 不同芘浓度处理下植物苗高、地径Fig.4 Seedlings height and ground diameter with different pyrene concentrations
3 讨 论
3.1 不同浓度芘胁迫对根系分泌物成分及比重的影响
根系分泌物是植物体利用地下部分和环境之间进行能量、物质及信息交换传递的重要媒介,其分泌产物能改变根际生态环境,并对周围土壤环境产生影响,任何环境改变都会影响植物根系分泌物的种类和数量[17]。本实验研究发现,不同芘浓度胁迫下,明显改变了植物根系分泌物的组成成分及所占比例,与王姣龙[18]试验的紫玉兰根系分泌物在芘胁迫下成分均发生明显变化的研究结果相似。随着添加芘污染物浓度的升高,从根系分泌物中检测到芘含量也不断增加,说明植物根系对土壤中芘污染物有一定的吸收和富集作用。和郜红建等[19]研究了植物对土壤和水中的菲与芘的吸收能力,发现PAHs污染物主要被植物的根部吸收并富集。许超等[20]研究了芘处理下对玉米根系分泌的影响,发现种植玉米对芘的降解率在低浓度处理下为36%,高浓度在处理下为28.2%,均能促进土壤中芘的降解。以上研究都证明了植物根系分泌物能帮助土壤中多环芳烃的降解。但本实验未检测土壤中剩余芘含量,后期实验设计中应添加检测剩余污染物的含量,更好的证明植物根系对污染物的降解作用。
3.2 不同浓度芘胁迫对植物根系活性的影响
测定根系活性吸收面积、TC、TN含量及磷酸酶活性吸收面积,目的是为了研究植物根部在土壤中的吸收能力及根系分泌物的变化情况。栾树和樟树根系总吸收面积和活跃吸收面积在芘胁迫下均大于对照组;栾树TC含量逐渐上升,樟树先下降后上升;栾树TN含量先下下降后上升,樟树持续下降。本研究证明,芘胁迫下能促进根部活性吸收,与张力[21]实验樟树幼苗植物根系分泌物在多环芳烃的胁迫下,TOC、TN含量较其他浓度下值为最大,说明多环芳烃的添加对根系分泌能力有提高作用的结果相似。杨艳[22]等研究了4种PAHs对黑麦草根系分泌物的可溶性有机碳的影响,说明了多环芳烃胁迫下促进了根系的分泌作用,可溶性有机碳含量均高于对照组。这主要与细胞膜的选择透过性有关,当污染物侵害植物时,细胞膜会做出应激反应,膜的选择透过性会发生改变[23],从而引起植物根系分泌发生不同变化。而在污染物的胁迫下,植物根系分泌物具体的生理反应还有待进一步的研究证明。
3.3 不同浓度芘胁迫下对植物生长状况的影响
L1处理下,对栾树、樟树的生长有一定的促进作用,经L2处理有抑制作用。栾树经L1处理,苗高、地径均高于对照组和L2处理组;经L2处理,苗高、地径均低于L1处理。樟树经L2处理下,苗高高于对照组及L1处理(约3 cm),地径低于L1处理。樟树及栾树苗高在不同浓度胁迫下,生长状况不同,可能是由于樟树较栾树更为耐受。这一研究现象与其他学者相似,陆志强[24]等在沙培秋茄幼苗时发现:当浓度为0.l mg/L(低浓度)时芘和萘明显促进幼苗生长,当浓度升高到10 mg/L,幼苗苗高显著降低;沈小明[25]等研究发现菲胁迫影响玉米的生长状况,浓度为l mg/L时玉米的生物量增加,当浓度增加至5 mg/L以上时其长势受到抑制。以上现象可能是因为多环芳烃化合物是环状结构,与某些能促进植物的生长激素相类似[25],所以低浓度下的多环芳烃能促进植物生长。
4 结 论
在不同浓度芘胁迫下,从植物根系分泌物中均检测到芘,且随着污染物浓度的升高,芘所占比重不断增大,说明植物根部对芘污染物有一定的吸附能力。该实验未能检测砂石中剩余的芘含量,可以更科学的说明植物对污染物的降解功能,后期还有待更近一步研究试验。污染物的添加一定程度的促进了根部活动,影响其活性,后期可以检测植物根系分泌物的微生物生物量碳,进一步研究植物根系在受到胁迫时的反应。低浓度污染物的胁迫可以促进植物体的生长,高浓度胁迫会抑制植物生长。对比两种绿化树种可见,樟树对芘胁迫的耐受性优于栾树,本试验为进一步研究植物根系分泌物对PAHs污染胁迫提供基础理论,为城市建设绿化树种的选择提供科学依据。
