旱生芦苇对地下水位变化的生态响应及适应机制
2018-11-15玛丽娅奴尔兰刘卫国霍举颂李宏侠刘建国
玛丽娅·奴尔兰,刘卫国,*,霍举颂,李宏侠,张 雨,刘建国,徐 悦
1 新疆大学资源与环境科学学院,乌鲁木齐 830046 2 绿洲生态教育部重点实验室,乌鲁木齐 830046
受全球气候变暖及环境恶化的影响,水分已成为干旱半干旱区影响植物生长发育的重要因素[1]。而干旱区降水稀少,地下水作为植物生存所依赖的关键水源,其深浅成为限定植物获得水分的重要条件,从而对植物的光合生理特征具有重要影响[2- 4]。干旱区缺水环境导致植物受到水分胁迫,使植物体内活性氧积累,从而造成氧化胁迫[5]。为了保护自身免受伤害,植物细胞合成抗氧化酶及渗透调节物质有效地清除活性氧[6]。有关水分胁迫抗性的研究已在灌木、乔木中广泛开展,但取得结果和结论还存在一定的差别[6- 9]。
新疆阜康北沙窝位于古尔班通古特沙漠南缘,是我国典型的干旱荒漠区,沙区水资源严重稀缺,降水无法满足植物正常的生长需求[10- 11],地下水补给成为植物用水的关键部分[12- 14]。而旱生芦苇(Phragmitesaustralis)作为干旱区特有的自然生禾本科植物,其强大的根系在削弱沙尘暴、保护绿洲农田、改良盐碱地等方面具有一定的生态价值[15];此外,旱生芦苇常作为造纸原料和优质饲草具有一定的经济价值[16]。研究其对地下水位变化的生态适应性动态变化规律,对揭示干旱生境下植物的生存策略具有重要意义。
目前,有关芦苇生理生态研究较多,Deegan等[17]发现水位波动对芦苇生长起促进作用;Pagter等[18]认为水分亏缺影响芦苇生长、光合等生理特性。以往的研究多集中于探讨湿地芦苇的生态适应性[18- 21],而对旱生芦苇对地下水位变化的生态响应及适应机制的研究鲜有报道。因此,设计不同水位与植物光合生理特征之间的关系,可为深入探讨旱生芦苇对地下水位的生理生态特征响应机制提供基础数据。
基于以上,本文以旱生芦苇为研究对象,通过人工模拟四种地下水位梯度,在生长季不同阶段测定芦苇的生理指标,旨在探讨:(1)旱生芦苇对不同地下水位的生理生态适应机制;(2)不同地下水位旱生芦苇的生理特征的动态变化规律;(3)旱生芦苇生理指标间的相关性。以期探索荒漠植物对其土壤生长环境的适应性,为改善当地生态环境和植被恢复提供科学依据。
1 研究区与研究方法
1.1 研究区概况
本研究试验材料选取自新疆阜康北沙窝研究区,地处古尔班通古特沙漠(44°15′—46°50′N,84°50′—91°20′E)南缘。该区夏季炎热干燥,冬季寒冷,属典型的温带大陆性荒漠气候。年均气温6—10℃,最热月均气温为24—27℃,极端最高温达40℃以上。降水主要集中于春冬季,普遍不超过150 mm,荒漠腹地年降水量仅为70—100 mm,年蒸发量却大于2000 mm,干燥度很大[22]。该区沙生和耐旱植物种类较丰富,草本植物主要有芦苇(P.australis),灌木植被主要有梭梭(Haloxylonammodendron)、蛇麻黄(Ephedradistachys)、沙拐枣(Calligonummongolicum)、琵琶柴(Reaumuriasoongorica)等。
1.2 试验设计
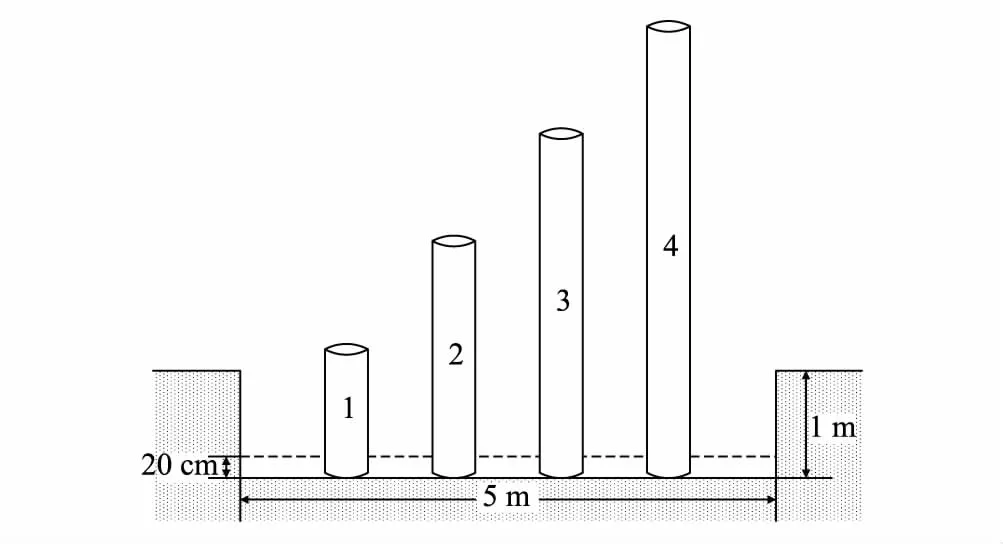
图1 试验装置侧面示意图Fig.1 Side view of the test device 虚线代表水槽中水面;1、2、3和4分别代表地下水位1、2、3 m和4 m
依据研究区水位调查(地下水位实测值范围:1.06—4.63 m),考虑实际可操作性和当地旱生芦苇的生长特性,地下水位设计了1、2、3 m和4 m共4个处理,每个处理3个重复。于试验地挖取3个水槽(长5 m,宽0.5 m,高1 m),将底部密封且用水泥做防水处置,每个水槽之间相隔3 m以上,保证互相不遮挡阳光。选取长度分别为1.2、2.2、3.2 m和4.2 m的聚氯乙烯(PVC)管(直径为40 cm)各3根,共计12根。将不同长度的4根PVC管设为一组,固定于水槽中(图1)。将古尔班通古特沙漠原状土过筛,又进行3次洗盐后晒干再装入PVC管中,保证每个PVC管内土壤一致。在当地选择长势一致,无病虫害的4年生旱生芦苇幼苗60株移栽至PVC管内,每根PVC管内移栽5株。移栽后每隔3 d浇一次水,不施肥,直到所有旱生芦苇幼苗长出2—3片新叶后停止浇水,并开始往水槽中注水,水槽水位保持在20 cm(隔4d浇1次水)。试验从2016年6月开始,同年9月结束。试验期间每月中旬选择晴朗天气测定旱生芦苇光合及生理指标,在每个梯度下随机选取具有代表性的3株旱生芦苇,在每株中上部选取3片健康叶片作为试验材料进行光合测定。同时采集同一叶位叶片放入铝盒,并立即装入液氮罐带回,在实验室测定叶片叶绿素(Chl)、可溶性糖(SS)、可溶性蛋白质(SP)、脯氨酸(Pro)、丙二醛(MDA)含量及超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性等生理指标,每一样品的各指标重复3次测量并求其平均值。
1.3 测定方法
1.3.1 气体交换参数的测定
在每月的中旬选择晴朗天气采用Li- 6400便携式光合测定仪(Li- 6400, Li-cor Inc, USA)测定芦苇的光合参数[净光合速率(Pn, μmol m-2s-1)、蒸腾速率(Tr, mmol m-2s-1)、气孔导度(Gs, mmol m-2s-1)、胞间CO2浓度(Ci, μmol m-2s-1)]的变化。每次测定重复3次取值,并取3组叶片作组内重复。
1.3.2 生理指标的测定
叶绿素含量的测定采用分光光度法[23]。采用硫酸苯酚法测定可溶性糖含量[24];可溶性蛋白质含量的测定采用考马斯亮蓝法[25];采用磺基水杨酸法测定叶片脯氨酸[26]。MDA含量的测定采用双组分光光度法[27];SOD活性测定采用氮蓝四唑法[27];CAT活性测定采用紫外吸收法[27]。
1.4 统计分析方法
本文利用SPSS 19.0中的双因素方差分析(Two-way ANOVA)检验不同地下水位和生长季不同阶段以及两者交互作用对旱生芦苇生理特征的影响,并利用单因素方差分析(One-way ANOVA)和LSD(Least-significant different)多重比较方法探讨旱生芦苇在不同地下水位及生长季不同阶段的差异,利用CANOCO 5.0中的冗余分析(RDA)以及Pearson相关分析探讨旱生芦苇生理因子对光合特征的影响。全文均采用Origin 9.0软件进行绘图。
2 结果与分析
2.1 不同地下水位和生长季不同阶段对旱生芦苇的影响
旱生芦苇光合生理参数均受地下水位和生长季极显著影响(P<0.01),两者交互作用对Pn的影响不显著(P>0.05),而对其他参数的影响均达到极显著水平(P<0.01)(表1)。对比地下水位和生长季因素F值发现,生长季变化对旱生芦苇Pn、Gs和SS、Pro、SP、MDA含量以及SOD活性变化的贡献大于地下水位差异,地下水位差异对旱生芦苇Tr、Ci、Chl含量和CAT活性贡献大于生长季的变化。
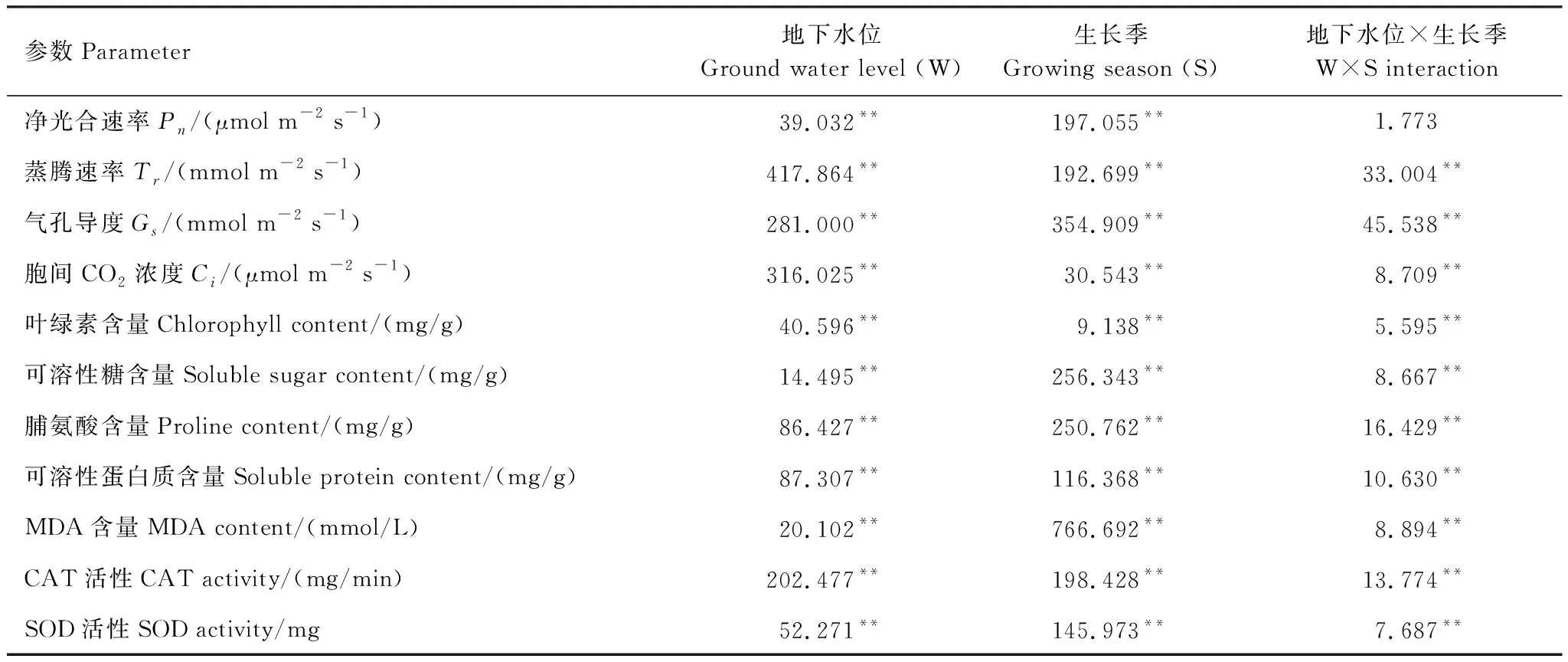
表1 不同地下水位和生长季不同阶段对旱生芦苇的影响的双因素方差分析
**表示在0.01水平上显著
2.2 不同地下水位旱生芦苇光合参数的动态变化特征
旱生芦苇Pn总体上随地下水位的下降呈先增后减的变化趋势,其生长季动态变化趋势符合单峰曲线,以生长最旺盛的8月为峰值(图2A)。生长季不同阶段Pn均表现为地下水位2 m大于其他3种水位,在地下水位4 m时达到最低值,其值随生长季的变化分别降低了18.0%、14.6%、14.2%和35.6%。6月Pn较低,在6.68—8.15 μmol m-2s-1之间,8月Pn最高,为10.30—12.01 μmol m-2s-1。
旱生芦苇Tr随地下水位的变化趋势及其生长季动态变化趋势均与Pn一致(图2B)。6 月、8月和9月Tr均在地下水位为2 m时最大,其他3种地下水位无显著差异(P>0.05);7月Tr表现为2 m地下水位最大,4 m地下水位最低,其值降低了82.6%。
旱生芦苇Gs随地下水位的变化趋势及其生长季动态变化趋势均与Pn和Tr变化趋势相似(图2C)。6月,Gs在地下水位2 m和3 m较大且无显著差异(P>0.05);7月,Gs在地下水位2 m最大,其他3种地下水位下差异不显著(P>0.05);8月,Gs表现为地下水位2 m大于1 m,其他两种地下水位下差异不显著(P>0.05);旱生芦苇Ci随地下水位的变化趋势及其生长季动态变化趋势均与Pn、Tr和Gs变化趋势相呼应(图2D)。6月Ci在2 m地下水位下最大,其他3种地下水位下差异不显著(P>0.05)。7月Ci表现为2 m和3 m地下水位下较大且无显著差异(P>0.05)。8月Ci在地下水位2 m最大,4 m最小,其他两种无显著差异(P>0.05)。
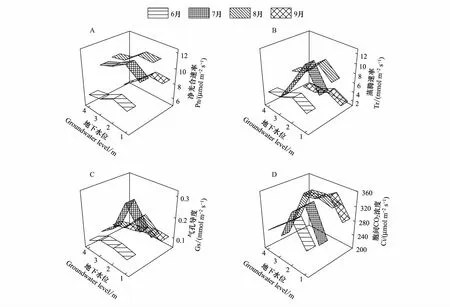
图2 不同地下水位旱生芦苇光合参数动态变化特征Fig.2 Dynamic characteristics of photosynthetic parameters of P. australis under different groundwater level
2.3 不同地下水位旱生芦苇Chl含量的动态变化特征
旱生芦苇Chl含量随地下水位的下降呈先增后减的变化趋势,但其随生长季变化的趋势则表现出较大的差异(图3)。不同地下水位Chl含量的变化规律均呈单峰曲线,以地下水位2 m为峰值。6月和9月不同地下水位Chl含量均表现为2 m>1 m>3 m>4 m,且2 m与1 m无显著差异(P>0.05),而与3、4 m差异性显著(P<0.05);7月和8月Chl含量均表现为地下水位2 m最大,与其他3种地下水位差异性显著(P<0.05),而其他三者间无显著差异(P>0.05)。
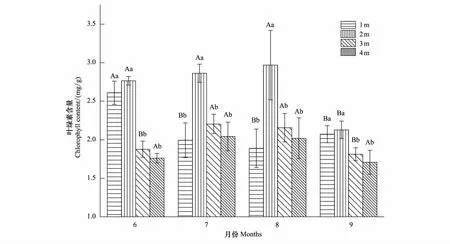
图3 不同地下水位旱生芦苇叶绿素含量的动态变化特征Fig.3 Dynamic characteristics of chlorophyll content in P. australis under different groundwater level不同小写字母表示该变量在不同水位间差异显著(P<0.05),不同大写字母表示该变量在不同月份间差异显著(P<0.05)
2.4 不同地下水位旱生芦苇细胞渗透调节物质含量的动态变化特征
旱生芦苇叶片Pro含量随地下水位的下降呈先增后减变化趋势,在地下水位2 m时达到最大值,但随生长季变化的动态特征各不相同(图4)。6月和9月Pro含量在地下水位为2 m时迅速积累达到最大值,且与其他地下水位差异性显著(P<0.05)。7月不同地下水位Pro含量变化表现为地下水位2 m与3 m和4 m无显著差异(P>0.05),而与1 m差异性显著(P<0.05)。8月不同地下水位Pro含量呈2 m>1 m>3 m>4 m变化趋势,且不同地下水位差异性均显著(P<0.05)。6月不同地下水位Pro含量最高且均与其他3个月差异性显著(P<0.05)。
旱生芦苇叶片SS含量随地下水位变化特征在生长季不同阶段表现出差异性,不同地下水位SS含量随生长季的动态变化呈增长趋势(图4)。6月不同地下水位SS含量呈快速增长趋势,在地下水位为4 m时达到最大值且与其他3个地下水位差异性显著(P<0.05)。7月不同地下水位SS含量呈增长趋势并在地下水位4 m时最大,与地下水位1 m差异性显著(P<0.05)。8月SS含量在地下水位为1—2 m时快速增加,地下水位为3—4 m时开始呈平缓下降趋势,不同地下水位无显著差异(P>0.05)。9月不同地下水位SS含量变化呈单峰曲线且以地下水位2、3 m为峰值,与地下水位1、4 m差异性显著(P<0.05)。不同地下水位SS含量随生长季的动态变化呈增长趋势,在9月达到最大值且与其他3个月差异性显著(P<0.05)。
不同地下水位旱生芦苇SP含量的变化规律呈“V”型曲线,且以地下水位2 m为最低值;生长季变化趋势一致,也呈“V”型曲线(图4)。6月SP含量在地下水位为2 m(最低值)时与其他三种地下水位差异性显著(P<0.05)。7月不同地下水位SP含量变化呈4 m>3 m>2 m>1 m且差异性显著(P<0.05)。8、9月SP含量在地下水位为1m时最大且与其他地下水位差异性显著(P<0.05)。地下水位为1、2 m时,6月与9月SP含量均无显著差异(P>0.05),而与7、8月差异性显著(P<0.05)。地下水位为3、4 m时,SP含量随生长季变化差异性显著(P<0.05)。
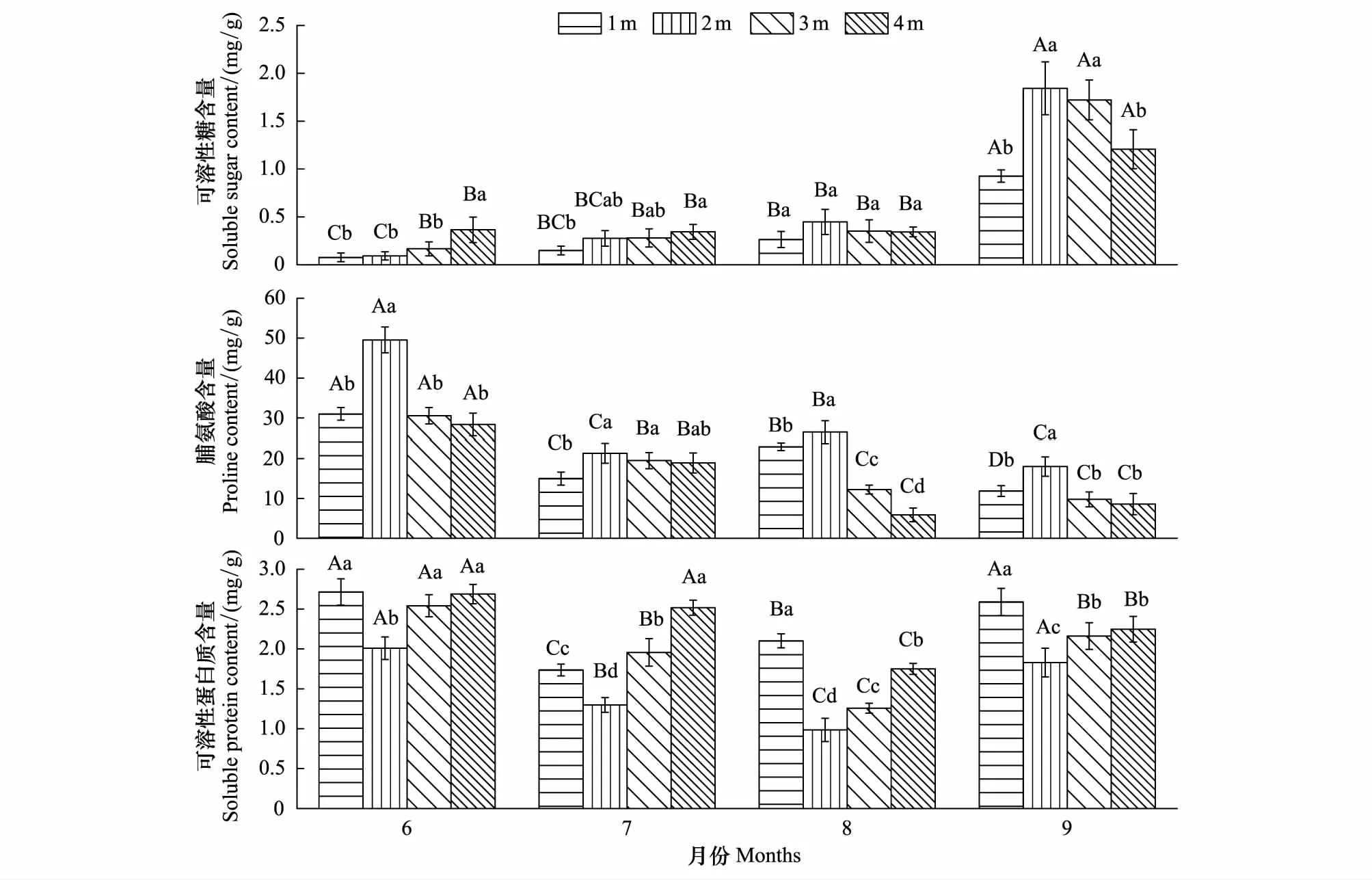
图4 不同地下水位旱生芦苇细胞渗透调节物质含量的动态变化特征Fig.4 Dynamic variation characteristics of Pro、SS and SP content of P. australis under different groundwater level
2.5 不同地下水位旱生芦苇叶片MDA含量和抗氧化酶活性的动态变化特征
旱生芦苇叶片MDA含量随地下水位的下降呈先增后减的变化趋势,在2时达到最大值;随生长季的变化,不同地下水位MDA含量呈增长趋势,并在9月达到最大值(图5)。6月不同地下水位MDA含量无显著差异(P>0.05)。7月MDA含量表现为地下水位2 m与1 m差异性显著(P<0.05)。8、9月MDA含量在地下水位2 m时均与其他地下水位差异性显著(P<0.05)。地下水位为2 m时,MDA含量随生长季动态变化差异性显著(P<0.05)。
随地下水位的下降,旱生芦苇叶片SOD和 CAT活性均升高(图5)。6月SOD活性表现为地下水位1 m与2 m无显著差异(P>0.05),而1、2 m与3、4 m差异性显著(P<0.05);CAT活性表现为地下水位4 m与其他地下水位差异性显著(P<0.05)。7、8月SOD活性表现为1、2 m与3、4 m差异性显著(P<0.05);CAT活性表现为地下水位4 m与其他水位差异性显著(P<0.05),地下水位2 m和3 m无显著差异(P>0.05)。9月不同地下水位SOD活性无显著差异(P>0.05);而CAT活性表现为1、2 m和3、4 m差异性显著(P<0.05)。2种抗氧化酶相比,干旱胁迫使SOD的含量提高幅度较大,其次是CAT,表明SOD对干旱胁迫反应更敏感,是旱生芦苇适应干旱胁迫的主要抗氧化酶。
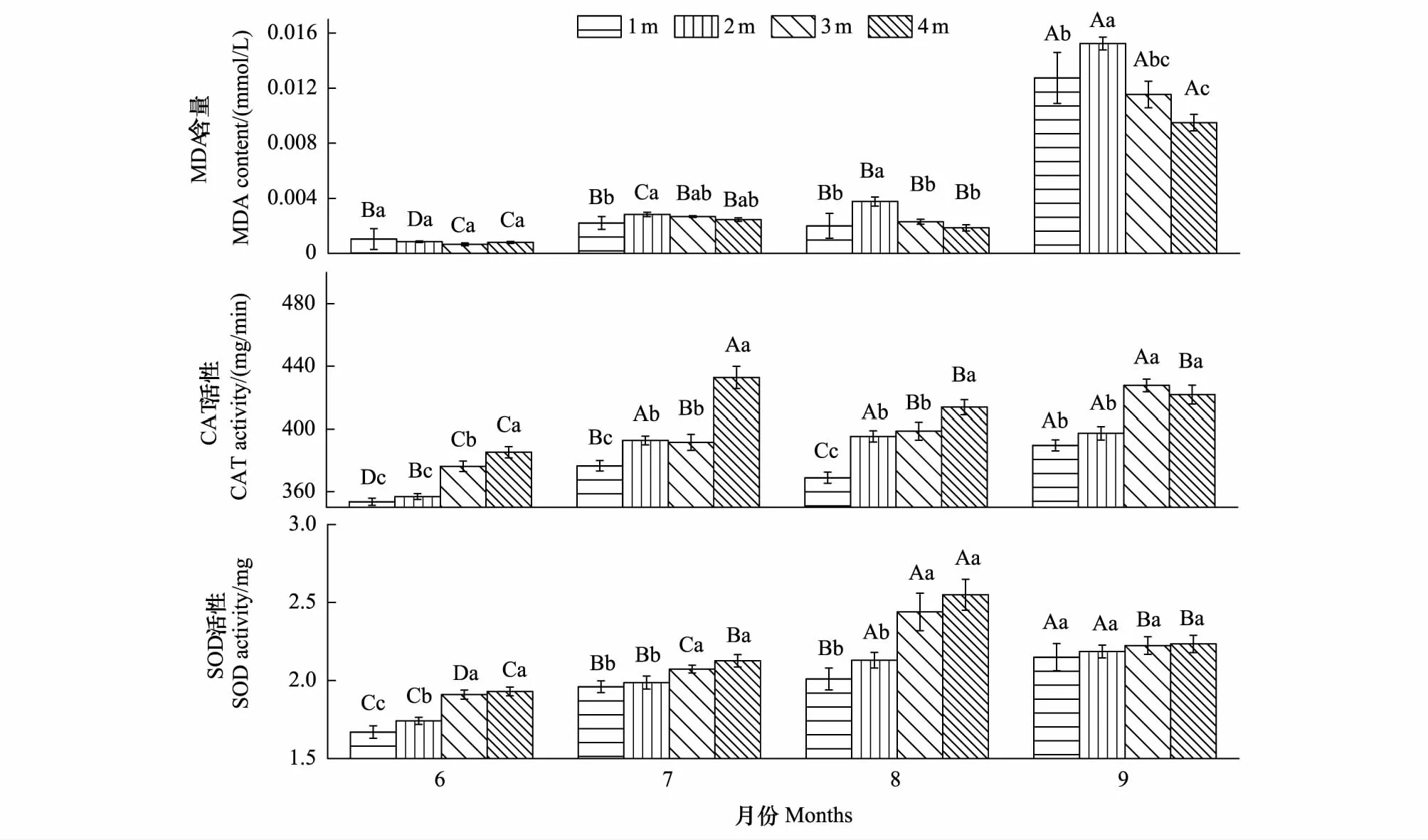
图5 不同地下水位旱生芦苇叶片MDA含量和抗氧化酶活性的动态变化特征Fig.5 Dynamic change characteristics of MDA content and SOD、CAT activity of P. australis under different groundwater level
2.6 旱生芦苇生理因子对光合特征的影响
旱生芦苇生理因子对光合特征影响的RDA分析表明,Chl和SP是影响旱生芦苇光合作用的重要驱动力(图6)。Pn和Gs相关性最大,Gs和Chl相关性最大。旱生芦苇生理因子对Pn的重要性大小顺序为Gs>SP>Chl>Tr>Ci>SS。主要生理因子均与旱生芦苇光合特征呈显著相关(表2),Tr、Gs、Ci、Chl和SOD与Pn呈正相关,而SS、SP、Pro、MDA和CAT却与之负相关;Pro、SOD、CAT与光合特征相关性均没有达到显著水平。
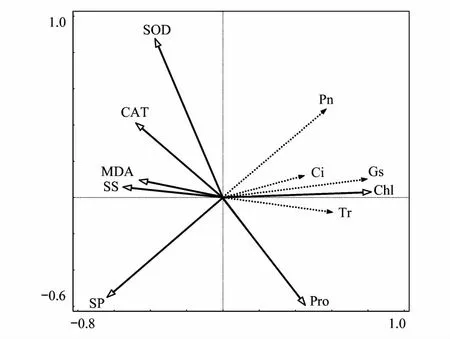
图6 旱生芦苇生理因子对光合特征影响的RDA分析Fig.6 RDA of physiological factors affecting photosynthetic characteristics in P. australis
3 讨论与结论
3.1 旱生芦苇对地下水位的光合响应特征
旱生芦苇作为古尔班通古特沙漠主要物种之一,其生长对沙漠生态环境起及其重要的作用。因此,探讨旱生芦苇适应极端干旱荒漠环境的生存条件和生理生态机制对保护珍稀濒危物种和促进区域生态恢复具有重要的意义。
光合作用是植物有机物质积累、生长发育的基础,受植物本身生理特性和环境因素的共同影响,其中地下水位的变化是影响光合生理过程的重要因素[28]。马赟花等[29]的研究结果显示浅水位抑制沙地芦苇的蒸腾光合作用。在本研究中,旱生芦苇光合指标在生长季不同阶段均随地下水位的下降而呈先增加后降低的变化趋势,在生长旺季(7或8月)均达到了较大值(图2)。旱生芦苇光合参数间均呈极显著的正相关(P<0.01)(表2),表明随地下水位的降低,旱生芦苇通过自我调节降低Gs从而降低Tr,以减少体内水分散失来应对土壤干旱,但同时也限制了CO2的吸收,导致Ci和Pn降低,这是旱生芦苇在长期进化过程中形成的一种自我保护方式。
已有研究表明旱生芦苇毛细根系在30 cm以内的土层分布密度最大,30—210 cm根重密度呈现波动起伏,210 cm以下根系逐渐减少[30]。部分地下水可以通过土壤的毛细上升作用将水分补充到植物根系分布的土壤区,使植物获得水分。地下水位为1 m时,土壤水分较充足,使根系处于水涝状态,在这种胁迫条件下旱生芦苇表现出的适应性就是气孔关闭,导致Gs、Ci下降。气孔作为水蒸汽逸出植物体和二氧化碳进入植物体的通道,它的关闭使Tr下降,进而影响了光合速率。该研究结果在刘永贤、曾祥难等[31]对烟草叶片的研究中表现出相似的适应性。地下水位为2 m时,旱生芦苇光和参数均达到最大值,表明其在此地下水位能充分利用水分,保持较高的光合效率来适应荒漠逆境,可见适宜旱生芦苇生长的最佳地下水位是2 m。地下水位在2 m之后,土壤根区获得水分较少,甚至无法获得地下水的补给,也直接导致Pn的下降[32],而Pn对Gs具有指示调节作用,光合作用处于优势时,Gs增大,劣势时Gs减小[33-34]。
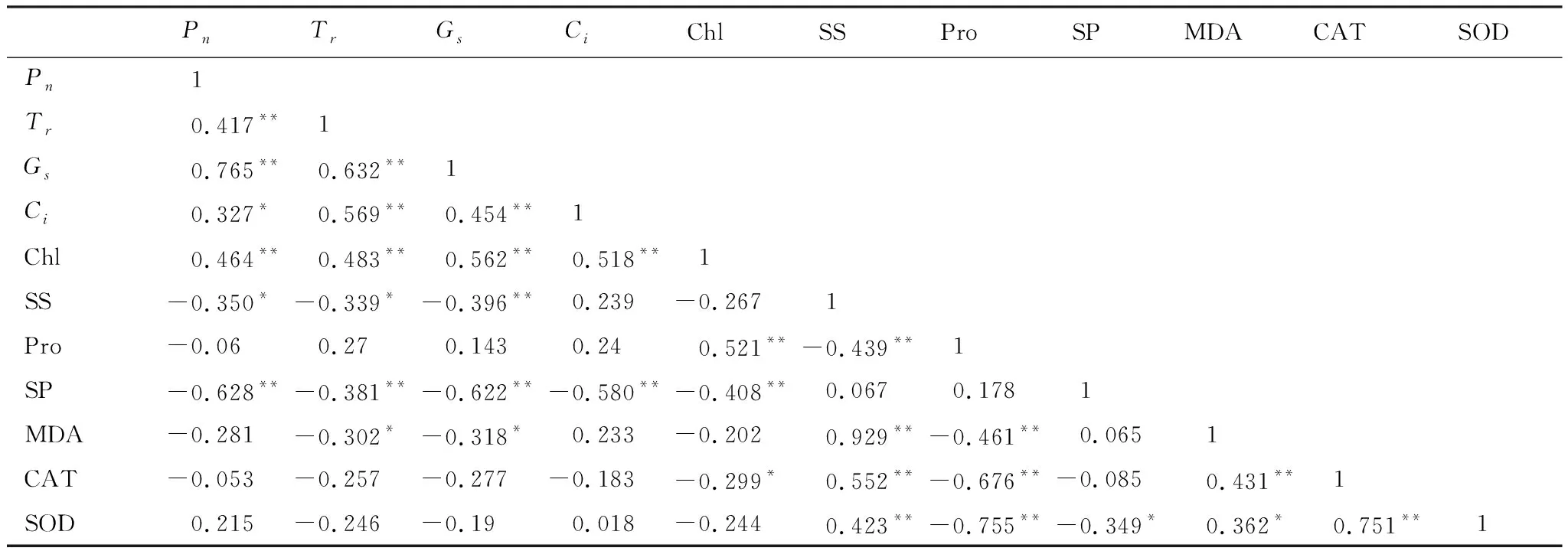
表2 旱生芦苇各生理因子间的Pearson相关系数
*,** 分别表示在0.05和0.01水平上显著
蒸腾作用是植物体内水分和物质运输的主要动力,植物根系吸收的水分主要消耗于蒸腾作用,旱生芦苇通过降低叶片Tr来防止其脱水死亡,这是植物适应干旱胁迫的有效途径。本研究与谢涛等[35]的研究结果相似,他们发现随土壤水分的下降,淡水沼泽芦苇叶片Tr呈先增加后下降的趋势。本研究中,降雨主要集中在6—8月,7月最高,为26.7 mm,降雨补充到土壤中,使旱生芦苇根区土壤水分含量较高,致其Pn、Tr高于其他干旱月份。而9月降水仅有0.3 mm,土壤极度干旱,由于缺水而使旱生芦苇生理活动下降。
3.2 旱生芦苇对地下水位的生理响应特征
前人大量研究了不同地下水位下植物Chl含量的变化。陈敏等[36]研究发现,随干旱胁迫的加剧,柽柳和芦苇叶片的Chl含量是不断减少的。曹昀等[37]研究表明在干旱胁迫下芦苇Chl含量降低。本研究中,随地下水位的下降,旱生芦苇Chl含量呈先增加后下降的变化趋势(图3),该结果与邓春暖等[38]对湿地芦苇的研究结果相似。不同地下水位下Chl含量变化的差异可能与干旱胁迫的强度以及旱生芦苇自身的生理特性有关,在地下水位为2 m时Chl含量达到最大值,可能是由于旱生芦苇叶片的相对含水量降低,增加了每克叶干重和细胞数,使叶片Chl含量增加,是植物受到干旱胁迫时维持较高光合效率的一种生理适应机制[39]。而地下水位在2 m之后,旱生芦苇受干旱胁迫程度加强,叶绿体的片层结构受到损伤,Chl含量减少,光合作用受到抑制,导致Pn有所下降。Chl与Pn、Tr、Gs、Ci和Pro均呈极显著的正相关(P<0.01)(表2),表明随地下水位的下降而引起的Chl含量的变化直接影响了旱生芦苇的光合生理过程。同时Chl含量的减少降低了叶片对光能的捕获能力,从而减少了光合系统受到的光氧化破坏,是植物适应干旱胁迫的光保护调节机制。不同地下水位Chl含量随生长季的动态表现出差异,总体在9月出现最低值且不同地下水位间无显著差异,表明在生长后期旱生芦苇叶绿体受到损伤,地下水位的变化对其影响不大。
植物通过调节体内渗透调节物质的含量来适应干旱胁迫,其中SS、SP和Pro是非常重要的三种渗透调节物质[40]。何开跃等[41]研究表明,木兰科5树种在干旱胁迫下SS含量升高,增强了其抗旱能力。Campos等[42]研究指出在干旱胁迫下Pro和SS的积累增加,能清除植物体内的活性氧,避免细胞膜质过氧化。本研究中,旱生芦苇SP含量与Pn、Tr、Gs和Ci均呈极显著负相关(P<0.01)(表2);SS含量与Pn和Tr呈显著负相关(P<0.05),与Gs呈极显著负相关(P<0.01)。表明SS含量和SP含量的变化对抵御干旱危害的贡献较大,它们能较快地清除活性氧,共同稳定了光合作用机构的功能,维持较高Pn。而Pro含量在地下水位≤2 m时虽有增加,但地下水位在2 m之后呈下降的变化趋势(图4)。SP在地下水位为2 m之后快速积累,从而提高植物的抗旱能力,可见旱生芦苇叶片的SS、SP和Pro在抑制干旱胁迫过程中存在相互补偿的关系,这与陈敏等[36]的研究一致,他们指出塔里木河中游的3种植物(胡杨、柽柳和芦苇)通过积累Pro与SS来增强抗旱性,且二者在抑制干旱胁迫过程中存在相互补偿关系。
干旱胁迫导致植物膜脂过氧化,MDA含量的变化反映了膜受伤害和膜脂过氧化的程度[43]。本研究中,地下水位在2 m时,MDA 含量积累并达到最大值(图5),旱生芦苇所受到的膜脂过氧化作用加强,表明地下水位在2 m时芦苇叶片受到干旱胁迫,芦苇通过积累MDA来抑制干旱胁迫对其叶片细胞膜的伤害。而地下水位在2 m之后,芦苇叶片也遭受相对较高的氧化损伤,但与此同时芦苇为了生存,适应干旱环境,通过增强抗氧化酶SOD和CAT活性,有效的清除了超氧离子,抵御膜脂过氧化作用,减轻质膜受损,减少MDA增生,缓解了脂质过氧化过程,使叶片MDA 的含量出现递减趋势,来抵御干旱胁迫,维持生长。这与龚春梅等[44]研究的芦苇在不同水分梯度上表现出来的抗氧化机理的结果一致。
3.3 旱生芦苇光合特征影响因子的比较
干旱环境对植物光合效率的抑制作用比较复杂,涉及到诸多生理生态因子,而且与实验植物的种类、生长状况以及处理方式密切相关[6,45-47]。RDA分析(图6)结果表明,Gs、Tr、Ci、Chl、SP和SS是芦苇叶片Pn的主要影响因子,其对Pn的重要性大小顺序为Gs>SP>Chl>Tr>Ci>SS。这表明旱生芦苇的Pn在气孔严格调控的基础之上,与叶片SP、Chl、Tr、Ci和SS存在紧密联系,Pn的变化是一个比较复杂的生理过程,受植物自身生理和环境因子的共同影响[48]。然而,光合作用受生理因子的影响会随着植物种类、土壤条件、天气状况的不同而发生较大的变化。付为国等[49]研究发现湿地芦苇叶片Pn与Tr和Gs存在显著相关性;周洪华等[50]研究得出胡杨叶片Pn主要受到光合有效辐射和大气CO2浓度的影响。植物往往通过自身生理因素和外界环境因子共同影响光合作用,而本研究则着重探讨了植物自身生理因素对其光合特征的影响,今后的研究工作需要结合植物的生理因素及环境因子,进一步探讨影响植物光合作用的生态因子及其作用机理,以综合评价荒漠植物对干旱环境的适应机制。另外,自然环境中的环境因子往往通过复杂的相互作用共同对植物产生影响,而本试验只考虑了地下水位一种因素。土壤养分、温度、光强等因子也是影响旱生芦苇生长的重要因素,它们与水分之间如何共同对旱生芦苇产生影响,旱生芦苇对这些生态因子综合作用的适应性如何,都是值得进一步深入研究的内容。
3.4 结论
(1)随地下水位的降低,旱生芦苇光和参数(Pn、Tr、Gs和Ci)均呈先增后减的变化趋势,在地下水位为2 m时均达到最大值,可见适宜旱生芦苇生长的最佳地下水位是2 m。
(2)旱生芦苇通过Chl含量的变化来适应干旱胁迫以维持较高光合效率;Pro、SS和SP含量在抑制干旱胁迫过程中存在相互补偿的关系;MDA含量呈先增后减的变化趋势来抑制干旱胁迫对其叶片细胞膜的伤害;SOD比CAT对干旱胁迫反应更敏感,是旱生芦苇适应干旱胁迫的主要抗氧化酶。
(3)旱生芦苇生理因子对Pn的重要性大小顺序为Gs>SP>Chl>Tr>Ci>SS,表明Pn在气孔调控的基础之上,与叶片SP、Chl、Tr、Ci和SS存在紧密联系。
