繁殖期高体鳑鲏对化学预警信息的行为响应及其与生理状态的关联
2018-11-15付世建夏继刚
张 嫱,付世建,夏继刚
重庆师范大学生命科学学院,进化生理与行为学实验室,重庆市动物生物学重点实验室, 重庆 401331
与陆生动物相比,由于受到水体透明度、浊度等生态因子的制约,鱼类的视觉通讯受到很大限制,依赖于嗅觉系统的化学通讯成为鱼类生存的必要选择[1]。1942年,Frisch最先发现并报道了欧洲真鱥(Phoxinusphoxinus)化学预警信息(Chemical alarm cues, CAC)的释放及其功能[2]。后来的研究发现证实:骨鳔总目中的大多数鱼类,例如鲤科(Cyprinidae)、鲶科(Siluridae)、脂鲤科(Characidae)、慈鲷科(Cichlidae)和鲑科(Salmonidae)等鱼类均可分泌CAC[3]。CAC是由鱼类表皮棒状细胞分泌的一种次黄嘌呤- 3-N-氧化物(Hypoxanthine- 3-N-oxide)或一组功能相似的化合物,当鱼体受到来自捕食者等外界的机械性损伤时释放至水体,可引起同伴迅速的预警/反捕食响应[4- 6],从而提高种群的整体适合度。由于其重要的生态学功能,CAC在鱼类行为学、水域生态学、进化以及保护生态学等领域已备受科学家重视,相关研究正逐渐成为热点。
对CAC的识别与应答体现了鱼类在特定生理状态和特定环境下的生态策略,与动物的生存适合度密切相关[6- 8]。尽管CAC对鱼类的生存至关重要,然而由于鱼类CAC的产生及其行为应答本身是一种较为耗能的生理过程[9- 10],在不同生活史阶段鱼类往往面临基于能量供需的“生存-繁殖”、“生存-发育”等的权衡(Trade-offs)。例如,我们前期研究发现,生活史早期孔雀鱼(Poeciliareticulata)仔鱼并不表现出对同生群个体CAC的行为应答,但发育14 d后的仔鱼却表现出显著的行为回避响应[6]。由于繁殖是一种高能耗的生命活动[6, 11],繁殖期鱼类的化学预警通讯是否表现出基于能量代价-收益(Cost-benefit)的权衡?
迄今为止,有关非繁殖期鱼类对CAC的行为响应及其生态机制已有较多研究报道[9, 12- 13],仅有少量学者探究了繁殖期鱼类的化学预警通讯。有趣的是,研究发现某些硬骨鱼类繁殖期CAC的产生及其行为应答模式缺失[14- 15](这也是很多学者在鱼类化学预警通讯研究中避开繁殖期的主要原因),并且该变化特征显著受到性别的影响。例如,繁殖期雄性黑头呆鱼(Pimephalespromelas)无产生CAC的细胞而雌鱼有[14];繁殖期不同性别曲口鱼(Campostomaanomalum)产生CAC的细胞均大量缺失[15];繁殖期盲鲃(Caecobarbusgeertsi)虽然保留了其体内用于产生CAC的细胞,但却对CAC无行为响应[16];类似地,生殖洄游期间太平洋鲑鱼(Oncorhynchusnerka)对同伴遭遇应激刺激后所释放信号的行为响应也存在性别差异[17]。那么,繁殖期鱼类对CAC的行为应答又是否存在性别差异?繁殖投入是否是鱼类化学预警通讯弱化的主要原因呢?
为探究以上科学问题,本研究选取具有特殊繁殖方式的高体鳑鲏(Rhodeusocellatus)作为实验对象。高体鳑鲏隶属于鲤形目鲤科鳑鲏属,是一种小型淡水鱼类,广泛分布于池塘、湖泊以及河湾缓流浅水区。该物种与河蚌(Unionidae)是共生关系,繁殖能力较弱,繁殖时通过产卵管(Oviduct)将卵产至河蚌的外套腔内,同时雄鱼在河蚌入水孔附近排精,精子随水流入外套腔完成受精,最终受精卵在河蚌鳃瓣中发育成幼鱼后游出[18]。与大多数鱼类相比,高体鳑鲏的繁殖投入较低(非卵胎生生殖方式、无生殖洄游、无筑巢行为、无抚幼行为,产卵量和性腺指数较低),据此推测:①繁殖期高体鳑鲏的化学预警通讯不会缺失(推测一),②但繁殖投入较高的个体行为响应较弱(推测二)。高体鳑鲏号称“中国彩虹”、“水中蝴蝶”,尤其在繁殖期雄性个体由于性选择的作用体色格外鲜丽,这将可能增加其被捕食风险,但雌鱼体色却无巨大变化,加之雄性相对较少的繁殖投入,③繁殖期高体鳑鲏的化学预警响应存在性别差异,即雄鱼较雌鱼对CAC的行为响应程度更大(推测三)。
1 材料与方法
1.1 实验动物
高体鳑鲏于2017年5月捕捞自重庆师范大学进化生理与行为学实验基地鱼塘(该鱼塘面积约为0.4669hm2,自然生态系统已维持十年以上),并于实验室条件下驯养适应2 d。驯养水槽长200 cm、宽100 cm、高50 cm,实际水深30 cm,驯养用水抽取自池塘。驯养期间,水温(24±1)℃,溶解氧大于6 mg/L,驯养密度低于0.12 g/L,光周期12 L∶12 D;每日早晚(08:00 am和06:00 pm)以商业饵料各饱足投喂1次。驯养结束后,选取健康活泼、大小相近、处于繁殖Ⅳ期的个体开展实验。
1.2 实验方案
1.2.1 CAC制备
选取大小相近的性成熟高体鳑鲏(雌鱼:体重(0.61±0.049) g、体长(3.14±0.055) cm,n=11;雄鱼:体重(0.83±0.074) g、体长(3.32±0.092) cm,n=10)用于预警物质的制备。首先将实验鱼钝击后断头处死,迅速剥离身体两侧的皮肤组织并精确计算出其面积大小,之后,将所剥离的皮肤组织混合加入一定量的水(鱼塘池水)低温匀浆,充分破碎皮肤细胞,过滤,并最终配制成10 mL/cm2的目标溶液(CAC)[6, 8]。将目标溶液及时分装至若干10 mL的小袋中于-20℃冷冻保存并于一周内用于实验研究。
1.2.2 行为学测试
实验观测设备为自制的方形水槽(长60 cm、宽10.5 cm、高60 cm)。将单尾实验鱼转移至实验水槽(实际水深为30 cm),并给予15 min的适应期(依据预实验研究结果,15 min后绝大多数实验鱼恢复自发游泳状态)。适应结束后,用摄像头(Logitech Webcam Pro 9000,15帧/s)拍摄记录实验鱼的行为响应,拍摄时间为5 min(Pre-test);采用注射器将CAC(实验组)或鱼塘池水(Pool water, PW; 对照组)10 mL通过管道缓缓推入实验水槽(操作时间为30 s并给予30 s的加样操作恢复期);之后,接着拍摄记录5 min(Post-test)。实验共使用测试水槽4个,其中两个用于实验组(被试雌雄实验鱼各一个),两个用于对照组(被试雌雄实验鱼各一个);每做完一个重复,将所有实验水槽冲洗三遍,确保无CAC及被试鱼化学信息残留。用于行为学测试的雌雄实验鱼处理组和对照组均为20尾(n=20)。视频录制期间,水温水质条件与驯养期间保持一致。
采用Noldus动物运动轨迹跟踪软件(EthoVision XT 9.0, Noldus, Netherlands)对视频进行分析。通过对实验鱼空间分布状态(底栖时间)、活跃状态(静止时间、运动距离和身体不重合度,其中静止状态的判断标准为实验鱼的图心位移小于1 cm/s)、逃逸行为(高速运动时间,即运动速度大于30 cm/s的时间)的解析来量化实验鱼的预警响应。本研究中,空间分布状态、活跃状态、逃逸行为分别被看作是实验鱼的I级、II级和III级预警响应。
1.2.3 形态及生理参数测定
视频录制结束后,将实验鱼用MS- 222麻醉,检测其健康状况并用分析天平和直尺测定体重、性腺重、体长、产卵管长度(Oviduct length,OL)等,并依据以上参数计算出肥满度(Condition factor,CF)和性腺指数(Gonado somatic index,GSI)(表1)。
CF=(m/L3) × 100,式中L为体长,m为体重;
GSI=m′/m× 100,式中m′为性腺重,m为体重。
1.3 数据分析
应用SPSS软件(SPSS 19.0 Inc., USA)对数据进行统计分析。首先对实验数据进行正态性和方差齐性检验。若数据满足正态性和方差齐性,采用双因素方差分析和Tukey′sHSD多重比较检验差异显著性;若数据不满足正态性和方差齐性,采用Scheirer-Ray-Hare分析[19]检验差异显著性,采用Mann-Whitney U检验分析实验鱼对PW和CAC的响应,采用Sign检验分析实验前后(Pre-test vs. Post-test)动物行为的变化,Spearman相关分析检测实验鱼行为变化与其生理参数(性腺指数GSI、产卵管长度OL、肥满度CF)的关联。数据均以平均值±标准误表示,显著性水平设在P<0.05。

表1 高体鳑鲏形态及生理参数
数据以平均值±标准误表示(n=20)
2 结果

图1 化学预警信息对不同性别高体鳑鲏空间分布的影响 Fig.1 The effects of chemical alarm cues and gender on the spatial distribution of Rhodeus ocellatus*表示引入信息前后底栖时间的显著差异(P<0.05); #表示引入不同信息后底栖时间的显著差异(P<0.05),PW: 池水 Pool water; CAC: 化学预警信息 Chemical alarm cues
2.1 高体鳑鲏空间分布对CAC的响应
CAC对雌性实验鱼的底栖时间影响显著(P<0.05,表2,图1)。不同性别鳑鲏底栖时间对CAC的响应无显著差异(P>0.05,表2,图1)。
2.2 高体鳑鲏活跃状态对CAC的响应
CAC对雌雄实验鱼静止时间和身体不重合度影响显著(P< 0.05,表2);CAC仅对雌性实验鱼的运动距离影响显著(P<0.05)。不同性别实验鱼静止时间、运动距离和身体不重合度对CAC的响应无显著差异(P>0.05,表2,图2)。
2.3 高体鳑鲏逃逸行为对CAC的响应
CAC对实验鱼的高速运动时间无显著影响(P>0.05,表2,图3)。不同性别实验鱼高速运动时间对CAC的响应无显著差异(P>0.05,表2,图3)。
2.4 高体鳑鲏化学预警响应与繁殖生理状态的关系
除了高速运动时间的变化与性腺指数(GSI)呈现弱负相关(r=-0.445,P<0.05,表3,图4),实验鱼其余化学预警行为参数的变化与GSI、产卵管长度(OL)、肥满度(CF)等均无显著相关性(P>0.05; 表3; 图4)。

表2 化学信息和性别对高体鳑鲏行为响应参数的影响
*P<0.05,差异显著

表3 高体鳑鲏化学预警响应的变化与其繁殖生理状态的关系
*P<0.05,差异显著

图2 化学预警信息对不同性别高体鳑鲏活跃性的影响Fig.2 The effects of chemical alarm cues and gender on the activity of Rhodeus ocellatus*表示引入信息前后活跃状态的显著差异(P<0.05);#表示引入不同信息后活跃状态的显著差异(P<0.05)

图3 化学预警信息对不同性别高体鳑鲏逃逸行为的影响 Fig.3 The effects of chemical alarm cues and gender on the escape behavior of Rhodeus ocellatus*表示引入信息前后逃逸行为的显著差异(P<0.05);#表示引入不同信息后逃逸行为的显著差异(P<0.05)
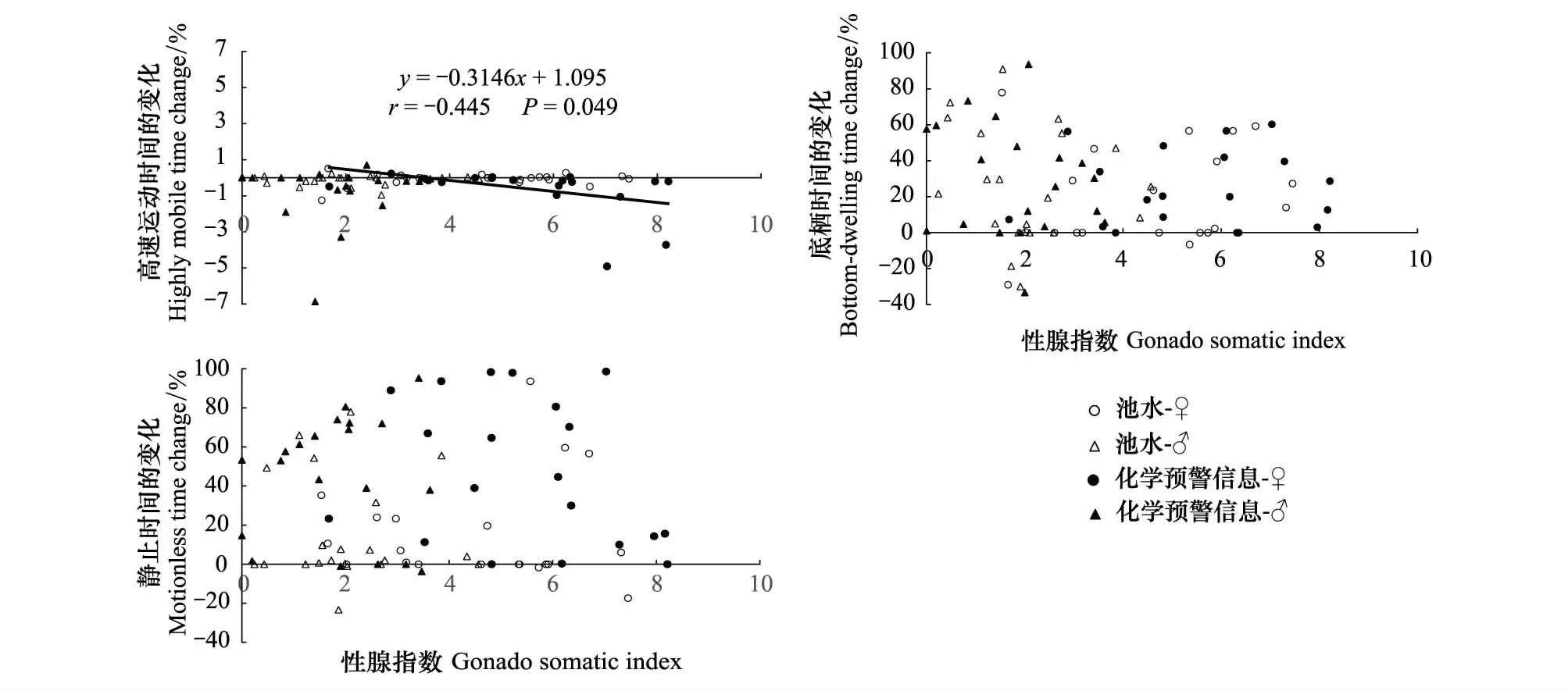
图4 高体鳑鲏性腺指数与其化学预警行为的关系Fig.4 The relationships between gonado somatic index and the changes of behavioral responses to chemical alarm cues in Rhodeus ocellatus
3 讨论
3.1 繁殖期高体鳑鲏对CAC的行为响应及其性别差异
本研究中,将高体鳑鲏对CAC的应答分为三级行为响应,其重要特点分别是“底栖”、“静止”、“逃逸”。与已有的大多数研究结果不同[14- 16],本研究证实了繁殖期高体鳑鲏依然展现出一定程度的化学预警通讯,主要体现在底栖时间和静止时间增加、运动距离和身体不重合度下降(研究结果支持“推测一”);这表明繁殖期高体鳑鲏对CAC展现出较为温和的行为应答模式(I级和II级)。另一方面,由于繁殖期鱼类的游泳能力降低并且运动所需的能量代价增大,逃逸行为(III级)作为高耗能的行为应答,其对CAC的非显著变化提示该物种可能存在基于能量代价-收益(Cost-benefit)的权衡。此外,值得注意的是,加样(加入PW或CAC)前后高体鳑鲏的行为也有一定的变化(图1—3),提示繁殖期该物种对于物理刺激也有反应。
对多数鱼类而言,由于体型、体色、繁殖投入等的差异,不同性别个体的反捕食行为往往差异较大。例如,不同性别红剑尾鱼(Xiphophorushelleri)的预警响应差异显著,当红剑尾鱼感知到化学预警信息时,雌性的底栖时间以及占用避难所的时间显著高于雄性[20]。性别二态性使其获得最大化的生存收益,即:雄性流线型的体型既不易被捕食又不会丧失觅食和寻找配偶的机会;雌性的身型限制了其逃逸能力,避难和底栖行为才能保证其安全[20]。本研究中,高体鳑鲏虽具性别二态性,但对CAC的应答无性别差异(研究结果不符合“推测三”),研究结果提示:尽管由于性选择的作用繁殖期雄性个体色鲜丽,但是否这种体色的变化增加其被捕食风险有待于进一步研究。
3.2 繁殖期高体鳑鲏对CAC的行为响应与其生理状态的关联
GSI和CF作为鱼类性腺发育和能量储备状况的重要指标,为评估鱼类的繁殖投入提供了参考。Pollock 等研究发现,繁殖期黑头呆鱼的CF、GSI均与其反捕食行为无统计学意义上显著相关性,但GSI与反捕食行为存在负相关趋势[21]。然而,Bachman 1993发现,CF较低的Belding′s地松鼠(Spermophilusbeldingi)警戒响应更弱[22]。本研究显示:繁殖期IV高体鳑鲏化学预警行为的变化与其生理状态(GSI、CF、OL)无显著相关性(研究结果不符合“推测二”),研究结果与Pollock等类似[21],但原因不尽相同。Pollock等认为,实验室驯养导致的鱼体生理状况同质化是造成黑头呆鱼化学预警响应与生理状态不相关的主要因素;本研究对象为高体鳑鲏野生种群,造成上述结果的原因可能有以下几个方面:
其一,高体鳑鲏与河蚌是共生关系,通过河蚌完成受精以及胚胎和仔鱼发育,繁殖投入较低。尽管实验对象为野生种群,相对而言,鱼体生理状况仍趋近同质化。从这一点考虑,造成高体鳑鲏化学预警行为与生理状态不相关的原因本质上与Pollock等相近。
其二,由于繁殖投入低,高体鳑鲏对CAC的行为响应可能更多的与其个性行为(Personality)有关[23],而受繁殖状态的影响小。本研究中,高体鳑鲏的个性行为可能掩盖了繁殖状态的效应,进而导致化学预警行为与生理状态不相关。
其三,从进化生态学的视角来看,鱼类的化学预警通讯反应了鱼类在特定生理状态和特定环境下的生态策略。CAC为鱼体遭遇捕食者等外界的机械性损伤时释放至水体,引起同伴预警/反捕食响应,对提高种群生存适合度显然是有利的;然而,繁殖期鱼类的集群性不强,化学预警通讯相对低效,在这种情况下,鱼类对CAC的行为响应程度可能更多的与其社群等级地位、被捕食经历等有关,而受生理状态的影响较弱。
综上,CAC在鱼类捕食-反捕食功能关系中扮演重要角色,然而,在特定的生境和生理状态下动物通常面临基于能量代价-收益的权衡。尽管少量研究发现某些硬骨鱼类繁殖期CAC的产生及其行为应答模式缺失,但我们推测这种现象并不是普遍存在的(本研究已经证实繁殖期高体鳑鲏依然展现出一定程度的化学预警通讯);与Pollock等研究结果类似[21],尽管本研究也未检测到鱼类化学预警行为的变化与繁殖生理状态的相关性,但我们推测这种相关性的有无/强弱在不同鱼类中可能差异较大,在未来研究中着眼于繁殖期不同繁殖投入/繁殖对策鱼类的化学预警通讯的比较生理学与进化生态学研究是十分必要的。
