氟喹诺酮类抗生素在农业紫色土中的吸附研究①
2018-11-15李余杰姚娟娟翁张帆
王 畅,李余杰,张 智,姚娟娟,卢 鹏,杨 潞,翁张帆
氟喹诺酮类抗生素在农业紫色土中的吸附研究①
王 畅,李余杰,张 智*,姚娟娟,卢 鹏,杨 潞,翁张帆
(重庆大学三峡库区生态环境教育部重点实验室,重庆 400044)
抗生素被广泛作为抗菌药物和添加剂使用在畜牧业中,造成大量抗生素随着动物粪便进入到土壤环境。吸附行为是抗生素在土壤中迁移转化的重要过程,对抗生素的风险评估及污染控制具有重要的意义。本文采用吸附试验研究了两种氟喹诺酮类抗生素(诺氟沙星(NOR)和氧氟沙星(OFL))在重庆广泛分布的紫色土中的吸附特性以及影响因素。结果表明:NOR和OFL在紫色土上的吸附过程较快,5 h就能达到吸附平衡,吸附常数K能达到3 082 L/kg。Freundlich吸附等温模型能很好拟合紫色土对NOR和OFL的等温吸附过程。由吸附过程的吉布斯自由能Δ和吸附能可知,紫色土吸附NOR和OFL主要是通过物理吸附。溶液pH>6会降低紫色土对NOR和OFL的吸附。当溶液离子强度从0.005 mol/L增加至0.05 mol/L时,NOR和OFL在紫色土上的吸附量分别降低了10.2% 和11.7%。土壤有机质对NOR和OFL的吸附过程影响很小。
诺氟沙星;氧氟沙星;紫色土;吸附
在全球范围内,抗生素已经广泛应用于畜牧业以促进动物生长和防治动物疾病。2013 年,我国抗生素的消费量达16.28万t,其中大约52% 用于畜牧业[1]。抗生素进入动物体内并不会被完全吸收,约30% ~ 90%的抗生素及其代谢产物经动物的粪便和尿液排出体外[2-3]。大量抗生素会随着农业施肥等过程进入土壤环境[4-5]。环境中大量抗生素的存在会促使微生物耐药性的增加,产生抗性基因,对人体健康和生态安全造成威胁。氟喹诺酮类抗生素(FQNs)是一类常用于治疗动物细菌感染的药物,使用量大,常见的药物包括诺氟沙星(NOR)、环丙沙星(CIP)、氧氟沙星(OFL)、恩诺沙星(ENR)等,在土壤中残留的浓度也相对较高[1,6-8]。Xie等[7]在广东省表层土壤中测出FQNs的含量为27.8 ~ 1 537.4 μg/kg,Li等[8]在山东省土壤中ENR、CIP、NOR的最高检出浓度分别为166.9、651.6、288.3 μg/kg。
土壤环境中的抗生素虽然可以被土壤微生物降解或以光解和水解的形式被降解,但是降解速度比较缓慢,同时抗生素也会在雨水淋溶或灌溉条件下随水流向下层土壤迁移。相关研究也表明,FQNs在淋溶条件下可以向下层土壤迁移,污染地下水。张旭等[9]采用0.01 mol/L CaCl2溶液淋溶含有不同浓度FQNs的赤红壤,发现NOR的迁移性最强,在酸性条件下淋溶5 d,FQNs可以迁移至90 cm深度土层中。Chen等[10]对北京和常州的地下水进行采样检测,发现NOR、OFL、ENR的检出率达到了100%,最大浓度为96.8 ng/L。吸附过程对抗生素在土壤中的迁移行为有着非常重要的影响,通过研究吸附过程有助于了解抗生素在土壤中的迁移性质及其环境风险[4-5]。
紫色土在我国西南地区广泛分布,在联合国粮农组织分类系统中属于粗骨土,在美国农业部分类系统中属于新成土,由紫色母岩及其快速风化物发育而成,保留着母岩的诸多性质[11-12]。紫色土中正长石、角闪石、云母、盐基含量丰富,但有机质含量不高,矿物养分含量较高,全磷可达1.5 g/kg,铁铝氧化物形态与其他类型的土壤也存在差异。考虑到土壤理化性质和各地区气候环境的差异,不同类型的土壤对抗生素的吸附可能也存在一定的差异,采用其他国家或地区的土壤研究数据来推断紫色土对抗生素的吸附过程并不能真实反映其环境行为。因此本文选取重庆地区的农业紫色土作为供试土壤,通过吸附试验研究紫色土对NOR和OFL的吸附特性以及环境条件的影响,为今后抗生素的环境风险评估和污染控制提供科学依据。
1 材料与方法
1.1 试验材料
诺氟沙星(NOR)和氧氟沙星(OFL)标准品(纯度>99.9%)购于上海阿拉丁生化科技股份有限公司,乙腈(色谱纯)购自韩国Honeywell公司。其余试剂均为分析纯,购自成都科龙化工试剂厂。实验用水为优普超纯水公司UPH系列(中国,成都)制备的去离子水(18.25 MΩ/cm)。将NOR和OFL固体粉末溶于甲醇中,配置成浓度为500 mg/L的标准储备液,在277 K和黑暗条件下保存,90 d内使用完毕。标准工作液通过稀释标准储备液获得。
供试紫色土样品采自重庆潼南(30° 01′37.87″ N,104° 44′17.53″ E,海拔426 m)蔬菜地5 ~ 20 cm 土层。该菜地主要种植的作物为叶类蔬菜。土样经风干、研磨和过筛后备用,其基本理化性质见表1。土壤样品中未检测出NOR和OFL。

表1 供试紫色土壤理化性质
1.2 吸附试验
采用OECD-106-2001实验方法进行吸附试验。称取2 g灭菌的紫色土于150 ml锥形瓶中,加入40 ml不同浓度抗生素溶液。将锥形瓶置于振荡器上振荡,速度为200 r/min,温度保持在298 K。在预定的时间移取2 ml液体进行离心(5 000 r/min),取上清液过0.22 μm滤膜并置于液相样品瓶中,277 K下保存待测。吸附试验过程重复进行2次。
吸附动力学试验中抗生素的初始浓度分别为1、5、10 mg/L,温度保持在298 K;等温吸附试验中抗生素初始浓度分别为0.5、1、2、5、7、10、12、15、20 mg/L,温度分别保持在283 K和298 K。
研究pH、离子强度和土壤有机质的影响时,抗生素的初始浓度为10 mg/L,温度保持在298 K。采用HCl和NaOH调节溶液的pH分别为4、5、6、7、8、9、10,研究pH对吸附过程的影响;调节溶液CaCl2含量分别为0.005、0.01、0.02、0.05 mol/L,研究离子强度对吸附过程的影响。腐殖酸是土壤有机物中的主要组成部分,因此通过向紫色土添加不同量腐殖酸的方式来模拟不同有机质含量的土壤,研究有机质对NOR和OFL吸附的影响。试验过程参考Li等[13]的方法,具体如下:向风干的紫色土中加入不同量的腐殖酸并混合均匀,形成有机质含量分别为5、10、20 g/kg的紫色土壤,保持含水率为23%(土壤样品采集时的含水率),在室温下养护1个月,然后风干,进行吸附试验。同时参考Hou等[14]的方法,采用0.1 mol/L NaOH和0.1 mol/L Na4P2O7去除土壤有机质,得到不含有机质的紫色土,进行对照试验。
1.3 NOR和OFL的测定
采用Hitachi L-2000高效液相色谱仪(配备UV检测器)检测溶液中的NOR和OFL,色谱柱为Agilent Eclipse Plus的C18柱(5 μm,2.1 mm × 150 mm),流动相由乙腈和0.05 mol/L的磷酸溶液(用三乙胺将其pH调节为2.4)按照体积比1∶9组成,流速1 ml/min,柱温为303 K,检测波长分别为280 nm(NOR)和294 nm(OFL),保留时间分别为5.2 min(NOR)和6.4 min(OFL)。
1.4 数据分析
NOR和OFL在紫色土中的吸附量e(mg/kg)用方程(1)进行计算:

式中:0为NOR或OFL的初始浓度(mg/L);e为吸附平衡时溶液中NOR或OFL的浓度(mg/L);为试验水土比(ml/g)。
NOR和OFL在紫色土中的吸附系数K(L/kg)用方程(2)进行计算:

式中:e(mg/kg)和e(mg/L)的含义同上。
2 结果与讨论
2.1 吸附动力学过程
NOR和OFL在紫色土中的吸附量随时间变化如图1A、B。结果显示:两种抗生素在3种浓度下振荡5 h左右基本达到吸附平衡,且溶液中残留的NOR和OFL都低于5%。NOR在紫色土上吸附平衡时间小于潮土、黄棕壤,与红壤、水稻土上的吸附平衡时间相近[15]。当初始浓度从1 mg/L升至10 mg/L时,NOR和OFL在紫色土中的吸附平衡量分别从19.8 mg/kg和19.3 mg/kg升至195.7 mg/kg和191.9mg/kg。吸附平衡后,NOR在3种浓度下的吸附系数K平均值是1 133 L/kg,大于OFL(417 L/kg),但都达到了易吸附水平。Leal等[16]研究4种FQNs在巴西13种热带土壤上的吸附特性同样发现,NOR在土壤中表现出了最强的吸附作用。两种抗生素在紫色土中的吸附过程可划分为开始的快吸附过程和之后的缓慢吸附过程,快吸附部分主要发生在0 ~ 1 h,慢吸附主要发生在1 ~ 4 h。随时间的增加,快吸附部分抗生素在紫色土上的吸附量线性增加,这可能是两种抗生素在刚接触到土壤时,土壤表面尚有大量的吸附点位。但是当土壤表面的吸附点位趋于饱和时,随着时间增加,吸附量增加趋势减弱,多余的抗生素有可能进入土壤无机质以及有机质基质的内部孔隙,形成较慢的吸附速率[17]。

图1 供试紫色土吸附NOR(A)和OFL(B)的动力学曲线
采用3种吸附动力学模型模拟NOR和OFL在紫色土中的吸附过程。一级动力学模型、二级动力学模型和Elovich模型[16]的方程式如公式(3)、(4)、(5)。对紫色土吸附NOR和OFL的动力学拟合结果见表2。
一级动力学模型:

二级动力学模型:

Elovich模型:

式中:Q为时刻的吸附量(mg/kg);1为一级动力学模型系数(mg/(kg·h));2为二级动力学模型系数(kg/(mg·h));m为最大吸附量(mg/kg);为常数(mg/kg);为常数(mg/(kg·h))。

表2 供试紫色土吸附NOR和OFL的动力学参数
3种动力学模型中,二级动力学模型能很好地拟合紫色土吸附NOR和OFL的动力学过程,这说明紫色土对两种FQNs的吸附速度与紫色土的吸附活性点位的平方呈线性关系。吸附开始时,紫色土表面存在大量的活性吸附点位,吸附量主要受吸附质数量的影响,此时吸附速率最快,但一定时间后,土壤表面的吸附点位达到饱和,吸附质进入土壤中无机质和有机质基质的内部孔隙发生吸附作用,不再受吸附质浓度的影响[18]。
2.2 吸附等温线
在283 K和298 K下,紫色土对NOR和OFL吸附等温线如图2所示。NOR和OFL的初始浓度为0.5 ~ 20 mg/L,由图2可知,紫色土对NOR和OFL的吸附量都随着温度的增加而增加,且随着初始浓度的增加,吸附量差异有增大的趋势。

图2 供试紫色土吸附NOR和OFL的吸附等温线
为了更好地了解紫色土对NOR和OFL的吸附过程,采用3种不同的吸附等温模型分析NOR和OFL在紫色土中的等温吸附过程。3种等温吸附模型分别为:Langmuir模型、Freundlich模型和Dubinin-Radushkevich模型(D-R模型)[19],模型的方程如下:
Langmuir模型:

Freundich模型:

D-R模型:

式中:m为理论饱和吸附量(mg/kg);L为Langmuir方程系数(L/mg);为与温度有关的常数;F为Freundlich方程系数((mg/kg)(L/mg)1/n);为吸附能常数(mol2/kJ2);为Polanyi吸附势(kJ2/mol2),计算公式如下:

式中:为气体常数,8.314 J/(mol·K);为温度(K);其余参数含义同上。
3种吸附等温模型相关参数如表3所示。拟合结果表明,Freundlich、Langmuir和D-R模型对NOR和OFL等温吸附的拟合效果都较好,其中Freundlich方程拟合效果最好,这说明紫色土吸附NOR和OFL可能是不均匀并且可能发生多层吸附。在283 K和298 K的温度下,NOR和OFL的吸附强度1/均<1,表明两种抗生素都能被紫色土强烈吸附。根据1/值与等温吸附线的形状关系可知,属“L型”吸附等温线,且OFL比NOR更趋于线性[20-21],这主要是由于土壤吸附位点的不均匀性,或吸附物之间的配合作用及静电排斥作用的影响[22]。

表3 NOR和OFL在供试紫色土中的吸附等温模型参数
2.3 吸附机制
为进一步了解紫色土吸附NOR和OFL的吸附机制,通过计算吸附过程的吉布斯自由能(Δ)和吸附能()来进行判断。Δ和是反映土壤吸附的重要参数,根据Δ和的变化范围,可以推断出抗生素在土壤上的吸附机制。其中,Δ<20 kJ/mol时,说明吸附机制属于物理吸附[22];是根据D-R模型的参数计算,当<8 kJ/mol,吸附过程是物理吸附;当8 kJ/mol≤<16 kJ/mol,吸附机理为离子交换[17,21]。Δ和分别按照公式(10)和(11)计算:


由表4可知,吸附过程中Δ值均为负值,说明反应是自发进行的,并且Δ值在–16.12 ~ –14.54 kJ/mol,在物理吸附范围(–20 ~ 0 kJ/mol)内,表明NOR和OFL在紫色土上的吸附都属于物理吸附。在283 K和298 K下,NOR和OFL在紫色土上的吸附能值在4.10 ~ 5.35 kJ/mol范围内,均小于8 kJ/mol,同样也印证了吸附机制应为物理吸附[23]。陈淼等[20,24-25]研究了CIP、OFL、NOR在3种热带土上的吸附作用,同样发现吸附机制为物理吸附,吸附过程主要为范德华力、疏水作用、氢键和偶极矩等其中一种或几种作用力的共同作用[15]。

表4 供试紫色土吸附NOR和OFL的ΔG和E值
2.4 溶液初始pH对吸附的影响
FQNs是两性化合物,pH对FQNs分子形态有强烈影响[9,26]。不同溶液初始pH条件下紫色土对NOR和OFL的K值和e值如图3所示。在酸性条件下紫色土对NOR和OFL表现出较强的吸附力,在pH 5时达到了最大吸附量,分别约有98% 和96% 的NOR和OFL被紫色土吸附。当pH逐渐上升到10时,紫色土对NOR和OFL的吸附量分别逐渐减小到175.5 mg/kg和172.2 mg/kg。和吸附量相比,NOR的K值在酸性和碱性条件下的差异更为明显,随着pH的升高,K值从最高的1 126 L/kg下降到了115 L/kg,OFL也有类似的趋势。这说明在酸性条件下紫色土对FQNs表现了更强的吸附效果。FQNs都是两性分子,具有两个解离常数(pKa1和pKa2),溶液pH的大小决定粒子形态。当pH 图3 pH对NOR和OFL在供试紫色土中吸附的影响 离子强度对紫色土吸附NOR和OFL的影响如图4所示。由图4可知,当CaCl2浓度低于0.01 mol/L时,对紫色土吸附NOR和OFL的影响较小;随着溶液中CaCl2浓度的增加,NOR和OFL在紫色土中的吸附量都有所下降;当CaCl2浓度达到0.05 mol/L时,NOR和OFL的吸附量与CaCl2浓度为0.01 mol/L时相比分别降低了10.2% 和11.7%。这是因为溶液中的Ca2+属于强水合交换阳离子,有相对较大的水合半径,从而可以大量与土壤颗粒表面疏水性区域的硅氧烷结合,而这些疏水性区域是吸附有机污染物的主要区域,因此溶液中大量的Ca2+就会抑制土壤颗粒对FQNs分子的吸附[28]。Mutavdžić等[19]也发现土壤对磺胺类抗生素的吸附量随CaCl2浓度的升高而显著降低。 图4 离子强度对NOR和OFL在供试紫色土中吸附的影响 土壤中有机质会通过离子架桥、静电作用和氢键等方式吸附FQNs,相关研究也表明土壤中有机质含量对FQNs的吸附行为会产生影响[26,29]。紫色土有机质含量对吸附NOR和OFL的影响如表5所示。随着有机质含量的增加,紫色土对NOR和OFL的吸附量也缓慢增加。紫色土去除有机质后,NOR和OFL的吸附量为194.6 mg/kg和190.2 mg/kg;当紫色土中的有机质含量增加到19.4 g/kg时,紫色土对NOR和OFL的吸附量分别增加到199.2 mg/kg和198.5 mg/kg,NOR和OFL的K值分别从724 L/kg和387 L/kg增加到4 980 L/kg和2 646 L/kg。虽然K值随有机质含量的增加有较明显的上升,但是吸附量并未发生太大改变,这说明有机质对紫色土吸附NOR和OFL的影响是比较微弱的。Yan等[28]的研究表明有机质含量的增加并不会对ENR在蒙脱石的吸附过程产生较大的影响。Figueroa-Diva等[30]也发现土壤中有机物不会增加土壤对NOR、CIP和ENR的吸附。但也有研究发现土壤中有机物会影响对抗生素的吸附。Zhang等[31]研究表明有机质的去除会增加土壤对NOR的吸附量,这可能是由于土壤中有机质会占据一部分土壤颗粒表面的吸附点位,降低土壤颗粒对抗生素的吸附,去除有机质后会释放土壤颗粒表面的吸附点位。而Teixidó等[32]却发现增加土壤中腐殖酸含量,土壤对FQNs的吸附量也显著增加。由此可见,土壤中有机物对FQNs吸附的影响比较复杂,不同类型的土壤、有机质组成及含量都有可能造成土壤对FQNs的吸附差异。 表5 有机质对NOR和OFL在供试紫色土中吸附的影响 1) 紫色土对FQNs有较强的吸附作用,吸附过程在5 h就能达到平衡,NOR和OFL的吸附常数K分别为1 133 L/kg和417 L/kg,吸附过程符合二级动力学模型。Freundlich吸附等温模型能很好地拟合紫色土对FQNs的等温吸附过程。通过Δ和可知,物理吸附是紫色土吸附FQNs的主要机制。溶液pH和离子强度对紫色土吸附FQNs有很大的影响,碱性pH以及溶液中大量的阳离子会抑制紫色土对FQNs的吸附;而有机质含量对紫色土吸附FQNs的影响很小。 2) 由于紫色土主要通过物理吸附机制来吸附FQNs,同时pH和离子强度等因素会影响该吸附过程,表明在一定条件下FQNs在紫色土中可能具有较强的解吸和迁移作用,存在一定的环境风险。关于FQNs在紫色土中的环境行为还需要深入研究。 [1] Zhang Q Q, Ying G G, Pan C G, et al. Comprehensive evaluation of antibiotics emission and fate in the river basins of China: Source analysis, multimedia modeling, and linkage to bacterial resistance[J]. Environmental Science and Technology, 2015, 49(11): 6772–6782 [2] 章强, 辛琦, 朱静敏, 等. 中国主要水域抗生素污染现状及其生态环境效应研究进展[J]. 环境化学, 2014, 33: 1075–1083 [3] 王冲, 罗义, 毛大庆. 土壤环境中抗生素的来源、转归、生态风险以及消减对策[J]. 生态环境, 2014, 33(1): 384–388 [4] 提清清, 高增文, 季慧慧, 等. 抗生素在土壤中的吸附行为研究进展[J]. 土壤, 2017, 49(3): 437–445 [5] 赵方凯, 杨磊, 乔敏, 等. 土壤中抗生素的环境行为及分布特征研究进展[J]. 土壤, 2017, 49(3): 428–436 [6] 郭丽, 王淑平, 周志强, 等. 环丙沙星在深浅两层潮土层中吸附-解吸特性研究[J]. 农业环境科学学报, 2014, 33(12): 2359–2367 [7] Xie Y F, Li X W, Wang J F, et al. Spatial estimation of antibiotic residues in surface soils in a typical intensive vegetable cultivation area in China[J]. Science of the Total Environment, 2012, 430(14): 126–131 [8] Li Y W, Wu X L, Mo C H, et al. Investigation of sulfonamide, tetracycline, and quinolone antibiotics in vegetable farmland soil in the Pearl River Delta area, southern China[J]. Journal of Agricultural & Food Chemistry, 2011, 59(13): 7268–7276 [9] 张旭, 向垒, 莫测辉, 等. 喹诺酮类抗生素在土壤中的迁移行为及影响因素研究[J]. 农业环境科学学报, 2014, 33(7): 1345–1350 [10] Chen G, Liu X, Tartakevosky D, et al. Risk assessment of three fluoroquinolone antibiotics in the groundwater recharge system. Ecotoxicology and Environmental Safety, 2016, 133: 18–24 [11] Zheng S, Chen C, Li Y, et al. Characterizing the release of cadmium from 13 purple soils by batch leaching tests[J]. Chemosphere, 2013, 91: 1502–1507 [12] 李艳, 张薇薇, 程永毅, 等.重庆紫色母岩及土壤As、Hg环境地球化学基线研究[J]. 土壤学报, 2017, 54(4): 917–926 [13] Li Y J, Wang W Y, Zhou L Q, et al. Remediation of hexavalent chromium spiked soil by using synthesized iron sulfide particles[J]. Chemosphere, 2017, 169: 131–138 [14] Hou J, Pan B, Niu X, et al. Sulfamethoxazole sorption by sediment fractions in comparison to pyrene and bisphenol A[J]. Environmental Pollution, 2010, 158: 2826–2832 [15] 张劲强, 董元华. 诺氟沙星的土壤吸附热力学与动力学研究[J]. 土壤学报, 2008, 45(5): 978–986 [16] Leal R M, Alleoni L R, Tornisielo V L, et al. Sorption of fluoroquinolones and sulfonamides in 13 Brazilian soils[J]. Chemosphere, 2013, 92(8): 979–985 [17] Pan B, Wang P, Wu M, et al. Sorption kinetics of ofloxacin in soils and mineral particles[J]. Environmental Pollution, 2012, 171(4): 185–190 [18] Peruchi L M, Fostier A H, Rath S. Sorption of norfloxacin in soils: analytical method, kinetics and Freundlich isotherms[J]. Chemosphere, 2015, 119: 310–317 [19] Mutavdžić P D, Ćurković L, Blažek D, et al. The sorption of sulfamethazine on soil samples: isotherms and error analysis[J]. Science of the Total Environment, 2014, 497-498: 543–552 [20] 陈淼, 俞花美, 葛成军, 等. 诺氟沙星在热带土壤中的吸附-解吸特征研究[J]. 环境污染与防治, 2013, 35(2): 1891–1896 [21] 鲍艳宇, 周启星, 万莹, 等. 3种四环素类抗生素在褐土上的吸附和解吸[J]. 中国环境科学, 2010, 30(10): 1383– 1388 [22] 郭丽, 王淑平, 周志强, 等. 环丙沙星在深浅两层潮土层中吸附-解吸特性研究[J]. 农业环境科学学报, 2014, 33(12): 2359–2367 [23] Chao Y, Zhu W, Wu X, et al. Application of graphene-like layered molybdenum disulfide and its excellent adsorption behavior for doxycycline antibiotic[J]. Chemical Engineering Journal, 2014, 243(5): 60–67 [24] 陈淼, 唐文浩, 葛成军, 等. 氧氟沙星在热带土壤中的吸附行为研究[J]. 广东农业科学, 2015, 42(10): 146–152 [25] 陈淼, 俞花美, 葛成军, 等. 环丙沙星在热带土壤中的吸附—解吸特征研究[J]. 环境污染与防治, 2013, 35(2): 38–42 [26] Wang S, Wang H. Adsorption behavior of antibiotic in soil environment: A critical review[J]. Frontiers of Environmental Science & Engineering, 2015, 9(4): 565–574 [27] 陈炳发, 吴敏, 张迪, 等. 土壤无机矿物对抗生素的吸附机理研究进展[J]. 化工进展, 2012, 31(1): 193–200 [28] Yan W, Hu S, Jing C. Enrofloxacin sorption on smectite clays: Effects of pH, cations, and humic acid[J]. Journal of Colloid and Interface Science, 2012, 372(1): 141–147 [29] 王磊, 应蓉蓉, 石佳奇, 等. 土壤矿物对有机质的吸附与固定机制研究进展[J]. 土壤学报, 2017, 54(4):805–818 [30] Figueroa-Diva M, Vasudevan D, Mackay A A. Trends in soil sorption coefficients within common antimicrobial families[J]. Chemosphere, 2010, 79: 786–793 [31] Zhang J, Li Z J, Ge G F, et al. Impacts of soil organic matter, pH and exogenous copper on sorption behavior of norfloxacin in three soils[J]. Journal of Environmental Sciences, 2009, 21(5): 632–640 [32] Teixidó M, Medeiros J, Beltrán J L, et al. Sorption of enrofloxacin and ciprofloxacin in agricultural soils: Effect of organic matter [J]. Adsorption Science & Technology, 2014, 32(2): 153–164 Sorption of Fluoroquinolone Antibiotics in Agricultural Purple Soils WANG Chang, LI Yujie, ZHANG Zhi*, YAO Juanjuan, LU Peng, YANG Lu, WENG Zhangfan (Key Laboratory of the Three Gorges Reservoir Region′s Eco-environment, Ministry of Education (Chongqing University), Chongqing 400044, China) Antibiotics have been widely used as antimicrobial agents and additives in livestock products, causing a large amount of antibiotics entering into soil environment through the application of manures contaminated with these chemicals. As an important process of controlling the migration and transformation of antibiotics in soils, sorption behavior has great significance on the risk assessment and pollution controlling of antibiotics. The sorption of norfloxacin (NOR) and ofloxacin (OFL), two widely used fluoroquinolone antibiotics (FQNs) in agricultural purple soil in Chongqing were investigated with batch sorption experiments. The results showed that sorption processes of NOR and OFL in purple soil were very fast, and sorption equilibrium were achieved in 5 h with sorption coefficientKof 3 082 L/kg. Freundlich model was fitted well with sorption isotherms of NOR and OFL in purple soil. Gibbs free energy and sorption energy demonstrated that physical sorption was dominant in NOR and OFL sorption in purple soils. Solution pH greater than 6 may decreased NOR and OFL sorption in purple soil. When solution ion strength was up to 0.05 mol/L, sorption capacities of NOR and OFL were decreased by10.2% and 11.7%, respectively. Organic matter in soil had little effect on the sorption of NOR and OFL in purple soil. Norfloxacin; Ofloxacin; Purple soil; Sorption 重庆市基础科学与前沿技术研究专项(cstc2017jcyjAX0206),国家自然科学基金项目(51778082),重庆大学研究生科研创新项目(CYB15039)和重庆市社会事业与民生保障科技创新专项(cstc2017shmsA20019)资助。 (zhangzhicqu@cqu.edu.cn) 王畅(1993—),女,四川泸州人,硕士研究生,主要从事废水处理及污染物迁移研究。E-mail: 346558394@qq.com 10.13758/j.cnki.tr.2018.05.015 X131 A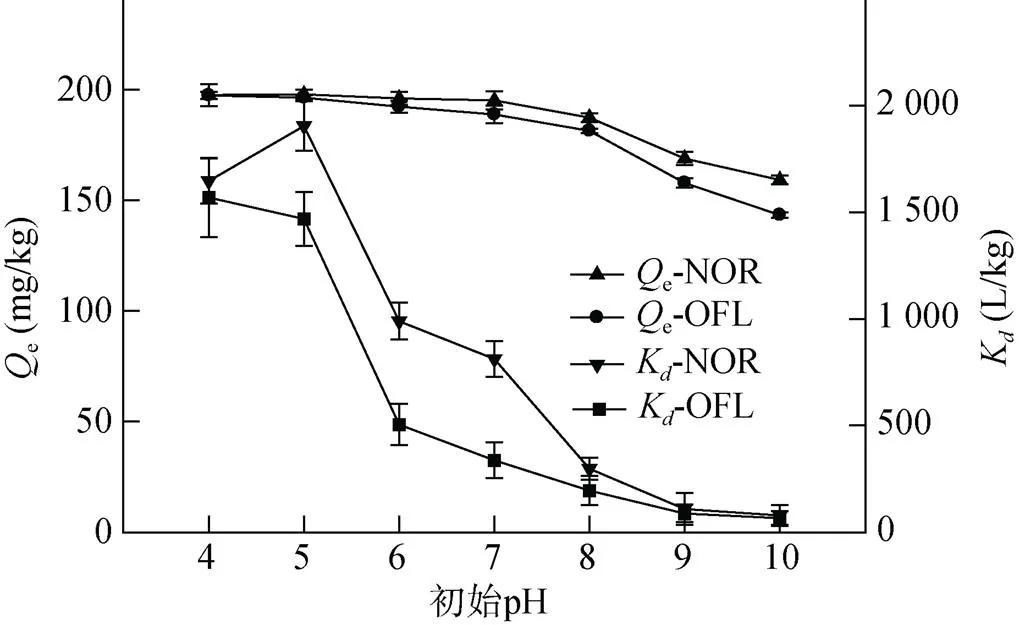
2.5 离子强度对吸附的影响

2.6 有机质含量对吸附的影响

3 结论
