双功能木聚糖酶Xyn2083的异源表达和酶学性质研究
2018-11-14刘雨露王华广杜建辉唐蕾
刘雨露 ,王华广 ,杜建辉, 唐蕾,*
1 (江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2 (江南大学 生物工程学院,江苏 无锡,214122)
木聚糖酶是一类可以水解木聚糖为木寡糖和木糖的酶系,β-1,4-D内切木聚糖酶(EC 3.2.1.8)是木聚糖水解过程中的关键酶,它能够水解木聚糖骨架中的β-1,4-木糖苷键[1]。根据氨基酸序列的相似性,木聚糖酶主要分为糖苷水解酶 (glycosyl hydrolase, GH) 10和11两大家族。木聚糖酶在食品、纺织、造纸、饲料、生物能源等工业领域具有较大的应用前景[2]。然而,在工业应用中,经常需要一些具有特殊性质的木聚糖酶来满足不同的需求,如耐高温、耐酸、耐碱等。因此,挖掘和开发一些新种类的木聚糖酶十分必要。当前木聚糖酶的来源主要是通过微生物发酵法制备。然而,在微生物发酵过程中,由于一些微生物产生的木聚糖酶量少,酶活低,成分复杂,使得一些特定的木聚糖酶难以分离纯化,限制了木聚糖酶在工业中的应用。近年来,已有多种不同来源的木聚糖酶通过分子克隆技术在大肠杆菌、酵母等多种宿主中进行了异源表达。如来源于黑曲霉的木聚糖酶XynB和XynC分别成功地在大肠杆菌与毕赤酵母中进行了表达[3-4]。来源于Clostridiumsp.的木聚糖酶也有较多在大肠杆菌或酵母中进行了异源表达[5-7]。其中,也有部分木聚糖酶是直接从复合菌系中利用分子克隆的方法获得,如来源于复合菌系中的木聚糖酶Xyn3F以及木聚糖酶Xyn2441[8-9]。
本课题组在前期的研究中,构建了一组可以高效水解酒精发酵后木薯渣的复合菌系RXS,并鉴定出1种关键菌株为Clostridiumclariflavum[10]。C.clariflavum作为一种嗜热厌氧微生物,有较丰富的木质纤维素降解酶系[11],对于木质纤维素的降解具有巨大的应用潜能,其全基因组序列于2012年公布[12]。目前,C.clariflavum中许多蛋白质的性质和功能并未确定。前期,对全基因组序列进行分析,发现了一种新的可以编码多个结构域的木聚糖酶基因Clocl-2083(结构域为GH11-GH10-Dockerin Ι) (ID:11562500),表达的木聚糖酶Xyn2083为一种双功能的木聚糖酶,包括2个催化结构域GH11、GH10[12-13]。
C.clariflavum作为厌氧微生物,产生的酶系较为复杂,且表达的木聚糖酶Xyn2083量较少[13]。因此,本实验通过分子克隆技术将Xyn2083及不同截短的木聚糖酶在大肠杆菌中进行异源表达,成功得到了具有活性的可溶性蛋白,将纯化后的重组酶进行了酶学性质研究,并探究了这种木聚糖酶的催化结构域中GH11与GH10在底物水解中的作用,为其在大规模工业化中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与质粒
C.clariflavum为复合菌系RXS中的一种关键菌株,复合菌系RXS由本实验室保藏。大肠杆菌JMl09、Rosetta (DE3)、质粒pET28a(+)均由本实验室保藏。
1.1.2 主要试剂
菌株构建所用的限制性内切酶(BamH I 和NotI)、T4DNA连接酶、PrimeSTAR HS DNA聚合酶购买于TaKaRa公司。定量所需的木寡糖标准品购买于青岛博智汇力生物科技有限公司。Super-Bradford蛋白定量试剂盒购买于康为世纪生物科技有限公司。山毛榉木聚糖购买于爱尔兰的Megazyme公司。
1.2 主要仪器与设备
AKTA AVANT25蛋白纯化仪,美国GE公司;SPECTRAMAX 0200-3850酶标仪,美国Molecular Devices公司;UltiMate 3000高效液相色谱仪,美国戴安有限公司;HPLC色谱柱Bio-Rad Aminex HPX-87H column (7.8 mm×300 mm)。
1.3 方法
1.3.1 目的基因的克隆和重组质粒的构建
以复合菌系RXS的总基因组为模板,利用National Center for Biotechnology Information (NCBI)数据库获得木聚糖酶Xyn2083(ID:11562500)的全长及不同结构域的核酸序列,设计引物,进行异源表达(表1),构建3种重组质粒,结构域的组成如图1所示。目的基因的克隆和重组质粒的构建均按照之前的实验方法[9]。其中,以大肠杆菌Rosetta (DE3)作为表达宿主。

表1 Xyn2083和不同截短木聚糖酶基因扩增引物Table 1 Primers used for amplification of the genes of Xyn2083 and different truncated xylanases
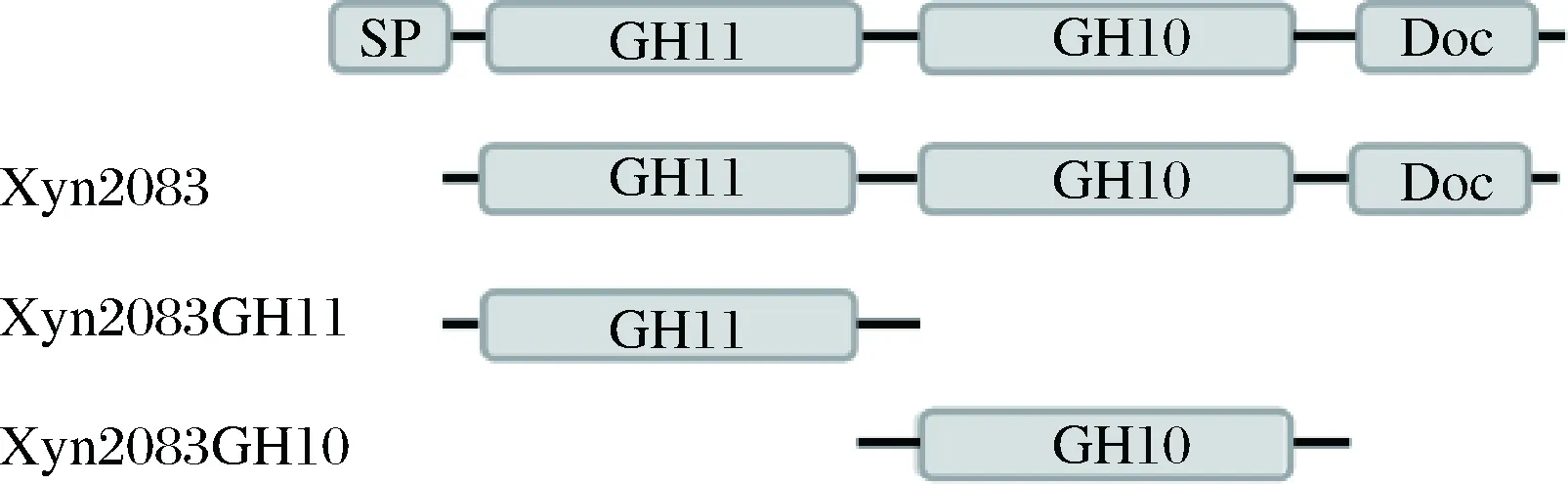
图1 Xyn2083木聚糖酶结构域组成Fig.1 Domain organization of Xyn2083 xylanases
1.3.2 重组木聚糖酶的诱导表达及分离纯化
将重组菌株接种到含有100 μg/mL卡那霉素、34 μg/mL氯霉素的TB培养基中,在37 ℃、200 r/min的摇床上培养,待菌体的OD600达到0.6~0.8时,加入终浓度为0.45 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactoside, IPTG),15 ℃、200 r/min诱导表达24 h,离心收集菌体。利用磷酸钠缓冲液重新悬浮收集的菌体,进行超声破碎、离心收集上清作为粗酶液,粗酶液用0.22 μm水系滤膜过滤后通过1 mL his TrapTMHP进行分离纯化, 并利用Sephadex G25进行脱盐,SDS-PAGE电泳鉴定纯度。
1.3.3 重组木聚糖酶活性及蛋白浓度的测定
向反应体系中加入500 μL稀释后的酶液与500 μL 10 mg/mL的山毛榉木聚糖底物,在一定温度下保温5 min,利用DNS法检测还原糖的释放量[14]。每分钟水解木聚糖底物生成1 μmol还原糖所需的酶量为1个酶活力单位(1 U)。蛋白浓度按照Super-Bradford 蛋白定量试剂盒的说明测定,以牛血清蛋白作为标准品。
1.3.4 重组木聚糖酶的酶学性质
1.3.4.1 温度对重组木聚糖酶活性的影响
以100 mmol/L Na2HPO4-NaH2PO4为缓冲溶液,在45~75 ℃范围内检测酶活性,以最高酶活为100%计算相对酶活。
1.3.4.2 pH值对重组木聚糖酶活性的影响
在pH 5.0~7.5的不同pH值和最适反应温度下检测重组木聚糖酶的酶活,以最高酶活为100%计算相对酶活。
1.3.4.3 温度对重组木聚糖酶稳定性的影响
将蛋白浓度为35 μg/mL的酶液,分别在60、65 ℃下处理不同的时间,在最适温度和pH值下检测剩余酶活,以处理0 h的酶活为100%计算处理不同时间的剩余酶活。
1.3.4.4 pH值对重组木聚糖酶稳定性的影响
将蛋白浓度为35 μg/mL的酶液,在pH 3.5~11.0范围缓冲溶液中于35 ℃下处理12 h检测剩余酶活,以处理0 h的酶活为100%计算处理不同时间的剩余酶活。
1.3.4.5 重组木聚糖酶的动力学参数测定
以山毛榉木聚糖为底物,在酶的最适条件下测定不同底物浓度下的初始酶活,根据Lineweaver-Burk 双倒数作图。以底物1/[S]为X轴,1/[V]为Y轴作图拟合出线性方程,计算不同底物的Km和Vmax。
1.3.4.6 重组木聚糖酶水解产物的分析
以100 mmol/L Na2HPO4-NaH2PO4为缓冲溶液,将1U的重组酶分别加入250 μL,2 mg/mL的不同木寡糖溶液中进行水解反应,重组酶液的体积为100 μL。利用RI检测器,HPLC色谱柱进行水解产物的测定,流动相为5.0 mmol/L的稀硫酸溶液,流速为0.6 mL/min,温度为65℃。
1.3.5 木聚糖酶Xyn2083序列分析
在NCBI数据库中利用BLAST比对,获得不同来源木聚糖酶的氨基酸序列,并利用DNAMAN软件对这些氨基酸序列进行比对和分析。
2 结果与分析
2.1 木聚糖酶Xyn2083序列分析
Clostridiumclariflavum全基因组序列表明,clocl-2083的一段完整开放阅读框(ORF)有1 983个碱基,可编码660个氨基酸,包括N端信号肽(SP),GH11、GH10两个催化结构域和C端的一个Dockerin I结构域(Doc),氨基酸残基的序列分别1~29, 41~222, 279~581, 600~657 (图1)。木聚糖酶Xyn2083的C末端有一个I型的Dockerin结构域,I型的Dockerin结构域是纤维小体的重要组成部分,它使酶亚基通过I型dockerin-cohesin作用连接在纤维小体上[13],这表明木聚糖酶Xyn2083属于纤维小体酶。
分别对Xyn2083全长及其中GH11、GH10结构域与不同来源的氨基酸序列进行比对分析。结果表明,对于多结构域Xyn2083氨基酸序列,在目前已报道的不同来源的木聚糖酶中,没有发现与Xyn2083全长氨基酸序列一致性较好的酶。然而与来源于PseudobacteroidescellulosolvensATCC 35603的木聚糖酶(KNY28459.1)进行比对,序列覆盖率为98%,一致性为63%(图2),但是目前并未发现与该酶相关的报道。Xyn2083中单一的GH11催化结构域与这些不同来源的GH11木聚糖酶氨基酸序列的一致性为48%~64%,推测出GH11结构域中的2个催化氨基酸(E82和E173) (图3)。Xyn2083中单一的GH10催化结构域与这些不同来源的GH10木聚糖酶氨基酸序列的一致性为38%~40%,推测出GH10结构域中的2个催化氨基酸(E107和E266) (图4)。
2.2 木聚糖酶基因的克隆及重组质粒的构建
以RXS的全基因组为模板进行3个不同目的基因片段的PCR扩增,对PCR产物进行琼脂糖凝胶电泳验证,电泳结果显示不同目的基因的条带单一(图5)。Xyn2083、Xyn2083GH11、Xyn2083GH10的理论大小分别为2023、770、1131 bp,与电泳胶图的位置符合。将构建的重组质粒进行BamH I、NotI双酶切验证,并进一步通过核酸序列测序,其结果与Clocl-2083中不同结构域的基因序列一致,且读码框正确,表明重组质粒构建成功。

Xyn2083:Clostridium clariflavum; Pce:Pseudobacteroides cellulosolvens ATCC 35603(KNY28459.1)图2 Xyn2083与其他来源的木聚糖酶氨基酸序列比对Fig.2 Amino acid sequence alignment of Xyn2083 with xylanase from the other source

图3 不同来源的GH11木聚糖酶氨基酸序列比对Fig.3 Amino acid sequence alignment of GH11 xylanases from different sourcesGH11: Clostridium clariflavum; Dth: Dictyoglomus thermophilum(PDB:1F5J); Bsu: Bacillus subtillis B230(1IGO); Cth:Chaetomium thermophilum(1H1A); Tfu: Thermobifida fusca(3ZSE)。黑色三角形为推测的GH11中E82和E173这2个催化氨基酸。

图4 不同来源的GH10木聚糖酶氨基酸序列比对Fig.4 Amino acid sequence alignment of GH10 xylanases from different sourcesGH11: Clostridium clariflavum; Tma:Thermotoga maritime (PDB:1VBR); Sli:Sreptomyces lividans (1EOV); Sol: StreptomycesOlivaceoviridis (1V6Y);Tpe: Thermotoga petrophila (3NIY)。黑色三角形为推测的GH10中E107和E266这2个催化氨基酸。
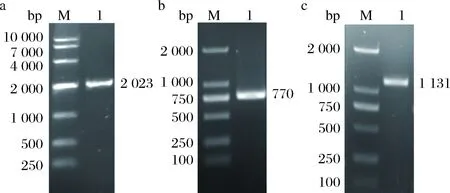
M-DNA marker; Lane a1-Xyn2083; Lane b1-Xyn2083GH11;Lane c1-Xyn2083GH10图5 目的基因Xyn2083(a)、Xyn2083GH11(b)、Xyn2083GH10(c) PCR扩增 Fig.5 PCR amplification of gene Xyn2083(a)、Xyn2083GH11(b)、Xyn2083GH10(c)
2.3 重组木聚糖酶的诱导表达及分离纯化
将构建的3种重组质粒分别转化至大肠杆菌Rosetta (DE3)中,在相同条件下进行诱导表达,获得了3种具有活性的可溶性重组木聚糖酶,测得粗酶液中Xyn2083、Xyn2083GH11、Xyn2083 GH10这3种重组木聚糖的酶活分别为135.253、658.134、5.937 U/mL,比酶活分别为35.638、175.152、1.574 U/mg。这3种重组木聚糖酶在大肠杆菌中的表达主要是以可溶性的形式存在,而包涵体蛋白约为总重组木聚糖酶的2.0%,其中 Xyn2083、Xyn2083GH11、Xyn2083GH10这3种可溶性重组蛋白在粗酶液中的质量分数分别为2.6%、 10.2%、5.7%。这种差别可能与重组蛋白中氨基酸的数量或结构域的构成有关。先前也有研究表明,将木聚糖酶截短后,使得酶的表达量得到了提高[15-16]。3种重组木聚糖酶的粗酶液经镍柱纯化和脱盐柱脱盐处理后,利用SDS-PAGE蛋白电泳检测重组木聚糖酶的纯度。如图6所示,3种酶纯度已达到了酶学性质分析的要求。Xyn2083、Xyn2083GH11、Xyn2083GH10的理论分子质量分别为72.3、31.7、46.4 kDa,与目的条带在电泳图中的位置吻合。
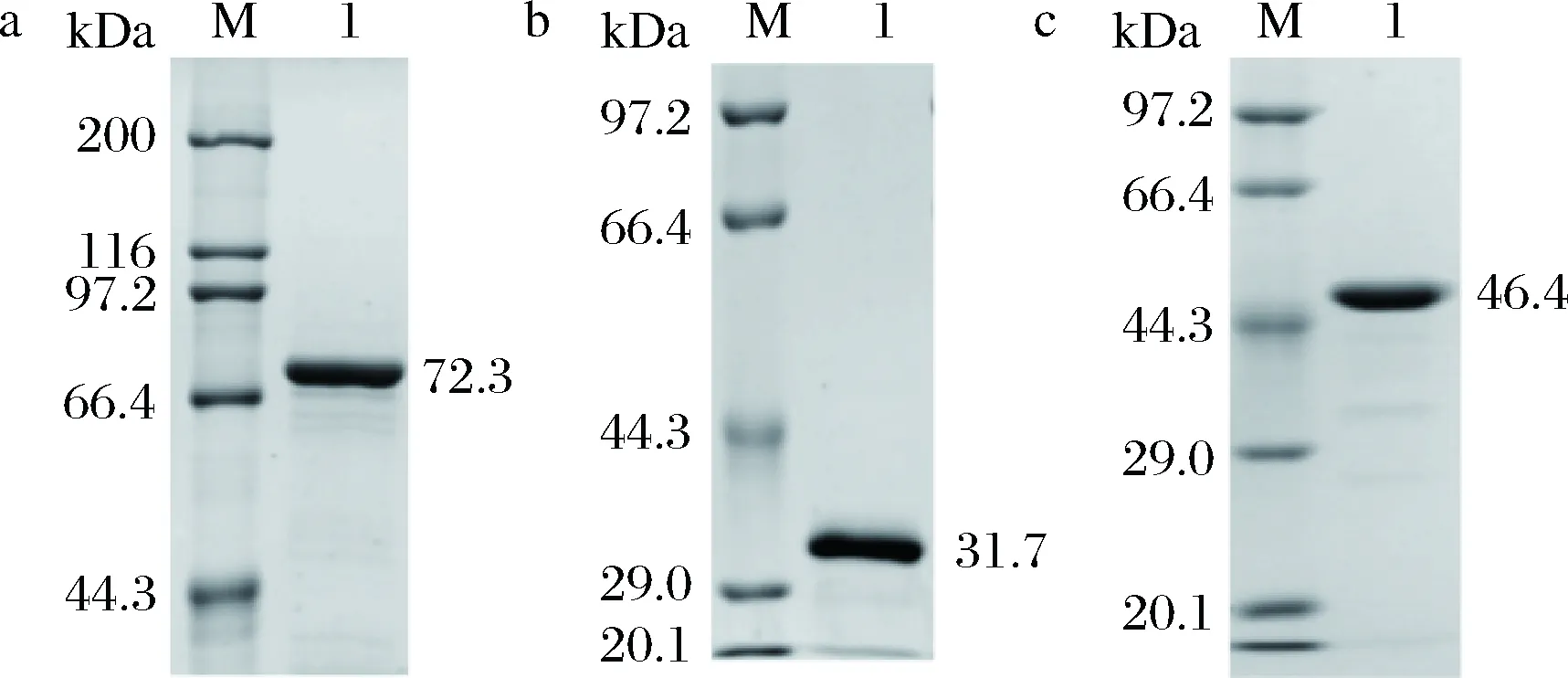
M-protein marker; Lane a1-Xyn2083; Lane b1-Xyn2083GH11; Lane c1-Xyn2083GH10图6 纯化重组木聚糖酶Xyn2083(a)、Xyn2083GH11(b)、Xyn2083GH10(c)的SDS-PAGE电泳Fig.6 SDS-PAGE of recombinant xylanase Xyn2083(a)、Xyn2083GH11(b)、Xyn2083GH10(c)
2.4 重组木聚糖酶的酶学性质
2.4.1 温度对重组木聚糖酶的活性与稳定性的影响
重组木聚糖酶最适反应温度的测定结果如图7所示, 测得Xyn2083、Xyn2083GH11、 Xyn2083GH10分别在60、55、65 ℃反应时相对酶活最高,酶活分别为18.451、24.834、7.290 U/mL。这表明GH11与GH10两个催化结构域具有不同最适反应温度, GH10的最适反应温度较高。
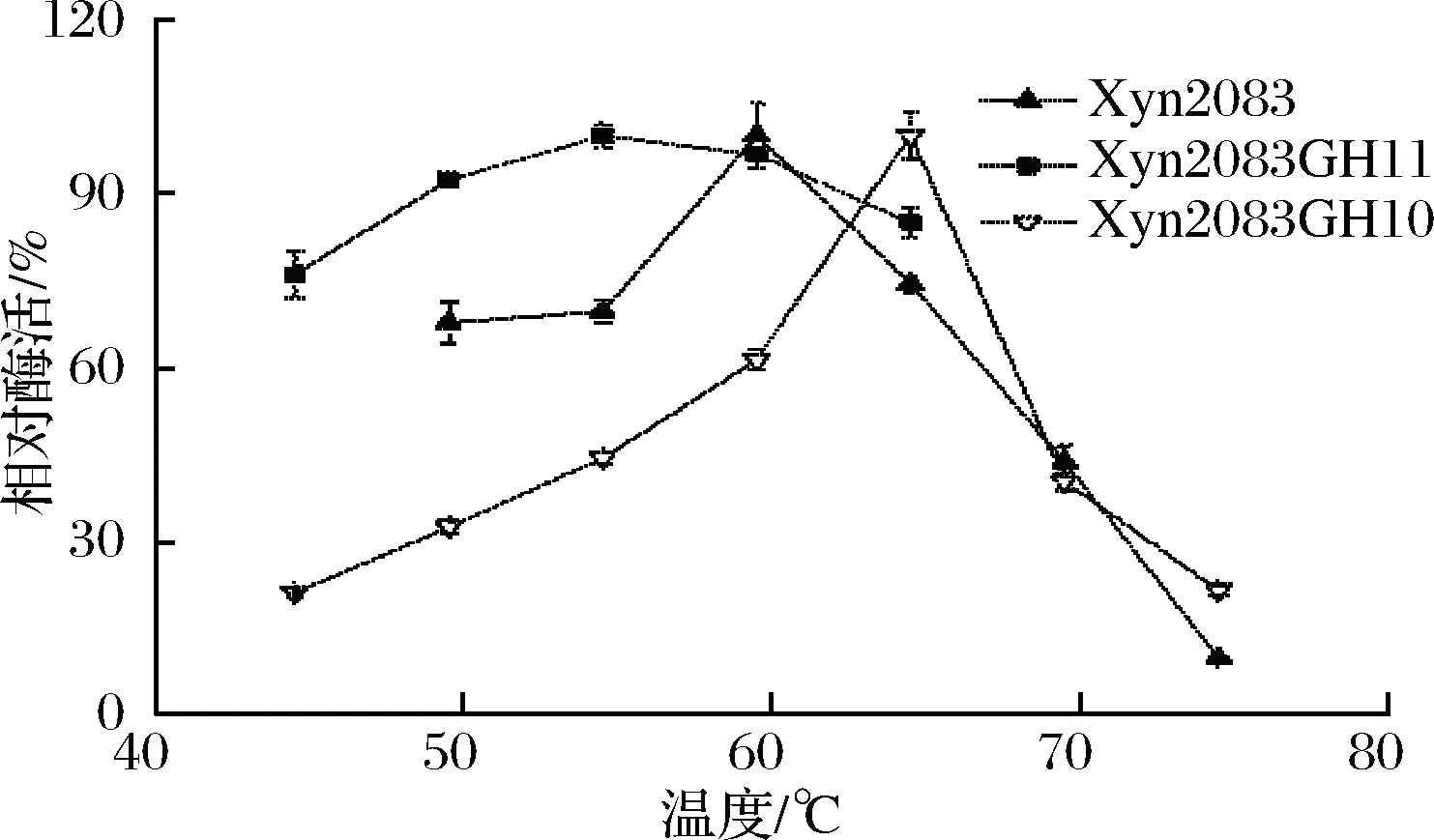
图7 重组木聚糖酶的最适反应温度Fig.7 The optimal reaction temperature forrecombinant xylanases
重组木聚糖酶温度稳定性的测定结果如图8所示,Xyn2083、Xyn2083GH11、Xyn2083GH10的加酶浓度相同,均为35 μg/mL,初始酶活分别为12.897、101.824、0.731 U/mL。这3种酶在60 ℃保温10 h时,酶的活性几乎不变。在65 ℃下处理时,3种木聚糖酶的活性缓慢降低,保温10 h后,Xyn2083、Xyn2083GH11木聚糖酶的活性剩余约为40%, Xyn2083GH10几乎检测不到酶活,这表明GH11结构域对温度耐受性较GH10好。由温度稳定性曲线可知,Xyn2083中GH11与GH10两个催化结构域在60 ℃及以下时,均具有较好的稳定性。
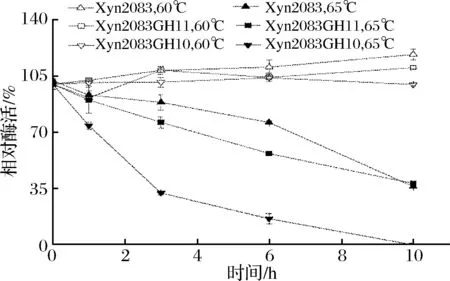
图8 重组木聚糖酶的温度稳定性Fig.8 The thermostability for recombinant xylanases
2.4.2 pH值对重组木聚糖酶的活性与稳定性的影响
如图9所示,当pH值为6.0时,Xyn2083、Xyn2083 GH11、 Xyn2083GH10这3种重组酶的相对酶活最高,酶活分别为19.463、25.167、7.721 U/mL。这表明GH11与GH10两个催化结构域具有相同的最适反应pH值,且在pH 5.5~6.5范围内其相对酶活在70%以上。对于Xyn2083,在pH值为5.5时,相对酶活较低,约为最高酶活的45%。

图9 重组木聚糖酶的最适反应pH值Fig.9 The optimal reaction pH for recombinant xylanases
重组木聚糖酶pH值稳定性的测定结果如图10所示。
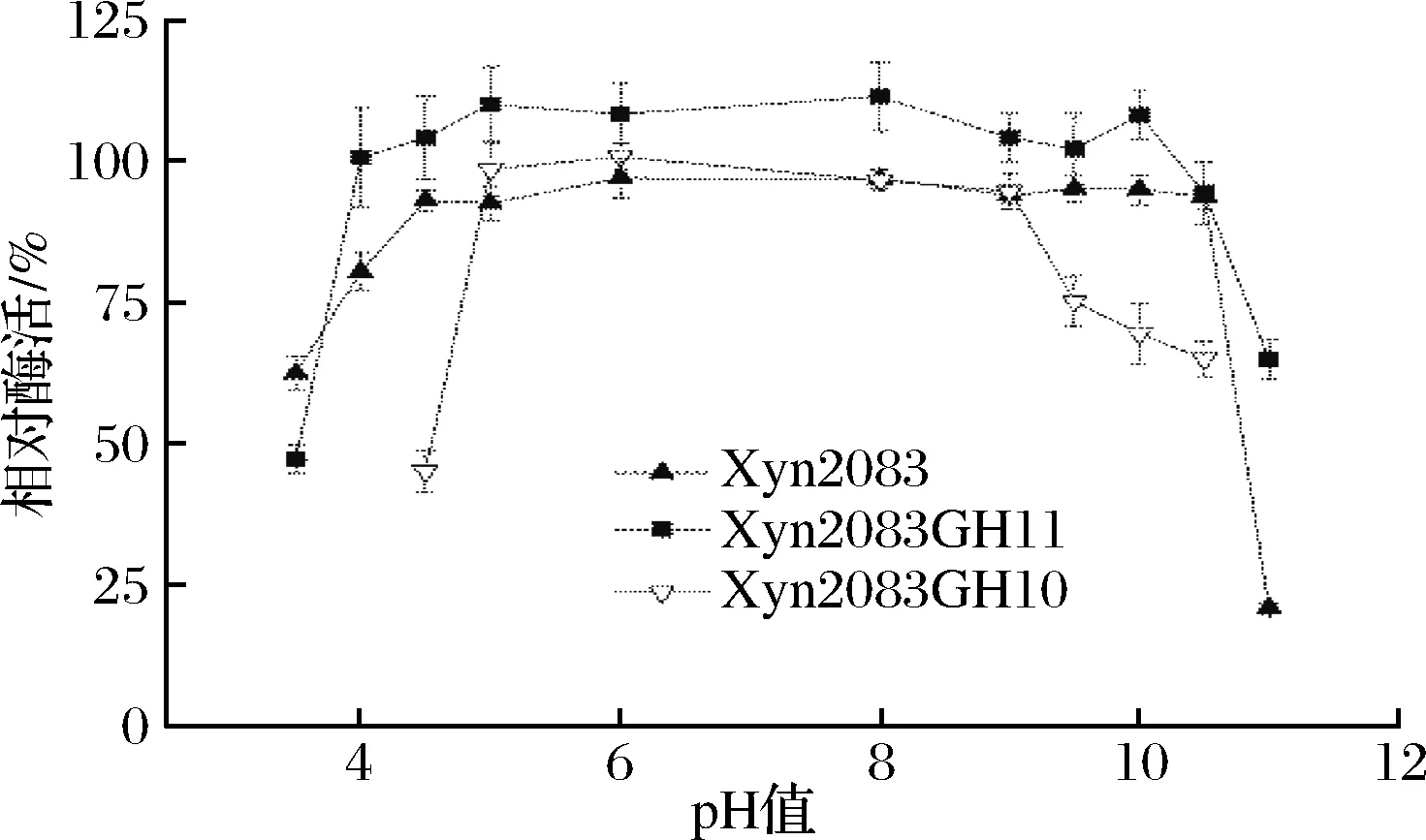
图10 重组木聚糖酶的pH值稳定性Fig.10 The pH stability for recombinant xylanases
3种重组酶的加酶浓度相同,均为35 μg/mL。分别在其最适反应温度与pH值下,测得3种重组酶Xyn2083、Xyn2083GH11、 Xyn2083GH10的初始酶活分别为11.982、95.725、0.805 U/mL。 由pH值稳定性可知,Xyn2083GH10在pH 5.0~9.0之间时比较稳定,当在pH 9.5溶液中处理12 h后,剩余酶活约为初始酶活的75%;在pH 4.5的条件下时,剩余酶活快速下降,约为初始酶活的45%。Xyn2083GH11在pH 4.0~10.5之间都比较稳定,当在pH值11.0溶液中处理12 h后,Xyn2083GH11的酶活还剩余约60%。这表明Xyn2083GH11比Xyn2083GH10具有更好的pH值耐受性。对于重组酶Xyn2083,在pH 4.5~10.5之间都比较稳定,处理12 h后,剩余酶活在85%以上。一些来源Clostridiumsp.的其他木聚糖酶也有关于pH值耐受范围的报道,但大多都有较窄的pH值耐受范围,如来源于C.beijerinckiiG117的木聚糖酶在pH 5.0~7.0间较稳定[17],来源于C.acetobutylicumATCC 824在pH 5.0~6.5间较稳定[18]。少数来源于Clostridiumsp.的木聚糖酶也具有较宽的pH值耐受范围,如来源于C.thermocellumATCC 27405D的木聚糖酶在pH 4.0~9.0间较稳定[15],该酶的耐酸性与截短木聚糖酶Xyn2083GH11的酸耐受性相似,但Xyn2083与Xyn2083 GH11的碱耐受性却强于该酶。这表明Xyn2083与大多数来源于Clostridiumsp.的其他木聚糖酶相比具有更宽的pH值耐受性,这也表明Xyn2083可在更宽泛的pH值范围内使用。
2.4.3 重组木聚糖酶的动力学参数
利用山毛榉木聚糖为底物测定3种重组木聚糖酶的动力学参数。如表2所示,当以山毛榉木聚糖为底物时,重组木聚糖酶Xyn2083GH11的kcat/Km值高于Xyn2083GH10的kcat/Km值,这表明在Xyn2083中,以高聚合度的木聚糖为底物时,GH11结构域比GH10结构域有更高效的水解效率。

表2 以山毛榉木聚糖为底物时木聚糖酶的动力学参数Table 2 Substrate specificities and kinetic parameters of xylanases for the hydrolysis of beechwood xylan
2.4.4 木寡糖水解产物的分析
为探究双功能木聚糖酶Xyn2083中2个催化结构域GH11、GH10在木聚糖水解中的作用,将Xyn2083与截短木聚糖酶Xyn2083GH11、Xyn2083 GH10分别与不同聚合度的木寡糖反应40 min后,利用HPLC对水解产物进行分析(图11)。结果表明Xyn2083GH11对木四糖与木五糖的水解产物为木二糖与木三糖(图11-c)。Xyn2083GH10对木寡糖的水解产物为木糖与木二糖(图11-d)。Xyn2083与Xyn2083GH10的水解产物相似,将木寡糖水解为木糖与木二糖(图11-b)。这表明了在Xyn2083中,GH10结构域对木聚糖的水解更彻底,GH11结构域与GH10结构域共同作用于木聚糖底物,其中GH11结构域能够将高聚合度的木聚糖水解为低聚合度的木寡糖,GH10结构域进一步将低聚合度的木寡糖进行水解,产生分子量更小的水解产物[19]。
3 结论
Clostridiumclariflavum为嗜热厌氧微生物,可产生多种木质纤维素降解酶系,在木质纤维素降解方面有极大的应用潜力。目前,研究者较多的关注于C.clariflavum产生的复合酶系对木质纤维素的水解作用及机制。对于单个酶的性质及功能的有关报道较少,使得一些性质较好的酶并未得到人们的关注, 限制了C.clariflavum在工业中的应用。本实验成功将双功能木聚糖酶Xyn2083及其截短部分在大肠杆菌中表达,得到具有活性的可溶性木聚糖酶。酶学性质表明,Xyn2083具有较宽的pH值耐受范围,为4.5~10.5,酶活在60 ℃以下保持稳定。最适反应温度与pH值分别为60 ℃、6.0。在木聚糖的水解反应中,2个催化结构域GH11、GH10共同作用于底物,将木聚糖水解为木糖和木二糖。具有良好的工业应用潜能。
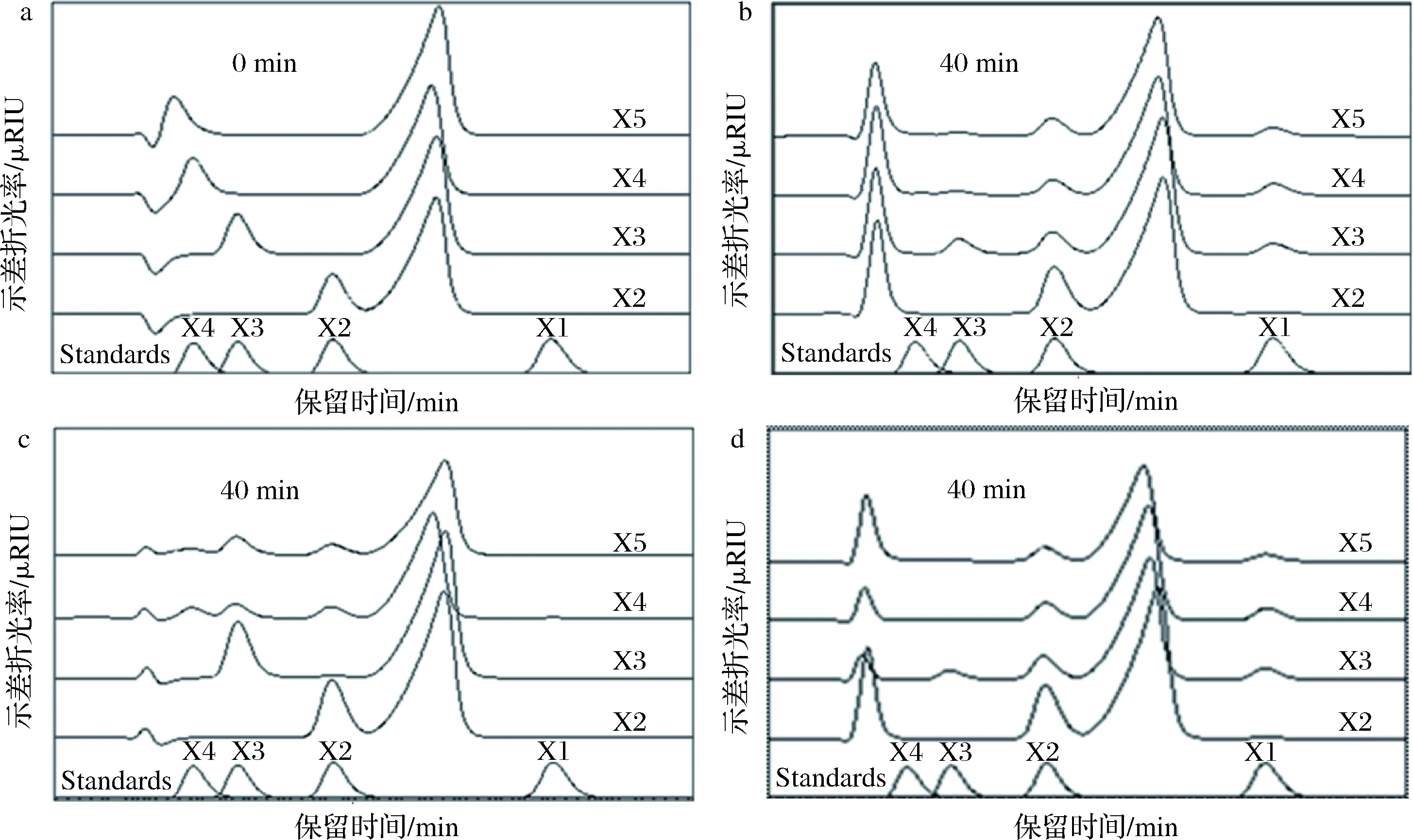
X1~X5:木糖、木二糖、木三糖、木四糖、木五糖图11 HPLC分析0min(a)以及Xyn2083(b)、Xyn2083GH11(c) and Xyn2083GH10(d)水解40min时木寡糖的水解产物Fig.11 HPLC analysis of hydrolytic products of xylooligosaccharides released at 0 min(a), 40 min using Xyn2083(b),Xyn2083GH11(c) and Xyn2083GH10(d)
