橙皮素单葡萄糖苷的酶法生物合成与定向调控
2018-11-14王幻王玉涛陈良朱思明
王幻,王玉涛,陈良,朱思明, *
1(华南理工大学 食品科学与工程学院,广东 广州,510640) 2(喀什大学 生命与地理科学学院,新疆 喀什,834000) 3(山东奔月生物科技有限公司,山东 东营,257000)
橙皮苷酶(hesperidinase)是一种由α-L-鼠李糖苷酶和β-D-葡萄糖苷酶组成的复合酶,主要源自青霉[1]和黑曲霉[2]。该酶可催化橙皮苷转化为橙皮素单葡萄糖苷(hesperetin-7-O-glucoside,HMG)和橙皮素。HMG即橙皮素-7-O-葡萄糖苷,分子式为 C22H24O11,是由橙皮苷脱掉1分子鼠李糖后的产物,是橙皮苷/橙皮素衍生物,非糖部分都是橙皮素。HMG水溶性是橙皮苷的50倍,其生物利用度比橙皮苷好。而且,HMG开环加氢后是一种新型低热值甜味剂,即葡萄糖基橙皮素二氢查耳酮,故HMG是一种新型甜味剂的前体物质[3-4],这种新型甜味剂具有无毒、低能量、安全等特点,可作为蔗糖的取代物,同时它还有较强的抗感冒病毒活性和抗氧化活性。
目前,HMG的制备方法有化学法[5]和生物转化法[6]。化学法的制备条件难以控制,且目标产物HMG容易进一步水解为橙皮素,从而使得目标产物得率较低,且易对环境造成严重污染;而酶法生物合成的条件温和,不会引起橙皮苷母核结构的变化。且橙皮苷酶价格便宜,但由于是复合酶,需考虑如何抑制葡萄糖苷酶活性、发挥鼠李糖苷酶活性,使反应历程向有利于HMG的方向定向转化;此外,橙皮苷溶解性差,需考虑在酶解体系中进行增溶试验以提高产物HMG的得率。
本文旨在利用HPLC法测定橙皮苷复合酶的酶学性质及其催化路线,由于本文的重点是探讨HMG的生成,所以就不考虑β-D-葡萄糖苷酶的作用,注重研究橙皮苷酶及α-L-鼠李糖苷酶的性质。并以目标产物的含量及底物转化率为指标,优化中间产物HMG的酶解条件,实现橙皮苷向HMG定向转化的调控,拟解决因橙皮苷水不溶性及复合酶中β-D-葡萄糖苷酶干扰造成的HMG得率低的问题,为甜味剂前体物质HMG的定向酶法转化提供理论基础,有较好的潜在应用价值。
1 材料与方法
1.1 材料与试剂
橙皮苷酶,自制;橙皮苷粗品,由山东奔月生物技术有限公司提供;橙皮苷、橙皮素单葡萄糖苷及橙皮素标准品,购自美国Sigma公司;乙腈,色谱纯;其他试剂 均为国产分析纯。
1.2 仪器与设备
高效液相色谱仪(LC-100),上海伍丰仪器有限公司;水浴恒温振荡器(SHA-BA),金坛市宏华仪器厂;离心机(KA-1000),上海安亭科学仪器厂;电磁炉(C21-RT2166),美的生活电器制造有限公司;电子天平(CP224C),奥豪斯仪器(常州)有限公司;pH计(PHSJ-3F),上海仪分科学仪器有限公司。
1.3 试验方法
1.3.1 高效液相色谱条件
色谱柱:Wondasil C18分析柱(250 mm×4.6 mm,5 μm);流动相:乙腈-甲酸溶液(A:体积分数为0.1%的甲酸水溶液;B:乙腈);梯度洗脱程序(0~1 min,85.0% A;1~5 min,85.0% A→75.0% A;5~15 min,75.0% A→60.0% A;15~25 min,60.0% A→50.0% A;25~30 min,50.0% A→85.0% A);紫外检测波长:283 nm;反相柱的柱温:35 ℃;进样量:20 μL。
1.3.2 橙皮苷酶活测定方法
采用HPLC法测酶活[7]:锥形瓶中加一定量橙皮苷溶液,置于60 ℃、转速200 r/min水浴摇床中保温5 min,后加入一定量酶液,继续保温1 h,取出立即用沸水灭活30 min,冷却后在4 000 r/min下离心20 min,取上清液测定底物剩余量或产物生成量。橙皮苷酶和α-L-鼠李糖苷酶酶活的确定以橙皮苷的减少量及HMG的生成量为依据,而β-D-葡萄糖苷酶的酶活以橙皮素的增加量为依据。
橙皮苷酶酶活的定义:在60 ℃、pH 4.0的条件下,每分钟转化1 μg橙皮苷或生成1 μg产物所需的酶量为1个酶活单位。
1.3.3 橙皮苷酶对橙皮苷的酶解路线分析
橙皮苷酶是由α-L-鼠李糖苷酶和β-D-葡萄糖苷酶组成,其催化路线有2条:(1)橙皮苷先经鼠李糖苷酶分解为鼠李糖和HMG,HMG经葡萄糖苷酶分解为橙皮素和葡萄糖;(2)橙皮苷先经葡萄糖苷酶分解为橙皮素和芸香糖,芸香糖再经鼠李糖苷酶分解为鼠李糖和葡萄糖。
为确定该复合酶的可能催化路线,将质量浓度为0.1 mg/mL的橙皮苷与橙皮苷酶液(12.28 U)在柠檬酸缓冲液pH值4.0和温度60 ℃的条件下反应150 min。每15 min取样1次,HPLC法测定不同时间体系中橙皮苷、HMG及橙皮素含量,根据3种黄酮类物质在酶解体系中含量的变化推断橙皮苷酶的可能催化路线。
1.3.4 橙皮苷酶酶学性质研究
1.3.4.1 橙皮苷酶最适反应温度和热稳定性
将橙皮苷与橙皮苷酶液(12.28 U)在20、30、40、50、60、70、80 ℃的温度下进行酶反应,缓冲液pH值为4.0,2 h后用HPLC测定橙皮苷酶和α-L-鼠李糖苷酶(rhamnosidase)的相对酶活,确定其最适反应温度(相对酶活:设定最高酶活为100%,其他条件下酶活占最高酶活的百分比)。
将等量橙皮苷酶液(12.28 U)分别在20、30、40、50、60、70、80 ℃的水浴中保温30、60、90、120、150 min,在酶液中加入橙皮苷溶液,HPLC法测定橙皮苷酶酶活,分析橙皮苷酶的热稳定性。
1.3.4.2 橙皮苷酶最适反应pH值和酸碱稳定性
在最适反应温度下,将底物与橙皮苷酶液(12.28 U)于pH值2.0、3.0、4.0、5.0、6.0、7.0、8.0 和9.0的缓冲液中进行酶解反应。酶解体系所用缓冲液为100 mmol/L的HCl-KCl 缓冲液(pH 2.0)、柠檬酸-柠檬酸钠缓冲液(pH 3.0、4.0、5.0)、磷酸盐缓冲液(pH 6.0、7.0、8.0)和Tris-HCl缓冲液(pH 9.0)。反应2 h后用HPLC测定橙皮苷酶和α-L-鼠李糖苷酶的相对酶活,确定反应最适pH值。
将橙皮苷酶用上述不同pH值缓冲液混合后置于4 ℃冰箱中分别放置1、2、3、4和5 h后,在最适pH值及温度下与橙皮苷反应1 h,测定其相对酶活,确定橙皮苷酶的酸碱稳定范围。
1.3.4.3 橙皮苷酶及鼠李糖苷酶反应动力学
取等量的橙皮苷酶液(12.28 U)分别与终质量浓度为 20~100 μg/mL的橙皮苷溶液混合,在最适温度及pH值下反应,每10 min取样1次,测定橙皮苷酶和α-L-鼠李糖苷酶的反应初速率。以橙皮苷浓度的倒数为横坐标,橙皮苷酶和鼠李糖苷酶的反应速率的倒数为纵坐标,分别绘制橙皮苷酶和α-L-鼠李糖苷酶Lineweaver-Burk 双倒数曲线,从而计算出米氏常数Km值和最大反应速度Vmax值。
1.3.5 HMG的酶法生物转化的定向调控
采取单因素试验研究橙皮苷酶实现HMG的定向转化调控。以HMG的生成量及橙皮苷的转化率为指标,考察酶用量(6.14、12.28、15.35和30.7 U)、增溶剂二甲基甲酰胺(DMF)添加量(0.8%、1.6%、3.2%、6.4%和12.8%)、葡萄糖的添加量(0、3、6、9和12 mg/mL)等因素对HMG得率的影响。
融资租赁是一种新的融资方式,对解决投资资金短缺、设备更新等方面都发挥着很重要的作用。但受到相关因素的影响,融资租赁业发展还处在一些不足之处,一些优势还未得到有效发挥。在现在这样一个经济迅猛发展的时代,我们应该认识到融资租赁的积极作用,加快融资租赁业的发展。
2 结果与分析
2.1 橙皮苷酶酶活测定与酶反应路线分析
对比DAVIS法[8]及对硝基苯酚法[9],HPLC法[7]可准确地检测橙皮苷、HMG及橙皮素的含量,分析橙皮苷酶解过程中橙皮苷酶、α-L-鼠李糖苷酶及β-D-葡萄糖苷酶的酶活。
由酶解体系的液相色谱图1可得酶解1 h后的橙皮苷、HMG及橙皮素的峰面积,求得体系中橙皮苷、HMG及橙皮素对应的质量浓度分别为63.15、10.50和1.65 μg/mL。进而计算橙皮苷酶、α-L-鼠李糖苷酶及β-D-葡萄糖苷酶的酶活分别为12.28、3.5和0.413 U/g。

图1 酶解后体系的高效液相色谱图Fig.1 HPLC chromatogram of enzymatic hydrolysis system
由1.3.3所述酶解反应的可能路径,酶解过程中橙皮苷、HMG及橙皮素含量变化情况如图2所示。

图2 酶解体系中3种黄酮类物质含量的变化Fig.2 Content variations of hesperidin and its hydrolysatein enzymatic hydrolysis system
随着酶解时间延长,橙皮苷含量逐渐减少,中间产物HMG在短时间内含量显著增加,在1 h后趋近平缓,而橙皮素含量则呈缓慢增加且含量极少。可推测,橙皮苷先在α-L-鼠李糖苷酶作用下生成HMG,且α-L-鼠李糖苷酶的活性较高;随着反应的进行,中间产物积累的越来越多,使得少量HMG在β-D-葡萄糖苷酶的作用下慢慢酶解生成橙皮素[10]。若以催化路线(2)为主,则反应在短时间内应先生成橙皮素,但与事实不符。故可推测橙皮苷复合酶是以催化途径(1)为主。即底物橙皮苷应先在α-L-鼠李糖苷酶作用下生成HMG,之后β-D-葡萄糖苷酶再将HMG少量酶解成橙皮素。
2.2 橙皮苷酶的酶学性质研究
2.2.1 橙皮苷酶的最适反应温度和热稳定性
从图3可看出,随着温度的升高,橙皮苷酶和α-L-鼠李糖苷酶的酶活均在增加。当温度在60 ℃时,2种酶的酶活均达到最大值,即酶促反应效果最佳。当温度大于70 ℃时,橙皮苷酶和α-L-鼠李糖苷酶的酶活显著下降,相对酶活低于50%,可能是高温使酶变性,导致酶活逐渐丧失[11]。故60 ℃是橙皮苷酶的最适反应温度,且橙皮苷酶和α-L-鼠李糖苷酶的最适反应温度相同,可能原因是α-L-鼠李糖苷酶是橙皮苷酶的限速酶。
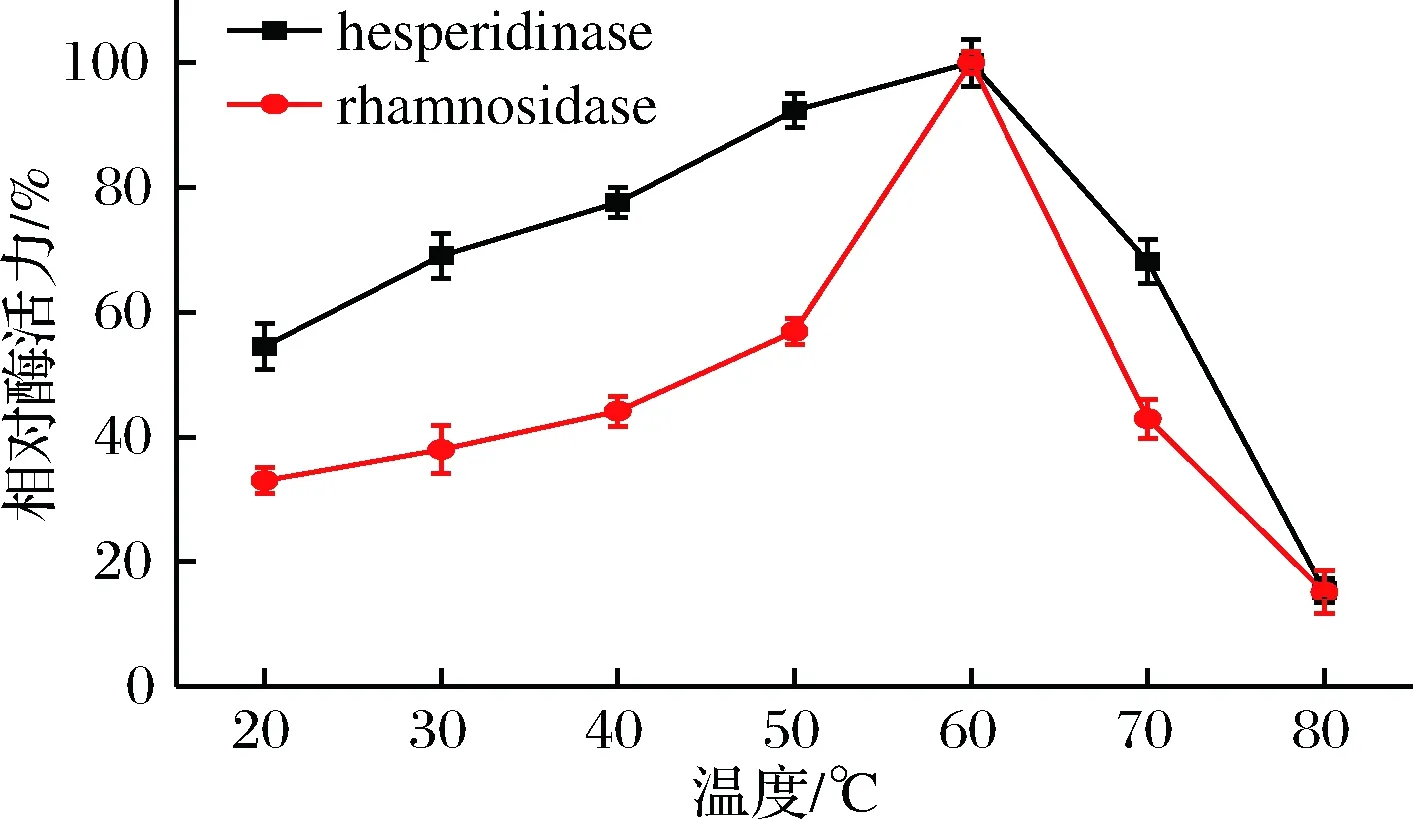
图3 温度对橙皮苷酶和α-L-鼠李糖苷酶活的影响Fig.3 Effect of temperature on the activities ofhesperidinase and its α-L-rhamnosidase
从图4可知,橙皮苷酶在不同温度下处理一段时间后,随着处理时间的增加,相对酶活整体呈现下降趋势。但是在20~70 ℃的温度范围内,处理时间为150 min时,橙皮苷的相对酶活仍维持在60%以上;且当温度为60 ℃时,其相对酶活近乎100%;当温度为20 ℃或70 ℃时,橙皮苷酶的相对酶活有所下降;而当温度为80 ℃时,橙皮苷酶活的耐热性急剧下降,相对酶活迅速降低。
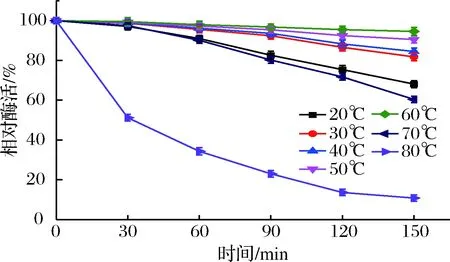
图4 橙皮苷酶酶活的热稳定性Fig.4 Effect of temperature on the thermo-stabilityof the hesperidinase
2.2.2 橙皮苷酶的最适反应pH值和酸碱稳定性
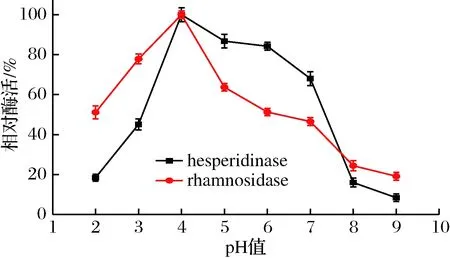
图5 pH值对橙皮苷酶活和α-L-鼠李糖苷酶活的影响Fig.5 Effect of pH on the activities of hesperidinase andits α-L-rhamnosidase
橙皮苷酶在不同pH条件下处理5 h后的酶活如图6所示,在pH 3.0~7.0的范围内处理5 h后橙皮苷的相对酶活仍保留60%以上;在pH 4.0时,橙皮苷酶酶活基本无变化;在pH 5.0~6.0时,橙皮苷酶相对酶活均保持在80%以上。当pH<3.0或>7.0时,橙皮苷酶的酶活在短时间内急剧下降,其最终相对酶活为20%左右。故橙皮苷酶在pH 3.0~7.0的环境下稳定性较好,即橙皮苷酶是嗜酸性酶。
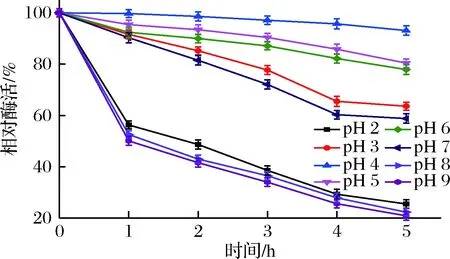
图6 橙皮苷酶的酸碱稳定性Fig.6 Effect of pH on stability of the hesperidinase
2.2.3 橙皮苷酶和鼠李糖苷酶的酶反应动力学
一般酶解反应过程中底物的减少量与产物的生成量在一段时间内是呈线性变化的,其线性变化的斜率即为酶解反应初速度。以橙皮苷浓度的倒数为横坐标,以橙皮苷酶或鼠李糖苷酶反应的初速度倒数为纵坐标,作2种酶的双倒数曲线,结果如图7所示。橙皮苷酶和α-L-鼠李糖苷酶的双倒数曲线分别为y=340.13x+1.146 4和y=584.49x+2.513 1。计算可得橙皮苷酶的Km值为296.69 μg/mL,Vm值为0.872 3 μg/(mL·min);α-L-鼠李糖苷酶的Km值为232.58 μg/mL,Vm值为0.397 9 μg/(mL·min)。
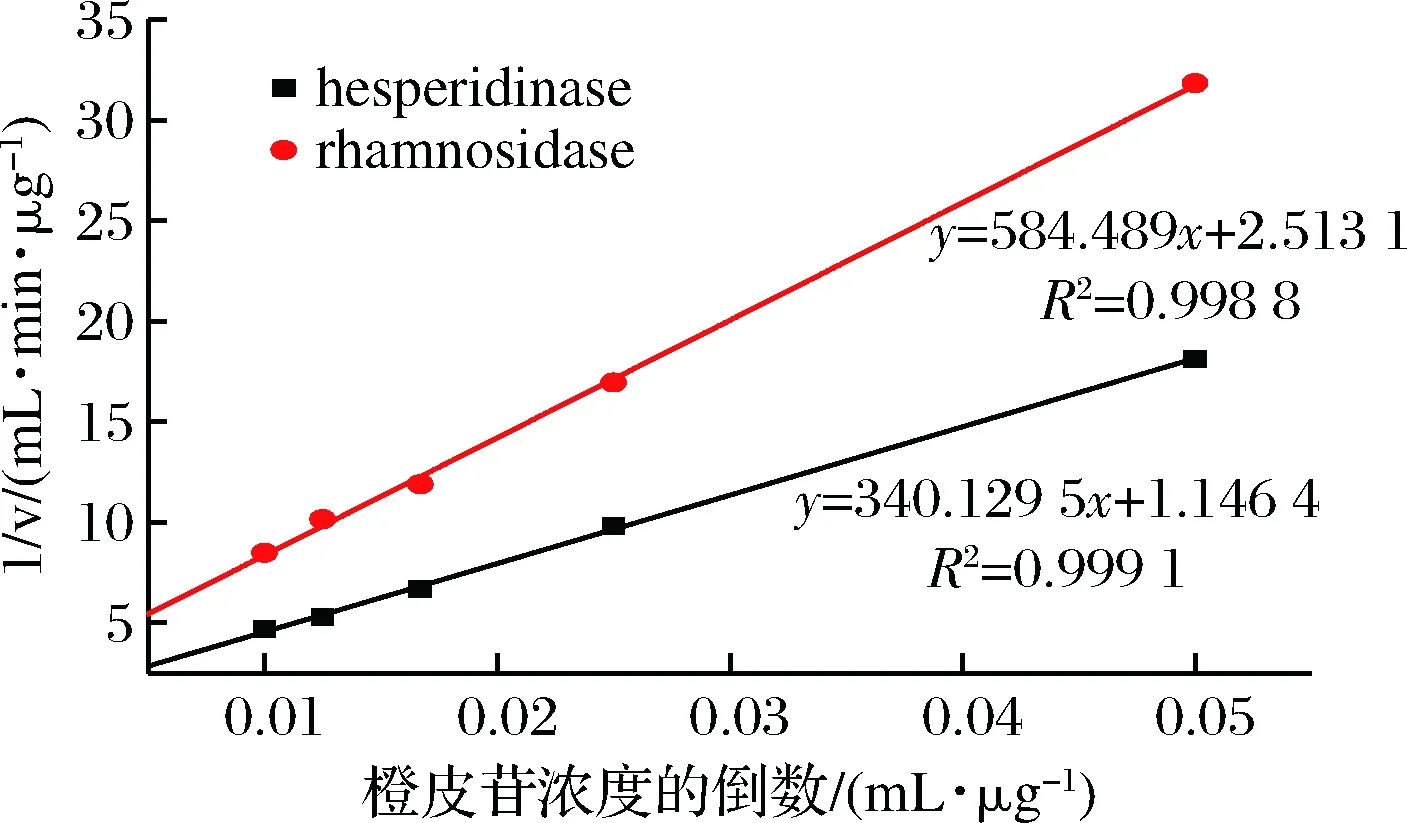
图7 橙皮苷酶及α-L-鼠李糖苷酶的双倒数曲线Fig.7 Double reciprocal curves of hesperidase andα-L-rhamnosidase
2.3 HMG定向生物转化的过程调控
2.3.1 酶用量对HMG定向转化过程的影响
酶添加量与底物浓度的比例对酶解过程有着重要影响。在最适反应温度60 ℃和pH 4.0下,其他条件均保持一致,改变酶用量,反应5 h。前3 h每隔30 min取样1次,后2 h每隔1 h取样1次,测定酶解液中的目标产物HMG的含量及反应底物橙皮苷的转化率随时间的变化,结果如图8所示。
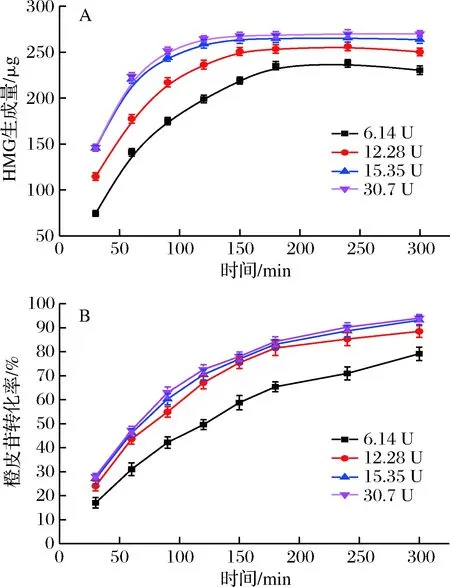
A-HMG含量的变化曲线;B-橙皮苷转化率变化曲线图8 酶用量对橙皮苷酶解过程的影响Fig.8 Effect of enzyme dosage on the hydrolysis of hesperidin
由图8可知,随着酶用量的增加,中间产物HMG的含量和底物橙皮苷的转化率也随之增加,且HMG含量达到最大值所需时间有所缩短。可能原因是,在酶解体系中,随着酶量的增加,体系中橙皮苷酶在一定时间和空间内与底物接触机会增加,即橙皮苷酶催化底物橙皮苷转化的速率变快,故HMG含量达到最大值的时间缩短。对比图8-A和图8-B发现,随着反应的进行,橙皮苷的转化率一直呈上升趋势,而HMG含量却逐渐平稳,这是因为随着HMG含量的积累,虽然有一部分橙皮苷转化成HMG,但同时HMG又少量酶解成橙皮素[13]。从图中还可看出,当酶用量大于15.35 U时,橙皮苷的转化率增加甚微,且反应至120 min时,中间产物HMG含量达最大值,得率为18.6%。故从节约成本的角度考虑,最适反应酶用量为15.35 U。
2.3.2 增溶剂二甲基甲酰胺(DMF)添加量对HMG酶法合成的影响
酶解过程往往是在缓冲溶液体系中进行,由于底物橙皮苷是几乎不溶于水,会影响酶促反应的效率。故考虑在酶解体系中加入增溶剂以促进底物橙皮苷的溶解,使酶解反应顺利进行。橙皮苷在常温下极易溶于DMF溶液,故采用DMF作为底物增溶剂。在酶解温度为60 ℃、pH值4.0、酶用量为15.35 U的条件下,考察增溶剂添加量对目标产物得率的影响。酶反应5 h,定时取样测定酶解液中HMG的含量及橙皮苷的转化率随时间的变化,结果如图9所示。

A-HMG生成量的变化曲线;B-橙皮苷转化率变化曲线图9 DMF添加量对橙皮苷酶解过程的影响Fig.9 Effect of DMF addition on the hydrolysis of hesperidin
由图9可知,随着酶解体系中DMF含量的增加,酶解过程的中间产物HMG的含量和底物橙皮苷的转化率均随之减少,且随着时间的延长,HMG含量逐渐平稳。这是因为在酶解体系中,随着DMF含量的增加,虽然体系中橙皮苷的溶解度会变大,但DMF同时会抑制橙皮苷酶的酶活[14],导致橙皮苷的转化率随着DMF含量的增加而减小,影响HMG的生成,且反应时间为3 h时,得到的中间产物HMG的量基本稳定,得率为20.0%。故为得到更多的HMG,选择增溶剂DMF的添加量越少越好,只需保证其添加量能使橙皮苷较好的溶解即可,本实验选择最适DMF的添加量为0.8%。
2.3.3 葡萄糖添加量对HMG制备的影响
橙皮苷酶催化路线主要为(1),可见中间体HMG的生成与β-D-葡萄糖苷酶也有关。β-D-葡萄糖苷酶会将得到的HMG继续酶解为橙皮素,为提高目标产物HMG含量,考虑在酶解体系中加入一定量的葡萄糖以抑制橙皮苷复合酶中的β-D-葡萄糖苷酶对中间产物的过度酶解[15]。在60 ℃、pH为4.0、酶用量为15.35 U、增溶剂DMF添加量0.8%的酶反应条件下,添加不同量的葡萄糖溶液(图10),反应5 h,每隔1 h取样1次,测定酶解液中的HMG的含量及反应底物橙皮苷的转化率随时间的变化,结果如图10所示。

A-HMG生成量的变化曲线;B-橙皮苷转化率变化曲线图10 葡萄糖添加量对橙皮苷酶解过程的影响Fig.10 Effect of glucose addition on the hydrolysis ofhesperidin
由图10可知,未加葡萄糖组的中间产物HMG的含量最少,而此时橙皮苷的转化率却是最大。原因可能是葡萄糖一方面抑制了β-D-葡萄糖苷酶的酶活使得中间产物HMG没有向橙皮素方向转化,另一方面葡萄糖的存在引起了产物抑制作用,使得橙皮苷的转化率下降。酶解体系中随着葡萄糖浓度的增加,酶解过程的中间产物HMG的含量和底物橙皮苷的转化率均随之减少。这是因为随着葡萄糖浓度的增加,虽然抑制了体系中得到的HMG进一步酶解为橙皮素,但β-D-葡萄糖苷酶的酶活本身较小,过量的葡萄糖添加量反倒会抑制橙皮苷的酶促反应方向,从而使得中间产物HMG的得率下降。反应3 h时,HMG含量基本稳定,最终HMG得率为35.8%,相较于直接反应未加适量增溶剂和葡萄糖苷酶抑制剂条件下得率提高约2倍,且在单位酶活下等量酶液反应所产生的目标产物HMG得率较前人报道的提高了4.7倍[16],实现目标产物的定向调控效果。为既能抑制HMG的过度酶解,又能尽量减少对橙皮苷酶的酶活影响,本实验选择最适葡萄糖浓度为3 mg/mL。
3 结论
经HPLC法测得的橙皮苷酶、α-L-鼠李糖苷酶及β-D-葡萄糖苷酶的酶活分别为12.28、3.5和0.413 U/g;酶反应最适温度为60 ℃,最适pH值4.0,此时橙皮苷酶及α-L-鼠李糖苷酶的动力学常数Km值分别为296.69 μg/mL和232.58 μg/mL,Vm值分别为0.872 3 μg/(mL·min)和0.397 9 μg/(mL·min);橙皮苷酶的热稳定性较好,是一种嗜酸性酶,在酸性条件下稳定性较高;考虑添加3 mg/mL葡萄糖抑制β-D-葡萄糖苷酶活性,增溶剂DMF添加量为0.8%,可实现橙皮苷向HMG而不是橙皮素的酶法转化的定向调控;在温度60 ℃、pH 4.0、酶用量15.35 U、DMF添加量0.8%和葡萄糖添加量3 mg/ml条件下反应3h,HMG最终得率可达35.8%。研究可为高倍查尔酮类甜味剂中间体开发提供参考,具有潜在应用价值。
