不同病理类型双侧肾癌1例报告
2018-11-14高佃军
李 晓,柳 港,李 良,高佃军
(潍坊医学院研究生院,山东潍坊 261000)
临床上肾癌多发生于单侧。双侧肾癌少见且病理类型常相同,而本文作者收治1例罕见的双侧不同病理类型的肾癌,现报告如下。
1 病例报告
患者女性,33岁因左侧腰部疼痛不适10 d入院。心、肺查体无明显异常,左腰腹可触及肿物、质硬。实验室检查未见明显异常。辅助检查:增强计算机断层扫描(computerized tomography,CT)示①左肾多发占位,恶性肿瘤不排除;②右肾上极占位(图1A)。肾动态显像示肾小球滤过率左肾30.27、右肾43.97 mL/min。行“根治性左肾切除术 (radical nephrectomy,RN)”。术后病理示:(左肾)嫌色细胞癌,免疫组化染色结果显示:Vimentin(-),CD10(-),EMA(+),CK7(+),E-cadherin(+),CD117(-),P504S(-),CK20(-),CD15(-),Ki-67阳性细胞占5%(图2A)。
2个月后复诊。专科查体及实验室检查未见明显异常。辅助检查:CT平扫示①左肾切除术后;②右肾上极实性肿物。肾动态显像示①肾小球滤过率 75.82 mL/min;②右肾上极局限性放射性稀疏缺损,结合临床考虑右肾占位;③左肾缺如。根据患者身体状况及病情,行“腹腔镜下保留肾单位手术(nephron-sparing surgery,NSS)”。术后病理示:(右肾上极肿物)结合免疫组化及齐鲁医院会诊意见病变符合透明细胞癌。免疫组化染色结果显示:Vimentin(+),CD10(+),EMA(+),CK(+),CK7(+),E-cadherin(+),CD117(-),P504S(-),CK20(-),CD15(-),HMB-45(-),Melan-A(-)(图2B)。
第二次术后3个月复诊。专科查体、实验室检查均未见明显异常,辅助检查:CT增强示:①左肾术后缺如;②右肾部分切除术后,右肾下极小圆形低密度影(图1B)。再次行“NSS”治疗。术后病理示:(右肾下极肿物)肾透明细胞癌合并肉瘤样变(图2C)。
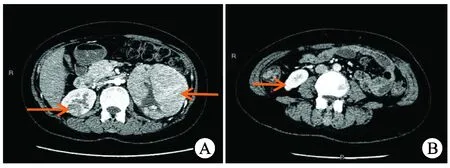
图1 双侧不同病理类型肾癌患者增强CT图片
A:左肾多个类圆形混杂影,边缘欠清晰较大者其内可见多发斑点状略高密度影及低密度区,呈明显强化;右肾类圆形稍高密度影,边缘不清,动静脉期均明显强化,延迟扫描呈相对低密度影;B:右肾下极一小圆略高密度影,边界欠清,动脉期其内点状明显强化影,延迟期呈略低密度影。

图2双侧不同病理类型肾癌患者术后组织病理镜图(HE,×400)
A:肾嫌色细胞癌,癌细胞膜厚而清晰,类似植物细胞,可见核周空晕; B:肾脏透明细胞癌,癌细胞透明,呈巢状排列,薄壁窦状血管构成网状间隔; C:肾透明细胞癌合并肉瘤样变,细胞变梭形,核异性大,核仁明显。
2 讨 论
双肾癌发病率极低,仅占肾癌的1%~5%。据文献报道单侧肾癌患者对侧肾发生肿瘤的可能性随年龄的降低而增加,与单侧肾癌相比,双肾癌为多灶性的概率显著增加[1]。目前肾癌多中心病灶的发生机制尚不清楚。国外诸多研究认为,多灶性肾细胞癌(multifocal renal cell carcinoma,MRCC)是肾癌原发病灶以肾内转移的方式形成,且各个病灶的恶性程度和原发灶一致,但肾肿瘤病灶数目的多少并不影响其预后[2]。国内外对不同病理类型双侧肾癌报道极少,2016年RASPOLLINI[3]报告1罕见病例,1名患者在3年内诊断出5个不同的肾脏肿瘤,显示3种不同的组织类型。本例患者左侧为肾嫌色细胞癌,右侧为肾透明细胞癌及肾透明细胞癌合并肉瘤样变,提示双侧肾肿瘤可以均为原发性,同时进一步证明同一机体双侧肾肿瘤出现不同病理类型是存在的。
对于双侧肾癌患者术前明确诊断及准确定位是手术成功的前提。有研究数据表明,在拟行RSS手术中,有51%患者因术中发现多个病灶而临时更改手术方案[4]。 肾癌不同亚型之间的CT表现存在一定的差异,临床可以通过CT征象及CT定量分析对肾癌亚型进行初步判断[5]。
目前,RN和RSS是安全可行的手术治疗方式[2,6],既要完整的切除肿瘤,也要尽量多的保留患者的肾功能。有研究显示,双侧肾癌患者双肾均行手术治疗、单侧行手术治疗、双侧均未治疗的3 年肿瘤特异性生存率(cancer specific survival,CSS)分别为97.7%、27.7%、0%[7]。故早发现、早诊断,有利于治疗方案的选择、提高生存率。
肾癌病理类型不同,预后不同。目前的观点认为,肾嫌色细胞癌较肾透明细胞癌的预后要好,且转移率低。对于双侧肾癌的预后是否比单侧肾癌差,仍存在争议,治疗时机、手术方案以及个体差异性的不同可能是造成这种结果的原因之一。患者除定期复查腹部CT外,还应注意胸部和骨扫描等转移性检查,明确病情及转移程度。目前随访中,无明显肿瘤复发及转移征象。
