c-FOXP3对肾透明细胞癌体外侵袭迁移的效应及机制研究
2018-11-14朱国栋张海宝王新阳贺大林
种 岳,朱国栋,张海宝,徐 珊,王新阳,贺大林
(西安交通大学第一附属医院泌尿外科,陕西西安 710061)
1 材料与方法
1.1实验材料786-O和ACHN细胞系,均购于美国ATCC细胞库;Millicell小室(Millipore,USA);细胞培养皿(Corning,USA);Matrigel(BD,USA);RPMI-1640培养基(Gibco,USA);胎牛血清(杭州四季青公司,China);0.25%胰酶(Sigma,USA);一抗:anti-FOXP3(Abcam,ab20034),二抗:山羊抗鼠(北京中杉金桥,ZB-2305),羊抗兔(北京中杉金桥,ZB-2301);ECL发光液(Bio-rad,USA)。从TCGA(The Cancer Genomic Atlas)数据库中的Human Protein Atlas子数据库下载分析528例肾癌患者的生存预后数据。
1.2实验方法
1.2.1细胞培养 使用含有10%胎牛血清的1 640培养基培养细胞,均置于37 ℃,5% CO2条件的培养箱中培养。
1.2.2细胞感染 于苏州吉玛基因公司订购c-FOXP3敲低慢病毒(含3个敲低序列和1个阴性对照),分别将786-O和ACHN接种于24孔板内,每孔4×104个细胞,完全培养基37℃、5% CO2过夜。用含2%胎牛血清的靶细胞维持液更换完全培养基并分别加入病毒10 μL,培养过夜后更换为完全培养基继续培养,待细胞需要传代时传至6 cm培养皿并加入嘌呤霉素筛选(786-O 1 μg/μL;ACHN 6 μg/μL),利用Western blot鉴定敲低效率。
1.2.3Western blot 收集细胞团块并用PBS清洗细胞团块3次,加入含蛋白酶抑制剂的细胞裂解液,冰浴10 min,于预冷的4度离心机15 000 r/min离心15 min后收集上清,使用BCA试剂盒测定蛋白浓度后加入6×上样缓冲液并于沸水中煮5 min。利用聚丙烯酰胺凝胶电泳将不同分子质量大小蛋白分离,将凝胶上蛋白连同marker转移至PVDF膜,5%牛奶封闭1 h,分别加入相应的一抗(c-FOXP3 1∶1 000;β-actin 1∶1 000; N-cadherin 1∶1 000; E-cadherin 1∶1 000; Vimentin 1∶1 000),4 ℃摇床过夜。TBST缓冲液洗膜三次,每次10 min,孵育相应二抗(山羊抗兔、山羊抗鼠均为1∶3 000稀释)1 h,TBST缓冲液洗膜3次,每次10 min。加入显影液显影。
1.2.4划痕实验 用marker笔在6孔板背后,用直尺均匀划横线,大约每隔0.5~1 cm一道,横穿过孔,每孔至少穿过3条线。在每孔中接种约5×105个细胞(786-O和ACHN),将培养板置于 37 ℃,5% CO2培养箱内过夜,第2天用微量上样器吸头垂至于背后的横线划痕,用PBS缓冲液洗细胞3次并加入无血清培养基,继续放入37 ℃、5% CO2培养箱培养分别并于0、24、36、48 h取样,拍照。
1.2.5Transwell细胞迁移实验及侵袭实验 分别向Millicell小室的上室加入 200 mL 786-O和ACHN细胞悬液,含4×104个细胞。向小室的下室加入含10%胎牛血清培养基800 μL,将培养板置于 37 ℃,5% CO2培养箱内培养24 h。取出小室,用棉签擦去上室的细胞。PBS缓冲液洗小室3次后,将下室细胞置于4%多聚甲醛溶液中固定 10 min。再用 PBS缓冲液洗小室3次,随后将下室置于0.1%结晶紫染液染色10 min。PBS缓冲液洗去残留结晶紫染料后置于显微镜下观察。取 5个100×随机视野计数穿膜细胞个数并计算出 5个视野的穿膜细胞平均数。侵袭实验:将已包被Matrigel(与无血清培养基1∶5稀释)的孔径8 μm的小室置于 24 孔板的孔内。向小室的上室加入 200 mL 786-O细胞悬液,含 8×104个细胞。向小室的下室加入含10%胎牛血清培养基800 μL,将培养板置于37 ℃,5% CO2培养箱内培养24 h。处理方法同迁移实验,并拍照计数。
1.3统计学方法使用SPSS 18.0统计软件分析数据,采用双尾t检验比较两组数据,以P<0.05为差异有统计学意义。
2 结 果
2.1c-FOXP3表达水平与肾透明细胞癌患者预后有关528例肾透明细胞癌患者(来自TCGA数据库中的子库Human Protein Atlas)分为两组,其中183例患者低表达c-FOXP3,345例患者高表达c-FOXP3,生存分析结果示低表达c-FOXP3组的患者总生存率明显高于高表达c-FOXP3组,结果显示差异有统计学意义(P<0.05,图1),提示c-FOXP3表达水平低的肾透明细胞癌患者,总生存率较高。
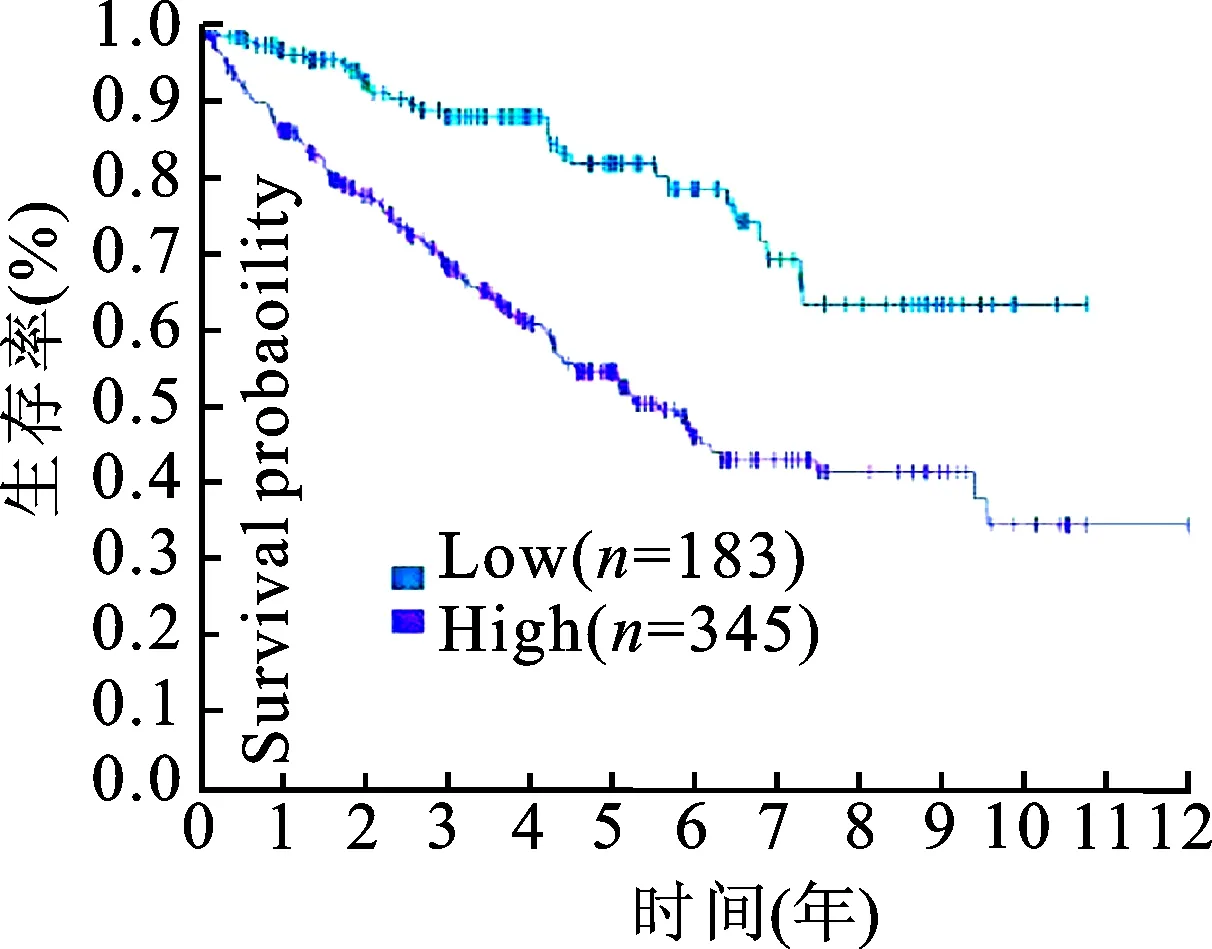
图1 低表达及高表达c-FOXP3的肾透明细胞癌患者的生存率比较(P<0.05)
2.2c-FOXP3敲低细胞的体外迁移能力受到抑制细胞划痕实验表明c-FOXP3敲低组细胞体外迁移能力较对照组减弱,Transwell小室迁移实验证实786-O及ACHN,c-FOXP3敲低组细胞穿过小室细胞数均少于对照组,统计分析差异有统计学意义(P<0.05,图2、图3),由此推断c-FOXP3可能促进肾癌细胞的体外迁移能力。
2.3c-FOXP3敲低后细胞体外侵袭能力减弱Transwell小室侵袭实验表明c-FOXP3敲低组细胞穿过小室的细胞数明显少于对照组,统计学分析差异有统计学意义(P<0.05,图4),由此推断c-FOXP3可能促进肾癌细胞的体外侵袭能力。
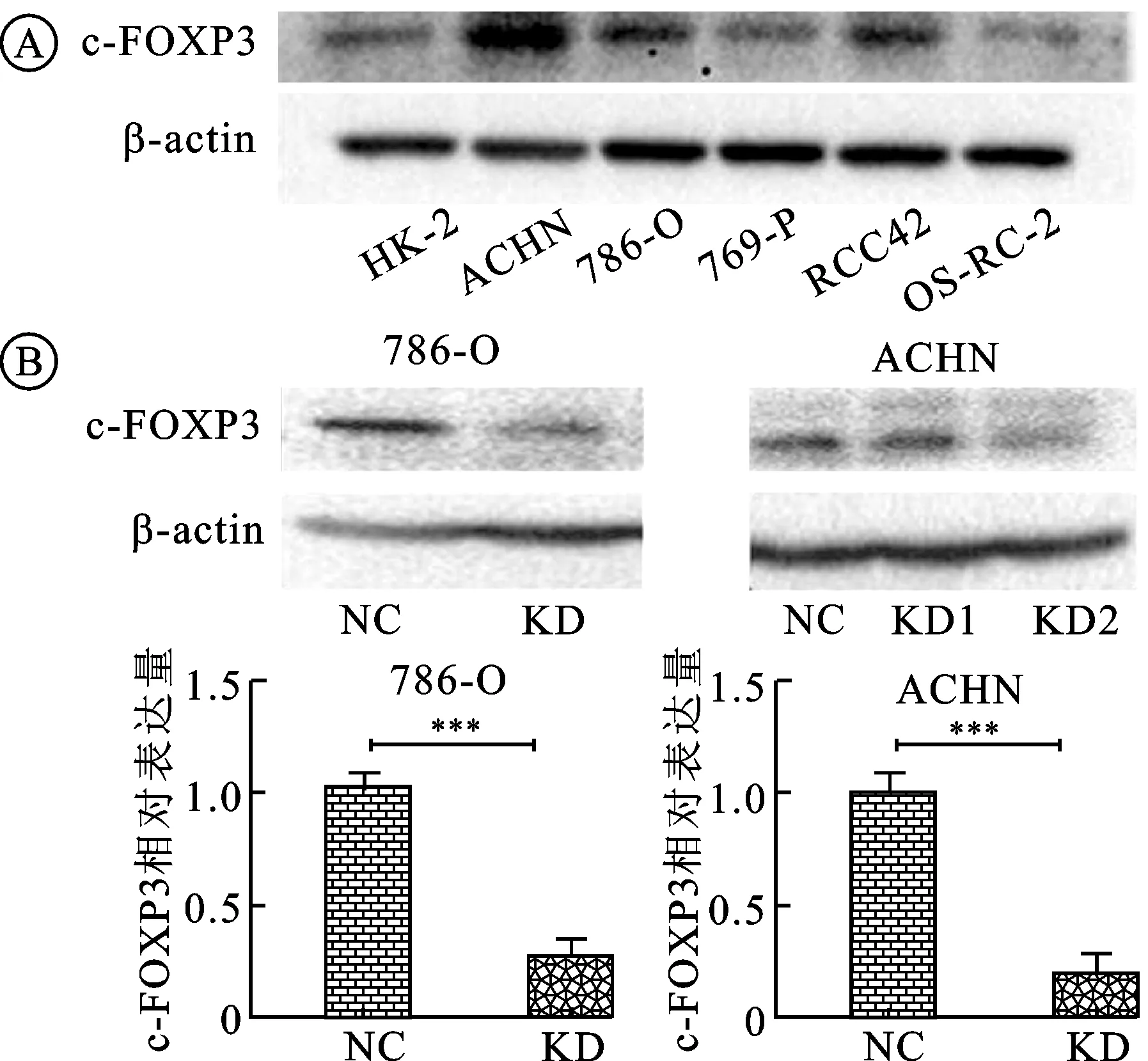
图2 c-FOXP3在肾癌细胞中的表达
A:Western blot法鉴定人肾癌786-O和ACHN细胞系中c-FOXP3存在高表达(×100);B:Western blot法鉴定c-FOXP3敲低组细胞(KD)及对照组细胞(NC)在786-O和ACHN细胞系中c-FOXP3的敲低效率及其柱状图[其中ACHN的KD1 和KD2分别是两个c-FOXP3的敲低细胞株(KD2细胞株c-FOXP3的敲低效率较高,后续实验均使用KD2作为c-FOXP3敲低的ACHN细胞株)]。
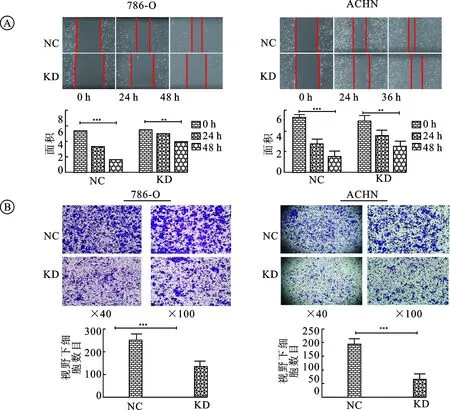
图3 c-FOXP3可提高肾癌细胞的体外迁移能力
A:786-O和ACHN划痕实验中KD、NC组细胞体外迁移能力比较及其柱状图(c-FOXP3敲低组细胞体外迁移能力弱于对照组P<0.05);B:786-O和ACHN Transwell小室迁移实验中KD、NC组细胞体外迁移能力比较及其柱状图(c-FOXP3敲低组体外迁移细胞数明显少于对照组,P<0.05)。
A:人肾癌细胞786-O的c-FOXP3敲低组细胞(KD)的体外侵袭能力明显低于对照组细胞(NC);B:柱状图显示人肾癌细胞786-O的KD组细胞穿越基质层及小室的数目明显少于NC组(P<0.05)。
2.4c-FOXP3促进肾癌侵袭迁移相关蛋白的表达Western blot检测发现肾癌侵袭迁移相关指标N-cadherin和Vimentin在c-FOXP3敲低的786-O和ACHN组表达水平均较对照组低(P<0.05,图5),由此推断c-FOXP3可能是促进肾癌侵袭、迁移的重要转录因子。

图5Westernblot检测间质细胞标志蛋白在c-FOXP3敲低的786-O和ACHN组(KD)及对照组(NC)细胞的表达水平及其柱状图
A:Western blot检测证实间质细胞标志蛋白N-cadherin和Vimentin均在c-FOXP3敲低的786-O和ACHN细胞中表达下调;B:柱状图显示N-cadherin和Vimentin在c-FOXP3敲低的786-O和ACHN组细胞(KD)中的表达水平均较对照组细胞(NC)减低(P<0.05)。
3 讨 论

KARANIKAS等[12]研究了25个不同组织来源的细胞株,包括肺癌、结肠癌、乳腺癌、黑色素瘤、红白血病、急性T细胞白血病等,结果发现 c-FOXP3的mRNA和蛋白质在所有肿瘤细胞株中均被检测到,仅表达水平不同,而与组织来源无关。c-FOXP3在不同肿瘤发展、演进中作用不尽相同,包括促进肿瘤演进,以及抑制肿瘤生长两个方面。对非小细胞肺癌患者的组织切片进行免疫组织化学染色,发现TNM分期较晚的患者中c-FOXP3阳性率较高,且c-FOXP3表达阳性的患者生存率明显低于阴性组[13]。在胃癌中有报道,c-FOXP3可与NF-κB相互作用而减少NF-κB与COX-2启动子的结合,进而影响COX-2的表达而发挥肿瘤抑制作用[14]。WANG等[15]发现趋化因子CCL5可以被c-FOXP3反式激活,从而由外周血向胰腺癌肿瘤微环境中招募更多的c-FOXP3+ 的Treg细胞,促进胰腺癌的演进。该研究提示,癌组织中表达的c-FOXP3可能作为重要的转录因子,调节趋化因子表达,进而向肿瘤微环境中招募炎症细胞,并促进肿瘤的演进。
通过对TCGA数据库分析,我们得知c-FOXP3在肾癌中的表达量与患者预后具有明显相关性,肾癌组织中c-FOXP3表达量相对较低的患者,临床预后较好。通过对常见肾癌细胞株进行c-FOXP3免疫印迹检测,发现786-O、ACHN和RCC42细胞中c-FOXP3表达水平较高。我们进而借助慢病毒感染技术建立了786-O和ACHN细胞的 c-FOXP3敲低细胞系,并进行了一系列癌细胞体外侵袭、迁移相关的生物学检测。细胞划痕实验和Transwell小室迁移实验表明,c-FOXP3敲低组肾癌细胞的迁移能力均较对照组下降;Transwell侵袭实验证实,c-FOXP3敲低组肾癌细胞的侵袭能力较对照组也有明显降低。由此我们可以看出,c-FOXP3作为转录因子,确实对肾癌侵袭、迁移这一肿瘤生物学行为具有促进作用。为进一步探讨分子机制,我们测定了肿瘤EMT相关蛋白标志物的表达,结果发现786-O及ACHN细胞系中,c-FOXP3敲低组细胞中N-cadherin和Vimentin表达水平均较对照组降低。c-FOXP3表达水平与“上皮-间质转化”(epithelial-mesenchymal transition,EMT)标志物的表达呈现同一变化趋势,提示肾癌的侵袭、迁移与c-FOXP3介导的EMT通路激活可能相关。
肿瘤转移是导致恶性肿瘤患者死亡的主要原因。新生血管形成在肾癌的演进中发挥重要作用,多项研究提示肥大细胞在肾癌组织中的浸润数目明显高于正常组织,肿瘤细胞分泌的多种趋化因子均可促进肥大细胞在肿瘤局部聚集。作为肿瘤微环境中重要成分的肥大细胞,可分泌一系列具有促进血管形成作用的活性因子,借鉴WANG等[15]的研究结果,我们认为c-FOXP3可能作为重要的转录因子,调节趋化因子表达,进而向肿瘤微环境中招募包括肥大细胞在内的多种炎症细胞,并促进肿瘤演进。除肿瘤微环境可能影响癌症演进,近年来以E-cadherin等上皮细胞标志物表达下调及功能缺失,同时N-cadherin、 Vimentin等间质细胞标志物表达上调为特征的EMT在肿瘤侵袭、转移研究中的作用受到越来越多的关注[16-17]。根据已有的研究表明,TGF-β、Wnt/β-catenin、 Notch、Hedgehog、IL-6/STAT3以及NF-κB等信号通路可诱导EMT进程。Snail1、Snail2、Twist1、Twist2、ZEB1和ZEB2等转录因子在EMT中发挥重要作用[18-19]。c-FOXP3作为重要的转录因子,其在NF-ΚB信号通路中的参与提示其可能对EMT有一定贡献,通过我们的实验初步验证了c-FOXP3通过某种机制促进N-cadherin和Vimentin的表达,从而促进肾透明细胞癌EMT进程。这一研究提示我们,c-FOXP3可能成为促进肾癌EMT的潜在转录因子,抑制c-FOXP3可能作为将来肾透明细胞癌治疗的新靶点。
