基于亚硫酸盐的六价铬−苯酚污染废水协同处理研究
2018-11-13闫松张成武呼博识郭超秦传玉
闫松,张成武,呼博识,郭超,秦传玉
基于亚硫酸盐的六价铬−苯酚污染废水协同处理研究
闫松,张成武,呼博识,郭超,秦传玉
(吉林大学 新能源与环境学院,吉林 长春,130012)
探讨基于亚硫酸盐的六价铬−苯酚复合污染废水协同处理的可行性。探究重金属−六价铬、有机物−苯酚协同处理的效果、影响因素及机理。研究结果表明:该体系可以快速且同时实现六价铬还原和苯酚降解;降解效率随体系初始pH降低而逐渐增大,本实验条件范围内最佳pH为3.0;Fe2+,Fe3+和Mn2+均在不同程度上抑制六价铬还原和苯酚降解,Al3+对该体系处理效果没有显著影响;仅当有氧气存在时体系能生成羟基自由基和硫酸根自由基进而氧化降解苯酚,其中起主要作用的是硫酸根自由基。该体系可以为复合污染废水的处理提供有效的依据,实现协同、绿色的水处理。
六价铬;苯酚;亚硫酸盐;自由基;协同处理
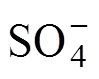
1 实验
1.1 实验试剂
无水亚硫酸钠、4-氨基安替比林(分析纯,天津市光复精细化工研究所);重铬酸钾(质量分数为99.8%,分析纯,天津市光复科技发展有限公司);苯酚、氢氧化钠、硫酸、磷酸、丙酮、异丙醇(分析纯,北京化工厂);二苯基碳酰二肼、氯化铵、铁氰化钾、一水合硫酸锰(分析纯,国药集团化学试剂有限公司);叔丁醇(化学纯,国药集团化学试剂有限公司);氨水、过氧化氢(质量分数为30%,分析纯,西陇化工股份有限公司);硫酸亚铁(质量分数为99.0%~101.0%,天津市光复精细化工研究所);三氯化铁(质量分数为99.0%,天津市光复科技发展有限公司);硫酸铝(分析纯,天津市华东试剂厂);高纯氮气。
1.2 实验仪器
HZK−210电子天平(福州华志科学仪器有限公司);PL203电子天平(梅特勒−托利多仪器(上海)有限公司);YSI pH100 pH计(美国黄泉仪器有限公司);HJ−6A数显恒温磁力搅拌器(金坛市医疗仪器厂);EVOLUTION 201紫外分光光度计(Thermo Fisher Scientific - Shanghai);SPECTRONIC 200E可见分光光度计(Thermo Fisher Scientific-Shanghai);YQAR−731L氩气减压器(余姚市华隆焊割仪表厂);LZB−3WB玻璃转子流量计(祥云流量仪表厂)。
1.3 实验方法
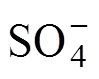
1.4 分析方法
六价铬离子浓度测定采用二苯碳酰二肼分光光度法[11],原理为六价铬与二苯碳酰二肼在酸性条件下反应生成紫红色络合物,显色一段时间后于540 nm波长下进行分光光度测定。
苯酚浓度测定采用4-氨基安替比林直接分光光度法[12],原理为在pH为10.0±0.2体系中,苯酚与4-氨基安替比林在有铁氰化钾存在时反应生成安替比林染料,呈橙红色。显色10 min后,于510 nm波长下进行分光光度测定。通过进行对比实验可知:虽然六价铬本身呈橙红色,但六价铬浓度较低情况下其对于苯酚的显色及分光光度测定基本无影响。
2 结果及分析
2.1 对照实验
图1所示为不同实验体系下六价铬和苯酚的转化降解效果。反应条件如下:苯酚浓度为0.02 mmol/L,六价铬浓度为0.1 mmol/L,亚硫酸盐浓度为 0.8 mmol/L,pH为3.0。
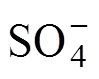
通过图1(a)中六价铬的2条转化曲线也能发现,与含有苯酚的体系相比,未加入苯酚的体系中六价铬的还原效率较低,这是由于体系产生的活性自由基在没有有机污染物消耗的情况下会与六价铬的还原产物,即三价铬作用再次生成六价铬,导致六价铬的还原受到影响。
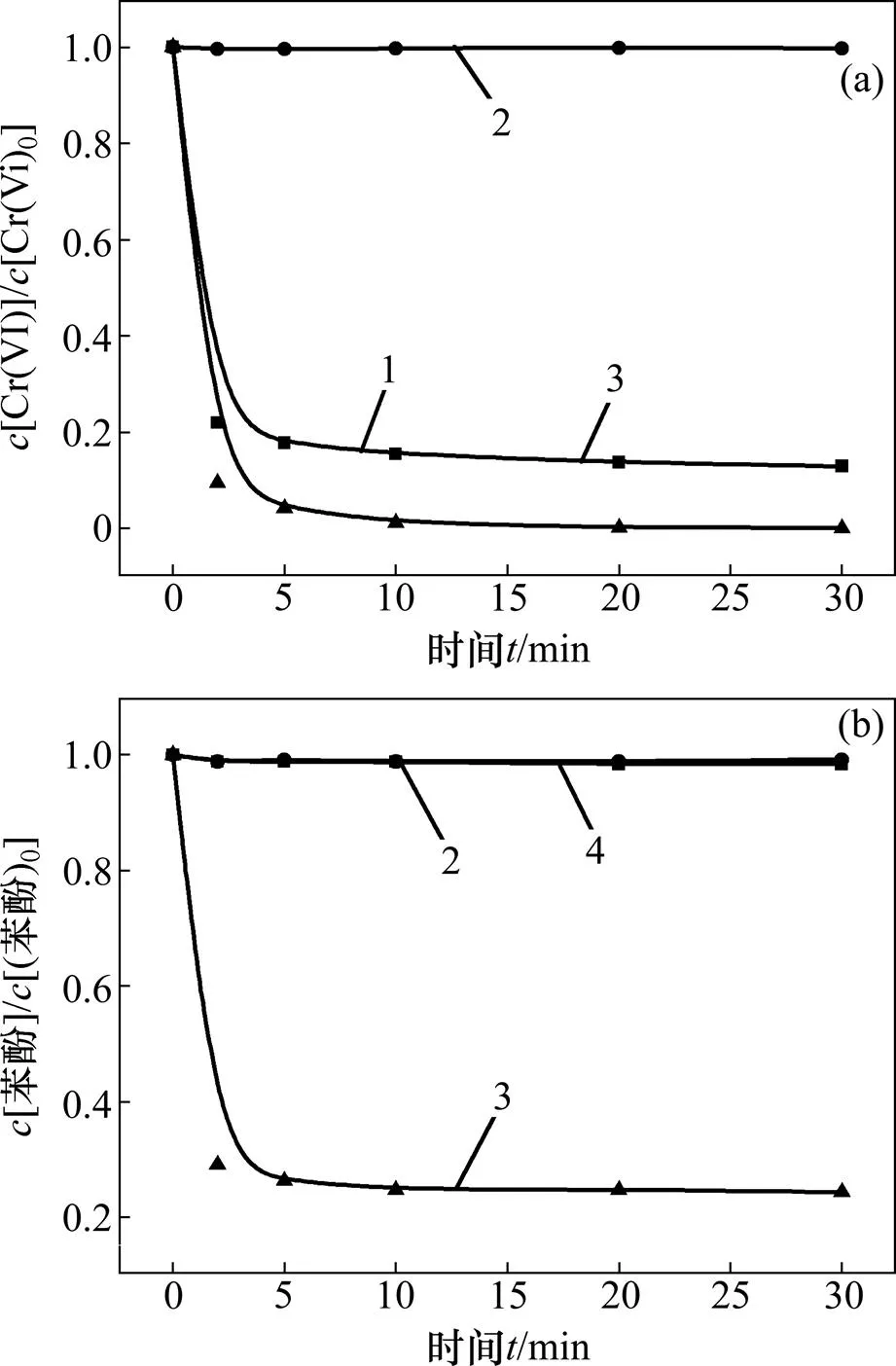
(a) 六价铬浓度变化;(b) 苯酚浓度变化
体系组分:1—Cr6++Na2SO3;2—Cr6++C6H6O; 3—Cr6++Na2SO3+C6H6O;4—Na2SO3+C6H6O。
图1 不同条件的对照实验中六价铬及苯酚浓度变化
Fig. 1 Change of hexavalent chromium and phenol concentration in control experiment of different conditions
2.2 反应初始pH对体系降解效果的影响
图2所示为体系初始pH对反应效果的影响。反应条件如下:苯酚浓度为0.02 mmol/L,六价铬浓度为0.1 mmol/L,亚硫酸盐浓度为0.8 mmol/L。
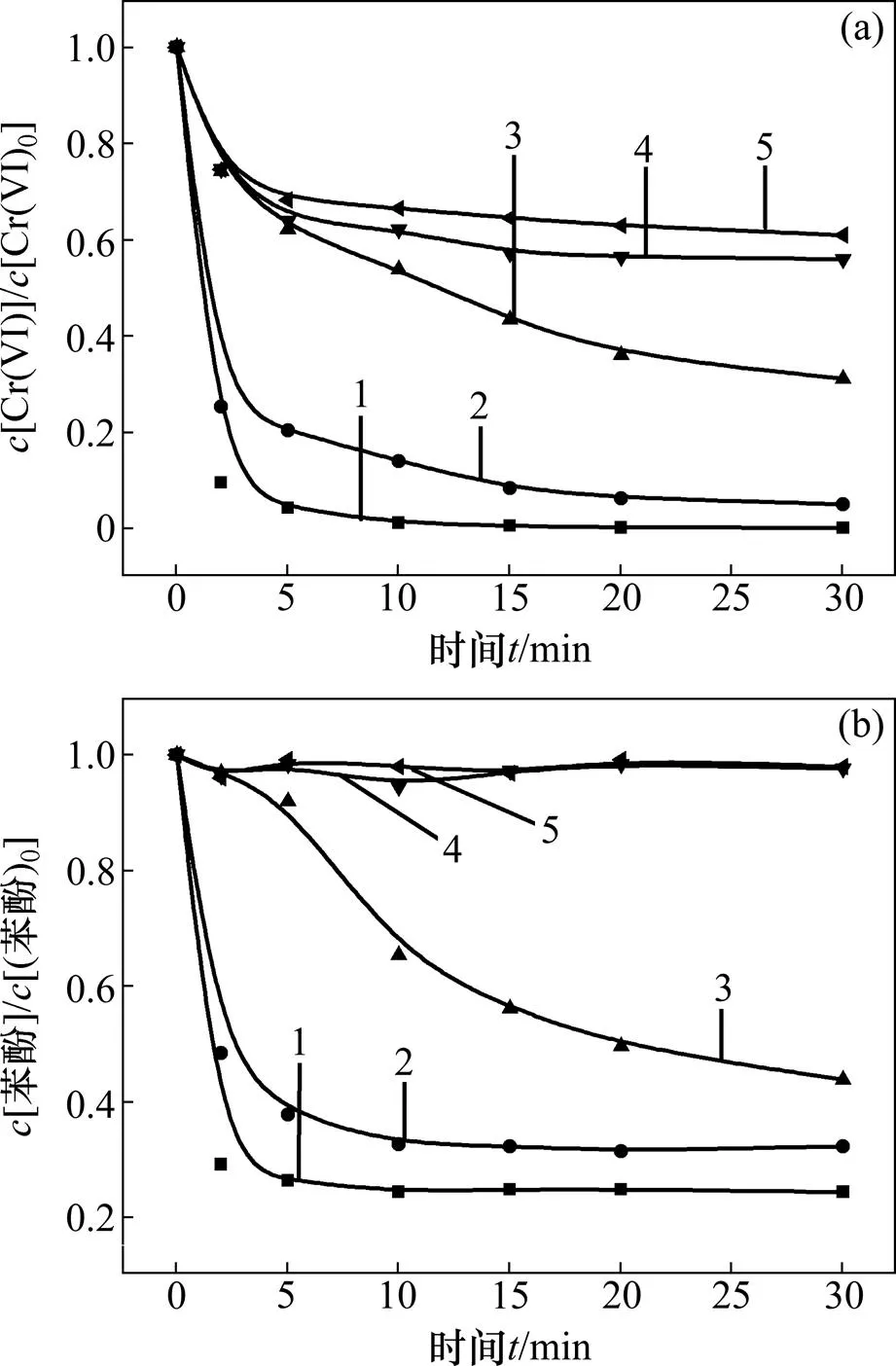
(a) 六价铬浓度变化;(b) 苯酚浓度变化
由图2(a)可以看出:亚硫酸盐在酸性和中性条件下均能还原六价铬,且随着pH降低,六价铬还原效率逐渐升高,pH为3.0时可以达到99.8%。由图2(b)可以看出:在中性条件下,该体系中苯酚降解率<2%,几乎不降解;随着pH降低,苯酚降解率逐渐升高,pH为3.0时可以达到75.6%。

2.3 Cr6+与SO32−浓度比对体系降解效果的影响
通过改变六价铬和亚硫酸盐浓度来探究其浓度比对体系降解效果的影响并确定特定苯酚浓度下实验使用最适浓度比,其结果如图3所示。反应条件如下:苯酚浓度为0.02 mmol/L,pH为3.0。
由图3(a)和图3(b)可以看出:当六价铬浓度不变时,六价铬还原及苯酚降解效率均随亚硫酸盐浓度的增大而增大,0.8 mmol/L亚硫酸盐的体系降解效率最大,再增加其浓度降解效率基本不发生变化,表明在0.1 mmol/L的初始六价铬浓度下,0.8 mmol/L是体系降解的最佳亚硫酸盐浓度。由图3(c)和图3(d)可以看出:0.8 mmol/L亚硫酸盐对于0.05 mmol/L和 0.10 mmol/L的六价铬还原是充分的,但该条件下苯酚降解不完全;0.15 mmol/L六价铬条件下苯酚降解效率较高,但0.8 mmol/L的亚硫酸盐对于0.15 mmol/L的六价铬还原是不足的。
综合考虑六价铬还原及苯酚降解,Cr6+与SO32−的浓度比即(Cr6+):(SO32−)=0.1:0.8时,体系的转化降解效果最好,此时对应的苯酚降解了75.6%(即0.015 mmol/L)。
2.4 金属离子的影响
二价及三价金属离子在许多废水中与六价铬共存且较丰富,例如酸性矿井排水和电镀废水[15]。通过向反应体系中添加硫酸亚铁、三氯化铁、硫酸锰、硫酸铝来考察Fe2+,Fe3+,Mn2+和Al3+几种常见金属离子对体系降解效率的影响,其结果如图4所示。反应条件如下:苯酚浓度为0.02 mmol/L,六价铬浓度与金属离子浓度均为0.1 mmol/L,亚硫酸盐浓度为 0.8 mmol/L,pH为3.0。
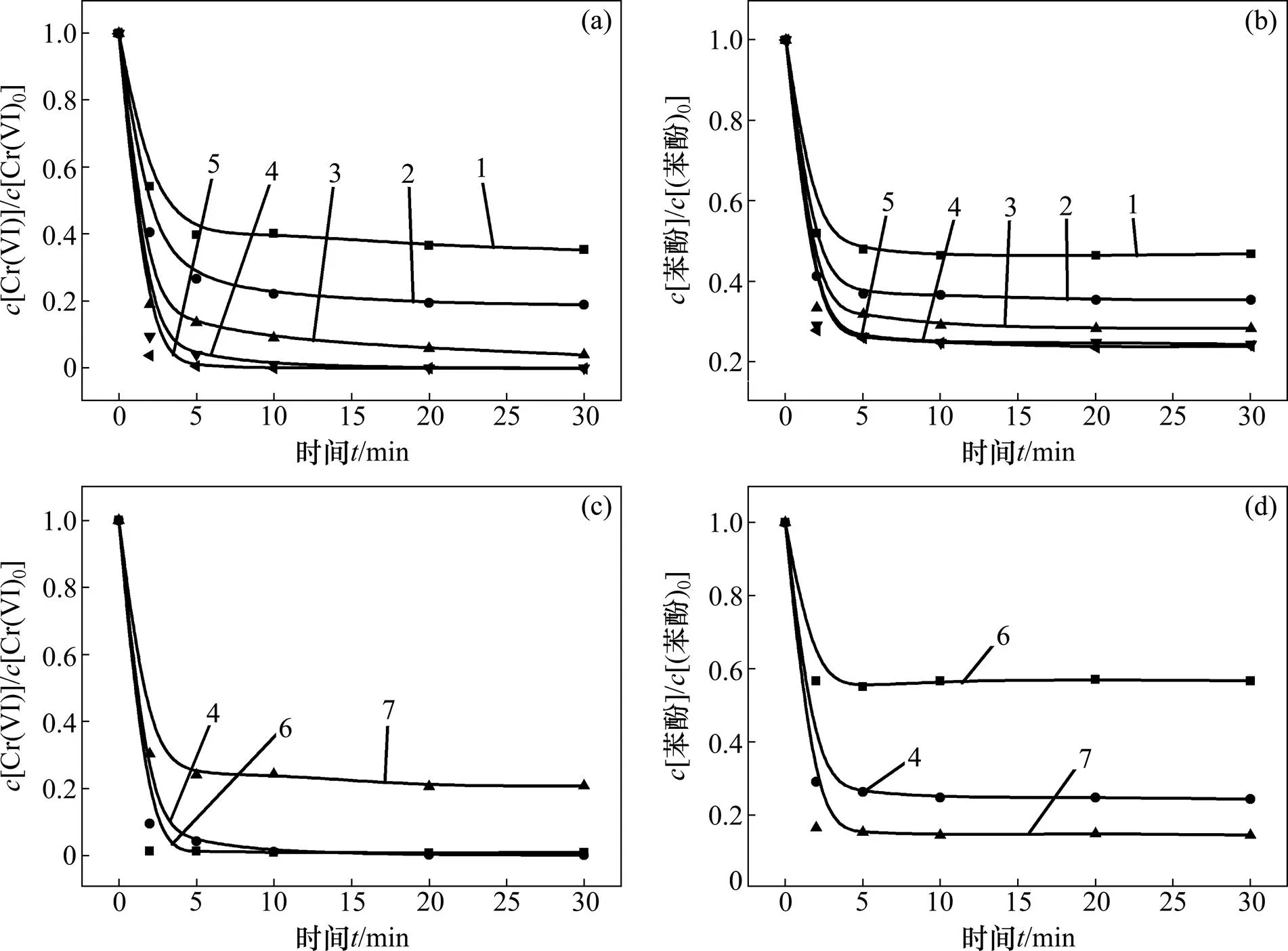
(a) 不同SO32−初始浓度下反应体系中六价铬浓度变化;(b) 不同SO32−初始浓度下反应体系中苯酚浓度变化; (c) 不同Cr6+初始浓度下反应体系中六价铬浓度变化;(d) 不同Cr6+初始浓度下反应体系中苯酚浓度变化 Cr6+与SO32−浓度比:1—0.1:0.3;2—0.1:0.5;3—0.1:0.65;4—0.1:0.8;5—0.1:1;6—0.05:0.8;7—0.15:0.8。
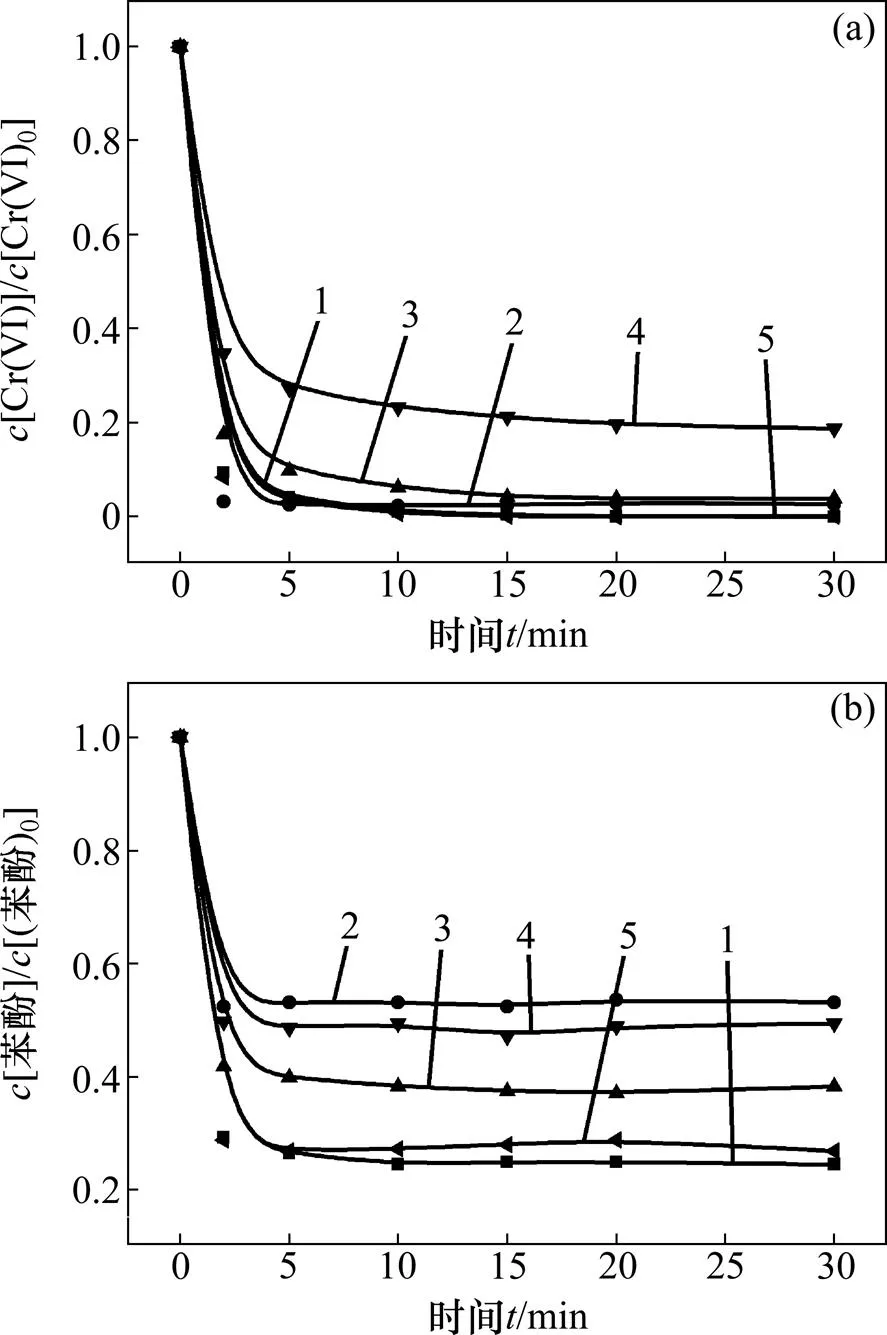
(a) 六价铬浓度变化;(b) 苯酚浓度变化
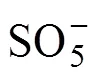
2.5 氧气的作用
通过氮气吹扫排出反应体系中的溶解氧,并在反应过程中持续通氮气以确保建立无溶解氧的环境来研究氧气对体系中苯酚降解的影响,确定氧气在该体系中的作用。反应条件如下:苯酚浓度为0.02 mmol/L,六价铬浓度为0.1 mmol/L,亚硫酸盐浓度为 0.8 mmol/L,pH为3.0。
由图5可以看出:有氧气存在的体系苯酚能被降解且效果较好,而在没有氧气的体系中六价铬虽然仍能被还原,但是氧气是使苯酚降解的必要条件,说明氧气参与了自由基生成的反应过程。


(a) 六价铬浓度变化;(b) 苯酚浓度变化
2.6 自由基淬灭
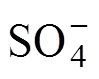
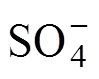
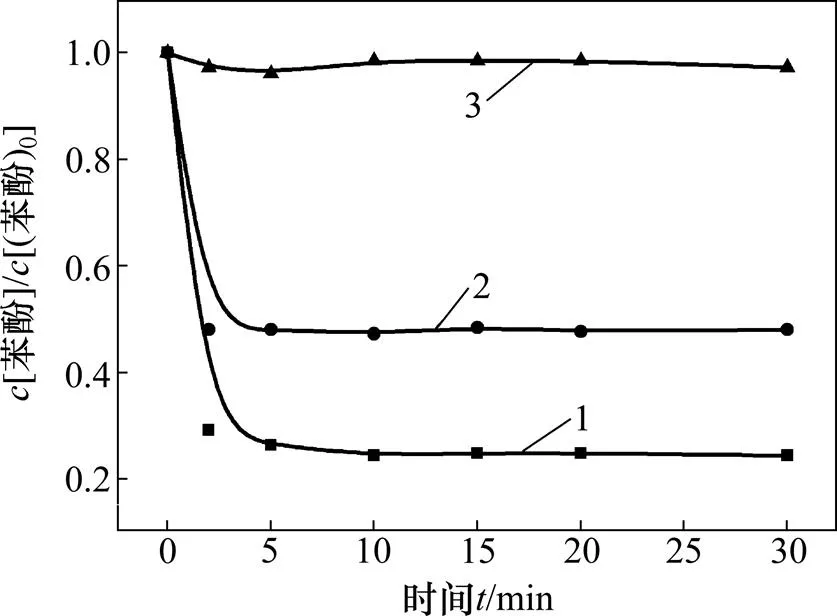
掩蔽剂:1—无;2—TBA;3—IPA。
3 机制研究

HCrO4−+HSO3−=CrSO62−+H2O (1)
HSO3−+CrSO62−+H+=[CrO2(SO3)2]2−+H2O (2)
[CrO2(SO3)2]2−+4H2O+2H+=

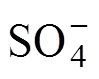
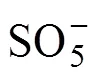
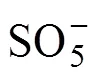
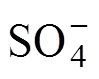
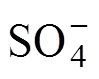
然而,反应不总是朝着生成活性自由基的方向进行,由反应式(1)生成的CrSO62−可以与HCrO4−反应生成中间产物O3CrOCrO3SO32−,其可以分解为Cr5+进而被HSO32−还原为Cr3+,具体过程如反应式(9)~(11)所示[19]。
CrSO62−+H++HCrO4−=O3CrOCrO3SO32−+H2O (9)
O3CrOCrO3SO32−=2Cr(V)+SO42−(10)
Cr(V)+S(IV)=Cr(III)+S(VI) (11)
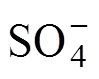


4 结论
1) 在六价铬与亚硫酸盐浓度比为0.1:0.8条件下,该体系可以快速且同时实现六价铬还原和苯酚降解,且六价铬和苯酚去除率较高可达到99.8%和75.6%。
2) 体系降解效率随初始pH的降低而增加,本实验体系最佳初始pH为3;Fe2+,Fe3+和Mn2+均在不同程度上抑制六价铬还原和苯酚降解,Al3+对该体系处理效果没有显著影响。
4) 本研究的目的在于协同处理重金属六价铬、有机物苯酚复合污染,但这2种物质去除效率及难易程度不同,六价铬被还原成三价铬相对比较容易,但苯酚需要该体系在酸性条件下才能得以降解,因此,在使用该技术对复合污染废水进行处理前,需对六价铬和有机物的浓度比进行充分研究。此外,三价铬在pH为3.0的强酸体系下可能仍以溶解态形式存在,需后续进行酸碱调整,以彻底通过沉淀去除。
[1] 郭红岩, 王巍, 王晓蓉, 等. 一种淋洗修复重金属−有机物复合污染土壤的方法: 中国, CN101293254[P]. 2008−10−29. GUO Hongyan, WANG Wei, WANG Xiaorong, et al. A method for leaching and repairing heavy metal-organic compound contaminated soil: China, CN101293254[P]. 2008−10−29.
[2] 孙洪良. 复合改性膨润土对水中有机物和重金属的协同吸附研究[D]. 杭州: 浙江大学环境与资源学院, 2010: 95−119. SUN Hongliang. Study on simultaneous sorption of organic pollutants and heavy metals to bentonite modified by surfactant and organic ligands from water[D]. Hangzhou: Zhejiang University. College of Environment and Resources, 2010: 95−119.
[3] 潘翠. 混合细菌群体对六价铬和苯酚的同时去除[D]. 长沙: 湖南大学环境科学与工程学院, 2008: 1−62. PAN Cui. Simultaneous removal of Cr(VI) and phenol in a consortium bacterial culture[D]. Changsha: Hunan University. College of Environmental Science and Engineering, 2008: 1−62.
[4] 段国凤. 粘质沙雷氏菌去除水中Cr(VI)-邻二氯苯复合污染的研究[D]. 长沙: 湖南大学环境科学与工程学院, 2014: 1−69. DUAN Guofeng. A research on the Removal of combined contamination of Cr(VI) and o-dichlorobenzene in water by S. marcescens ZD0559[D]. Changsha: Hunan University. College of Environmental Science and Engineering, 2014: 1−69.
[5] 刘作华, 刘仁龙, 牟天明, 等. 微波促进含铬废渣催化H2O2降解甲基橙溶液研究[J]. 光谱学与光谱分析, 2008, 1(8): 1900−1904. LIU Zuohua, LIU Renlong, MOU Tianming, et al. Degradation of methyl orange solution by microwave-assisted catalysis of H2O2with chromium residue[J]. Spectroscopy and Spectral Analysis, 2008, 1(8): 1900−1904.
[6] 刁增辉, 徐向荣. 一种利用零价铁−过硫酸盐同时去除重金属−有机物复合污染水体的方法: 中国, CN105110448A[P]. 2015−12−02. DIAO Zenghui, XU Xiangrong. A method of using zero valent iron-persulfate to simultaneously remove heavy metal-organic compound polluted water: China, CN105110448A[P]. 2015−12−02.
[7] BOKARE A D, CHOI W. Chromate-induced activation of hydrogen peroxide for oxidative degradation of aqueous organic pollutants[J]. Environmental Science & Technology, 2010, 44(19): 7232−7237.
[8] ZHANG Li, CHEN Long, XIAO Mei, et al. Enhanced decolorization of Orange II solutions by the Fe(II)-sulfite system under xenon lamp irradiation[J]. Industrial & Engineering Chemistry Research, 2013, 52(30): 10089−10094.
[9] 吉冰冰, 肖玫, 张琳, 等. 铁−亚硫酸盐配合物体系氧化处理硫酸厂的含砷废水[J]. 水处理技术, 2014, 40(9): 52−56. JI Bingbing, XIAO Mei, ZHANG Lin, et al. Oxidation and removal of arsenic-containing wastewater from sulfuric acid factory by iron-sulfite complex system[J]. Technology of Water Treatment, 2014, 40(9): 52−56.
[10] 范文娟, 董红钰, 关小红. Cr(VI)/亚硫酸钠体系快速氧化活性蓝4的动力学研究[J]. 四川环境, 2016, 35(3): 1−7. FAN Wenjuan, DONG Hongyu, GUAN Xiaohong. Rapid oxidation of reactive blue 4 by the Cr(VI)/sulfite system: Kinetics and mechanisms[J]. Sichuan Environment, 2016, 35(3): 1−7.
[11] GB 7467—87, 水质·六价铬的测定·二苯碳酰二肼分光光度法[S]. GB 7467—87, Water quality—determination of chromium (VI) —1,5 diphenylcarbohydrazide spectrophotometric method[S].
[12] HJ 503—2009, 水质·挥发酚的测定·4-氨基安替比林分光光度法[S]. HJ 503—2009, Water quality—determination of volatile phenolic compounds—4-AAP spectrophotometric method[S].
[13] YUAN Yanan, YANG Shaojie, ZHOU Danna, et al. A simple Cr(VI)-S(IV)-O2system for rapid and simultaneous reduction of Cr(VI) and oxidative degradation of organic pollutants[J]. Journal of Hazardous Materials, 2016, 307: 294−301.
[14] CHEN Long, PENG Xinzi, LIU Jihao, et al. Decolorization of dyes in aqueous solution by Fe(II)/sulfite system:replacement of persulfate[J]. Industrial & Engineering Chemistry Research, 2012, 51: 13632−13638.
[15] JIANG Bo, LIU Yukun, ZHENG Jingtang, et al. Synergetic transformations of multiple pollutants driven by Cr(VI)-sulfite reactions[J]. Environmental Science & Technology, 2015, 49: 12363−12371.
[16] VOLPE A, PAGANO M, MASCOLO G, et al. Simultaneous Cr(VI) reduction and non-ionic surfactant oxidation by peroxymonosulphate and iron powder[J]. Chemosphere, 2013, 91: 1250−1256.
[17] NETA P, HUIE R E, ROSS A B. Rate constants for reactions of inorganic radicals in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(3): 1027−1284.
[18] BUXTON G V, GREENSTOCK C L, HELMAN W P, et al. Critical review of rate constants for reactions of hydrated electrons, hydrogen atoms, and hydroxyl radicals (•OH/O•−in aqueous solution[J]. Journal of Physical and Chemical Reference Data, 1988, 17(2): 513−886.
[19] HAIGHT G P, PERCHONOCK E, EMMENEGGER F, et al. The mechanism of the oxidation of sulfur(IV) by chromium in acid solution[J]. Journal of the American Chemical Society, 1965, 87: 3835−3840.
[20] ZHANG Wensheng, SINGH P, MUIR P, et al. Iron(II) oxidation by SO2/O2in acidic media: part I. kinetics and mechanism[J]. Hydrometallurgy, 2000, 55: 229−245.
(编辑 杨幼平)
Study on sulfite-based synergistic treatment of wastewater containing hexavalent chromium and phenol
YAN Song, ZHANG Chengwu, HU Boshi, GUO Chao, QIN Chuanyu
(College of New Energy and Environment, Jilin University, Changchun 130012, China)
The feasibility of sulfite-based synergistic treatment of hexavalent chromium and phenol polluted wastewater was investigated. The synergetic transformation efficiency, influencing factors and correlated mechanisms were analysed. The results show that this system can achieve the simultaneous and rapid effect of hexavalent chromium reduction and phenol oxidation. The transformation efficiency of both pollutants gradually increases with the decrease of pH, and the optimum pH is 3.0 in this series of experiments. Fe2+, Fe3+, Mn2+all inhibit hexavalent chromium reduction and phenol degradation to some extent, but Al3+has little influence on the treatment. In this synergistic reaction system, oxygen is necessary in generating the free radicals, such as hydroxyl radical and sulfate radical. Sulfate radical plays a major role in degrading phenol. This study can provide a basis for remediation of composite wastewater contamination, as a realization of synergistic and green wastewater treatment.
hexavalent chromium; phenol; sulfite; free radicals; synergistic treatment
10.11817/j.issn.1672−7207.2018.10.004
X523
A
1672−7207(2018)10−2391−07
2017−11−16;
2018−01−19
吉林省科技厅项目(20160520079JH);国家自然科学基金资助项目(41572213)(Project(20160520079JH) supported by Science and Technology Department of Jilin Province; Project(41572213) supported by the National Natural Science Foundation of China)
秦传玉,博士,副教授,从事水土污染控制与修复研究;E-mail:qincyu@jlu.edu.cn
