转PeTLP基因‘南林895’杨对土壤微生物的影响及外源基因分子检测
2018-11-10马晓星孙伟博诸葛强
马晓星,孙伟博,魏 辉,刘 铃,于 翔,王 璞,诸葛强
转基因‘南林895’杨对土壤微生物的影响及外源基因分子检测
马晓星1,孙伟博1,魏 辉1,刘 铃1,于 翔2,王 璞1,诸葛强1
(1. 南京林业大学 南方现代林业协同创新中心,生物与环境学院,江苏 南京 210037;2. 日本理化学研究所 植物科学中心,横滨 日本 230-0045)
转基因技术是当今林木分子育种的手段之一,但其生物安全性问题广受关注。本研究选择进入田间试验的转(类甜蛋白)基因‘南林895’杨cv. ‘Nanlin 895’为材料,开展转基因杨树对土壤微生物影响及外源基因分子检测等分析。结果显示,转基因杨树在进入田间试验一年后,外源基因仍稳定存在于转基因植株基因组中;转基因与非转基因植株根系周围可培养土壤微生物菌落数量无显著差异,表明外源基因对土壤微生物无显著影响;对土壤微生物总DNA进行分子检测也显示外源基因未有向周围土壤微生物扩散现象;叶片化感作用试验显示转基因植株叶片未对生菜L.var.Hort.种子的生长造成显著影响。初步分析结果表明,转基因‘南林895’杨在进入田间试验后未出现外源基因水平转移,也未对周围生态环境造成显著影响。
转基因植物;‘南林895’杨;田间试验;生物安全性;
杨属由于生长迅速、适应能力强、产量高、轮伐期短以及用途广泛等优点,已成为全球重要的经济树种之一。我国森林资源相对贫乏,每年需要大量进口木材才能满足国家经济建设的需要。近几十年来随着杨树产业的迅速发展,杨树人工林的面积不断增加,但由于杨树单一化种植,导致病虫害发生情况越来越严重,极大地制约了杨树产业的快速发展。因而,如何高效培育抗病虫害的杨树新品种已成为育种学家所面临的一个迫切问题。转基因技术育种目标针对性强且周期短,可大大加速育种进程[1-3]。
近年来,许多研究发现PR-5蛋白具有一定的抗真菌活性。PR-5蛋白是植物在受到生物和非生物胁迫时体内诱导产生的病程相关蛋白(PRs),参与多种真菌抗性反应过程[4]。由于PR-5蛋白的氨基酸序列与西非热带雨林灌木的苏甜蛋白氨基酸序列高度同源,因此又被称为类甜蛋白(thaumatin-like proteins,TLPs)[5]。已有许多文章报道转类甜蛋白基因植物具有一定的抗真菌活性。Mackintosh等将大麦中分离得到的-1转入小麦中过表达,可以提高对小麦赤霉病的抗性[6]。含有类甜蛋白的转基因烟草能够延缓由瓜果腐霉以及立枯丝核菌所引起的疾病的发生[7]。将光稃稻中的类甜蛋白基因转入小麦中,获得的转基因小麦对小麦赤霉病具有一定的抗性[8]。Jin等通过农杆菌介导法将类甜蛋白基因导入到阳芋(马铃薯)中,提高了马铃薯对晚疫病的抗性[9]。Wang等过量表达明显地提高了拟南芥对轮枝菌的抗性[10]。在籼稻L.表达水稻基因增强了其对水稻纹枯病致病菌以及水稻叶鞘腐败病菌的抗性[11]。本实验室从‘南林895’杨×cv. ‘Nanlin 895’克隆获得了基因,功能分析显示其具一定的抗病菌活性[12]。
随着转基因技术越来越多地被应用于遗传育种领域,转基因植物潜在的生物安全性也日益受到公众的关注[13-17]。目前转基因植物生态安全评估主要集中在外源基因是否稳定存在、外源基因是否会发生水平转移、转基因植物是否会对土壤微生物数量造成影响以及是否会对周围非目标生物的生长造成影响等。国内外关于转基因植物生物安全性的研究大多集中于玉米、水稻、棉花等农作物上[18],对转基因林木的生物安全性检测相对较少。本研究选择实验室利用农杆菌介导法获得经检测具一定的抗病菌能力(数据未发表)且经申请己准许进入田间试验的转基因‘南林895’杨为材料,开展转基因杨树的分子检测及生物安全性分析,为转基因杨树抗病新品种培育及应用提供依据。
1 材料与方法
1.1 试验材料
试验材料选择进入田间试验并于2017年春扦插种植于江苏泗洪陈圩林场的转基因‘南林895’杨株系(1-2,1-6,1-7,2-9,2-11),以未转基因‘南林895’杨(NL895)(美洲黑杨×欧美杨F1代优良无性系)为对照。
1.2 实验方法
1.2.1 外源基因稳定性的分子检测 外源基因能否在受体植物中长期存在并且稳定表达是培育转基因新品种的重要依据[19]。为此,采集了进入田间试验1 a后(2018年4月)的转基因杨树以及非转基因杨树叶片,每个株系(加对照共6个株系)随机采集3棵植株的幼嫩叶片,3次重复,低温保存备用。提取叶片基因组DNA(采用TIANGEN的植物基因组DNA提取试剂盒),对目的片段进行PCR扩增。
本研究中转基因杨树采用的植物表达载体为PBI121,连接时使用的限制性内切核苷酸酶为Xba1和BamH1。目的基因片段长度为750 bp,在本实验中使用35S启动子作为上游引物序列,下游引物序列为目的基因的下游序列,预期扩增片段长度为850 bp左右。
PCR反应体系50 μL,包括模板3 μL,10×Buffer 5 μL,2.5 μM dNTP 4 μL,上、下游引物各1 μL,rTaq 0.5 μL,加ddH20至50 μL。反应程序为:95℃预变性10 min;95℃变性50 s,56℃退火50 s,72℃延伸50 s,35个循环;72℃,10 min。
35S Forward: 5’-CTATCCTTCGCAAGACCCTTC-3’
1 Reverse: 5’-CGGGATCCCTAGTGACAGAAGATAAC-3’
35S Forward: 5’-CTATCCTTCGCAAGACCCTTC-3’
2 Reverse: 5’-CGGGATCCTTAGTGACAAAAGATAACC-3’
1 Forward: 5’-GCTCTAGAATGGCCACCGCCACGCAAC-3’
1 Reverse: 5’- CGGGATCCCTAGTGACAGAAGATAAC-3’
2 Forward: 5’- GCTCTAGAATGACTACTGCTAGGCCAATC-3’
2 Reverse: 5’- CGGGATCCTTAGTGACAAAAGATAACC-3’
1.2.2 可培养土壤微生物的检测 为了评估转基因植物对于土壤微生物的影响,对试验地进行了连续动态监测。定期(每隔3个月)采集土壤样本按Yu等人[20]的方法培养土壤微生物并进行土壤可培养微生物数量的统计。土壤微生物培养采用的2个培养基为:四环素-葡萄糖-酵母提取物培养基(OGYE)和蛋白胨-胰蛋白胨-酵母提取物-葡萄糖培养基(PTYG)。OGYE培养基用于培养土壤中可培养的真菌,其培养基成分为:酵母提取物5.0 g·L-1,葡萄糖20.0 g·L-1,生物素0.1 mg·L-1以及四环素50.0 mg·L-1。PTYG培养基用于培养可培养的放线菌以及细菌,其培养基成分为:蛋白胨0.25 g·L-1,胰蛋白胨0.25 g·L-1,酵母提取物0.5 g·L-1,葡萄糖0.5 g·L-1,且含有30.0 mg·L-1的MgSO4·7H2O以及3.5 mg·L-1的CaCl2·2H2O。
土壤采样时,随机选取转基因植株和非转基因植株各3棵,以样树为中心,选取主干半径30 cm距离的等边三角形的3个顶点,采集10 ~ 20 cm土层处土壤样品约60 g,该土壤层微生物最为丰富。将采集好的土壤样品保存于保鲜袋中,放入冰盒保存带回实验室,冰箱4℃存放备用。每份土壤样品约为60 g,30 g放于80℃下过夜烘干,余下的30 g与270 mL无菌且pH值为7的磷酸缓冲液(15 mM)混合,放于160 r·min-1,25℃的摇床上震荡10 min。使用移液枪准确吸取0.1 mL土壤悬浮液注入0.9 mL的无菌磷酸缓冲液中得到10-1土壤稀释液。照此方法稀释得到10-3土壤稀释液,吸取0.1 mL的10-3土壤稀释液接种于含有OGYE培养基与PTYG培养基的培养皿上,各重复3次。将培养皿放置于室温、黑暗条件下培养,3 d后统计真菌菌落,7 d后统计细菌菌落。为了区分放线菌与其他细菌,先统计总的菌落数量,然后用70%乙醇在培养基表面轻轻擦拭,剩下的菌落数量即为放线菌。其他细菌菌落即为总的细菌菌落数量减去剩下的菌落数量。
菌落形成数量(CFU)=(微生物数量×稀释倍数)/土壤干重
1.2.3 外源基因水平转移情况分析 参考Muriel. Viaud等的方法[21]将采集的土样(2018年4月土壤样品)经筛网过筛处理,然后进行土壤微生物总DNA的提取。土壤微生物总DNA的提取采用Mpbio公司的FastDNA Spin kit for soil试剂盒。随机采取每个株系3份不同的土壤样品用于总DNA的提取,共采取18个土壤样品。
以提取的土壤微生物总DNA为模板,使用细菌16S rDNA通用引物PCR扩增,设计的引物序列如下,预期扩增片段长度为1 050 bp。
16S rDNA Forward:5’-ACG GGC GGT GTG TAC-3’
16S rDNA Reverse:5’-CCT ACG GGA GGC AGC AG-3’
PCR反应体系50 μL,包括模板3 μL,10×Buffer 5 μL,2.5 μM DNTP 4 μL,上、下游引物各1 μL,rTaq 0.5 μL,加ddH20至50 μL。反应程序为:95℃预变性10 min;95℃变性1 min,56℃退火1 min,72℃延伸1 min,35个循环;72℃,10 min。
以土壤微生物总DNA为模板,质粒DNA为阳性对照,设计Ⅱ基因引物进行PCR扩增,设计的引物序列如下,预期扩增片段长度为795 bp。
ⅡForward:5’- ATG ATT GAA CAA GAT GGA TTG C-3’
ⅡReverse:5’- TCA GAA GAA CTC GTC AAG AAG G-3’
PCR反应体系50 μL,包括模板3 μL,10×Buffer 5 μL,2.5 μM DNTP 4 μL,上、下游引物各1 μL,rTaq 0.5 μL,加ddH20至50 μL。反应程序为:95℃预变性10 min;95℃变性50 s,56℃退火50 s,72℃延伸50 s,35个循环;72℃,10 min。
将土壤样品与磷酸缓冲液(15 mM)混合,将土壤稀释液涂布于两类含有卡那霉素(50 mg·L-1)的培养基(OGYE和PTYG)上,从而筛选抗性菌株,提取DNA进行分子检测。细菌基因组DNA的提取与PCR检测:挑取菌落到含有10 μL无菌水的PCR管中并混匀,以此做细菌的DNA溶液。真菌和放线菌基因组的提取[22]与PCR检测:挑取菌落液体培养,抽滤菌丝。菌丝烘干后捣碎,分别加入1 mL的DNA提取缓冲液(100 mmol·L-1Tris pH 8.0,100 mmol·L-1EDTA,250 mmol·L-1NaCl,1%SDS),50 μL的20%SDS,75 μL的5 mol·L-1NaCl,65 μL的10%CTAB,充分混匀,65℃水浴1 h。12 000 r·min-1离心10 min,取上清。加等体积氯仿/异戊醇(24:1),12 000 r·min-1离心5 min,取上清。加入0.6倍体积的冰异丙醇,混匀放-20℃冰箱过夜沉淀。次日取出,12 000 r·min-1离心15 min,弃上清。用70%,100%乙醇各清洗一次,干燥沉淀DNA,除去多余的乙醇。加入200 μL TE缓冲液即可获得DNA溶液。将获得的用于PCR扩增的DNA溶液使用分光光度计检测其纯度和浓度,确保可进行PCR扩增。
以获得的DNA溶液为模板,以35S启动子作为上游引物序列,目的基因的下游序列作为下游引物进行PCR扩增,预期扩增片段长度为850 bp左右。PCR反应体系50 μL,包括模板3 μL,10×Buffer 5 μL,2.5 μM DNTP 4 μL,上、下游引物各1 μL,rTaq 0.5 μL,加ddH20至50 μL。反应程序为:95℃预变性10 min;95℃变性50 s,56℃退火50 s,72℃延伸50 s,35个循环;72℃,10 min。
35S Forward: 5’-CTATCCTTCGCAAGACCCTTC-3’
1 Reverse: 5’-CGGGATCCCTAGTGACAGAAGATAAC-3’
35S Forward: 5’-CTATCCTTCGCAAGACCCTTC-3’
2 Reverse: 5’-CGGGATCCTTAGTGACAAAAGATAACC-3’
1.2.4 叶片化感作用试验 用Sandwich方法[23-24]初步评估了转基因杨树是否会对周围其它植物造成负面影响。在2017年6月至2017年10月和2018年5月期间每月采集杨树叶片样本,每个株系采集的叶片来自于同一个株系9棵不同的杨树。采集的新鲜叶片放置于60℃条件下烘24 h,烘干的叶片存放于干燥环境下。叶片化感作用试验使用美国康宁的6孔板(6孔,孔直径34.8 mm,生长面积9.5 cm2),将烘干叶片(150 mg)平均放入3个孔中。倒入5 ml 0.5% w·v-1的低熔点琼脂,待琼脂凝固后再加入5 ml 0.5% w·v-1的低熔点琼脂。之后每个孔中放入5颗生菜种子(L. var.Hort.),于暗环境,25℃条件下培养72 h。之后放于-20℃冰箱内冷冻1晚,次日取出,测量生菜下胚轴与胚根长度。测量得到的5个数据去掉最大值与最小值,采用剩下的3个值得到平均数。
1.2.5 数据处理 采用Microsoft Excel 2003进行两因素方差分析[25],采用OrigiPro 8.0软件分析可培养土壤微生物数量的变化情况以及叶片化感作用实验中下胚轴与胚根长度的变化情况。
2 结果与分析
2.1 外源基因稳定性的分子检测
从转基因‘南林895’杨植株和非转基因植株叶片中提取基因组DNA,设计特异性引物进行PCR扩增。结果显示(图1),点样孔1使用引物为目的基因的上、下游引物,以‘南林895’杨基因组DNA为模板,扩增出了约750 bp的片段,与预期长度相符。点样孔2~7使用的上游引物为35S启动子序列,在对照植株(非转基因‘南林895’杨)中使用35S启动子未扩增出目的片段,但在转基因‘南林895’杨(1-2,1-6,1-7,2-9,2-11)基因组DNA中扩增出了约850 bp的片段长度,与预期长度相符。分析表明,转基因杨树在进入田间试验1 a后,外源基因仍稳定存在于转基因杨树基因组中。

M-DNA Marker 2 000;1-2 ‘南林895’杨基因组DNA;3~7-转PeTLP基因‘南林895’杨基因组DNA。
Figure 1in transgenic plants by PCR amplification
2.2 根系周围土壤微生物种群数量的比较
对田间试验1 a数据进行结果整理分析,3类土壤微生物数量在不同月份的变化趋势基本一致,且不同微生物数量在转基因株系与非转基因株系之间的变化趋势也基本保持一致。2018年1月,3类土壤微生物数量达到最低值,但之后随着气温的上升3类土壤微生物数量逐渐增加。放线菌与其他细菌的数量在2017年4月达到了最大值,之后随着时间的变化呈现先下降后上升的趋势。真菌数量则在2018年4月达到了最大值,2017年4-10月真菌数量变化差异不大(图2,图3,图4)。
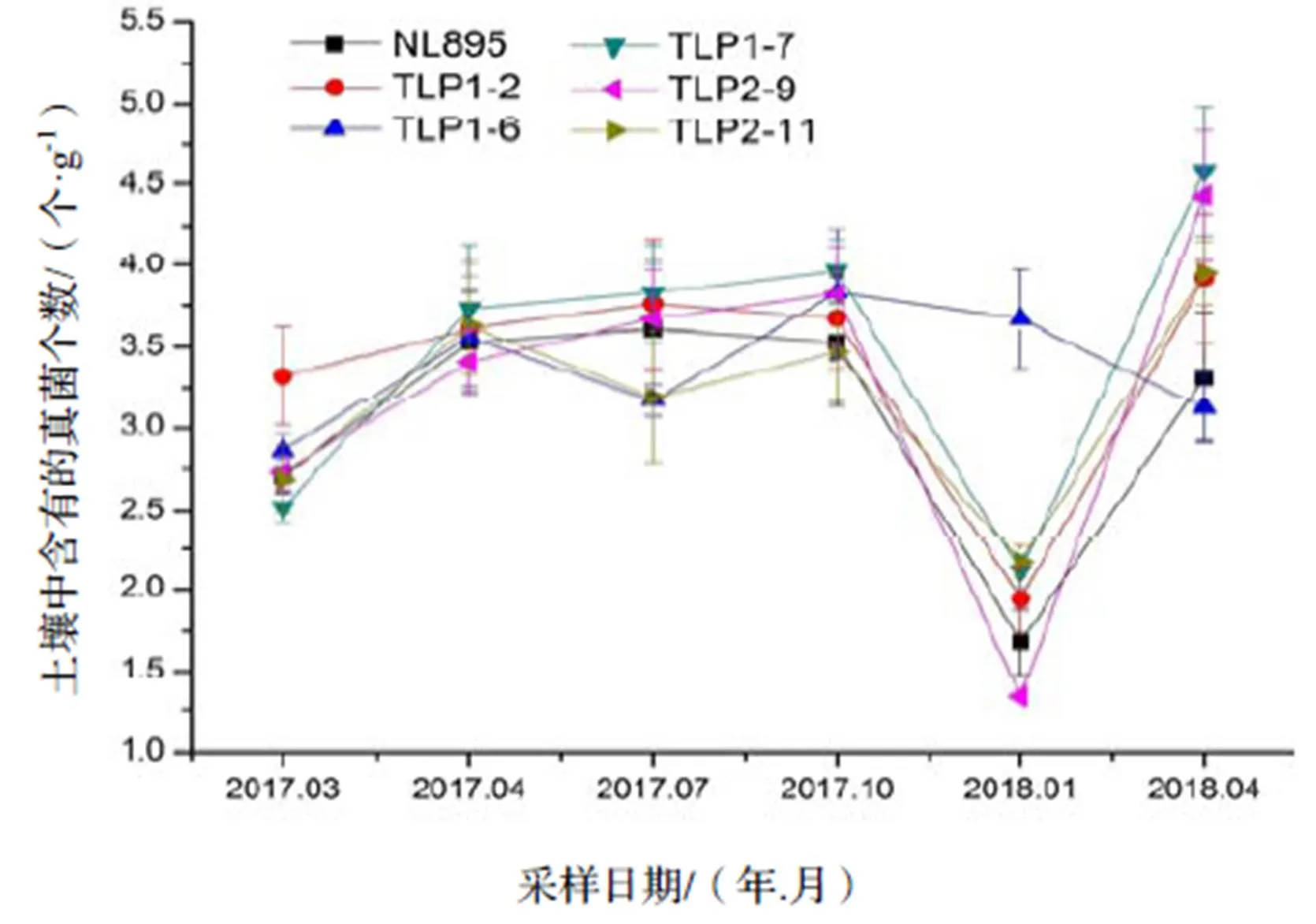
图2 转基因植株与非转基因植株根系周围土壤真菌数量随季节变化情况
Figure 2 Seasonal change in numbers of soil fungi of transgenic and non-transgenic plants

图3 转基因植株与非转基因植株根系周围土壤放线菌数量随季节变化情况
Figure 3 Seasonal change in numbers of actinomycetes in soil of transgenic and non-transgenic plants
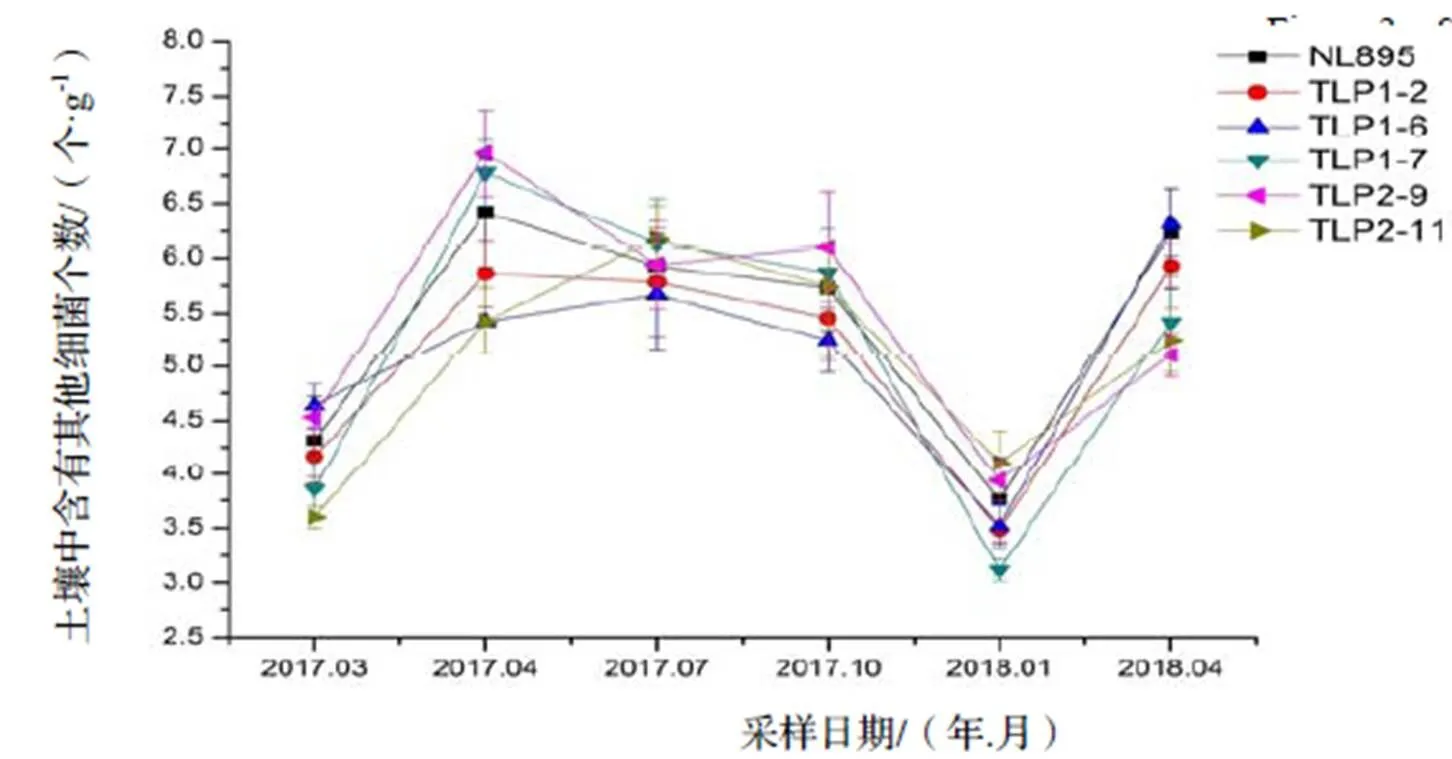
图4 转基因植株与非转基因植株根系周围土壤其他细菌数量随季节变化情况
Figure 4 Seasonal change in numbers of other bacteria in soil of transgenic and non-transgenic plants
用两因素方差分析(表1)显示,真菌(α=0.01)、放线菌(α=0.01)、其他细菌(α=0.01)的群落数量之间随着季节的变化有着极显著性差异(α=0.01),但是转基因杨树与非转基因杨树之间土壤微生物的菌落数量间无显著性差异。这一结果表明该试验林内转基因‘南林895’杨未对土壤中可培养真菌、放线菌以及其他细菌的数量造成显著影响。
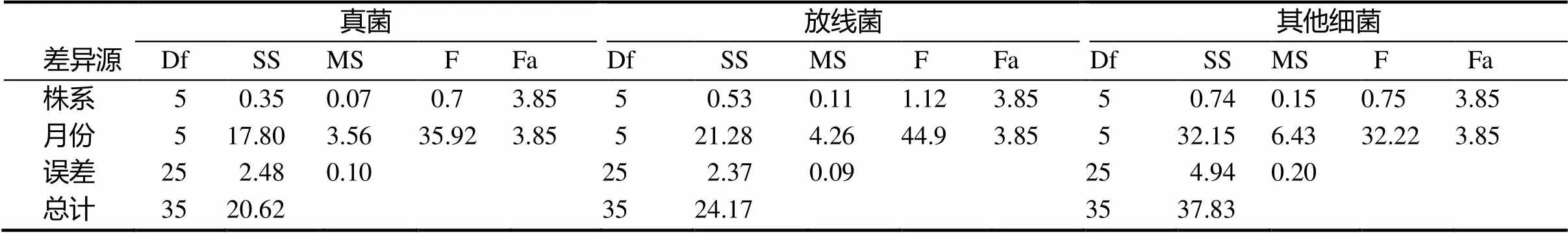
表 1 转基因与非转基因植株土壤微生物方差分析结果
2.3 外源基因水平转移情况分析
随机采取每个株系3份不同的土壤样品用于总DNA的提取,用Mpbio公司的Fast DNA Spin kit for soil试剂盒所提取的根系周围土壤微生物总DNA为模板,用细菌16S rDNA通用引物扩增,所得的实验结果如图5,孔1 ~ 6分别为NL895,1-2,1-6,1-7,2-9,2-11植株周围土壤微生物总DNA,扩增出了1 050 bp左右的片段,与预期目的片段长度相符。
以根系周围土壤微生物总DNA为模板,质粒DNA为阳性对照,用Ⅱ基因引物进行PCR扩增,实验结果如图6所示,阳性质粒扩增出了约795 bp的长度,但转基因杨树周围土壤微生物总DNA中并未扩增出Ⅱ基因目的片段,表明Ⅱ基因未向周围土壤微生物发生基因扩散现象。
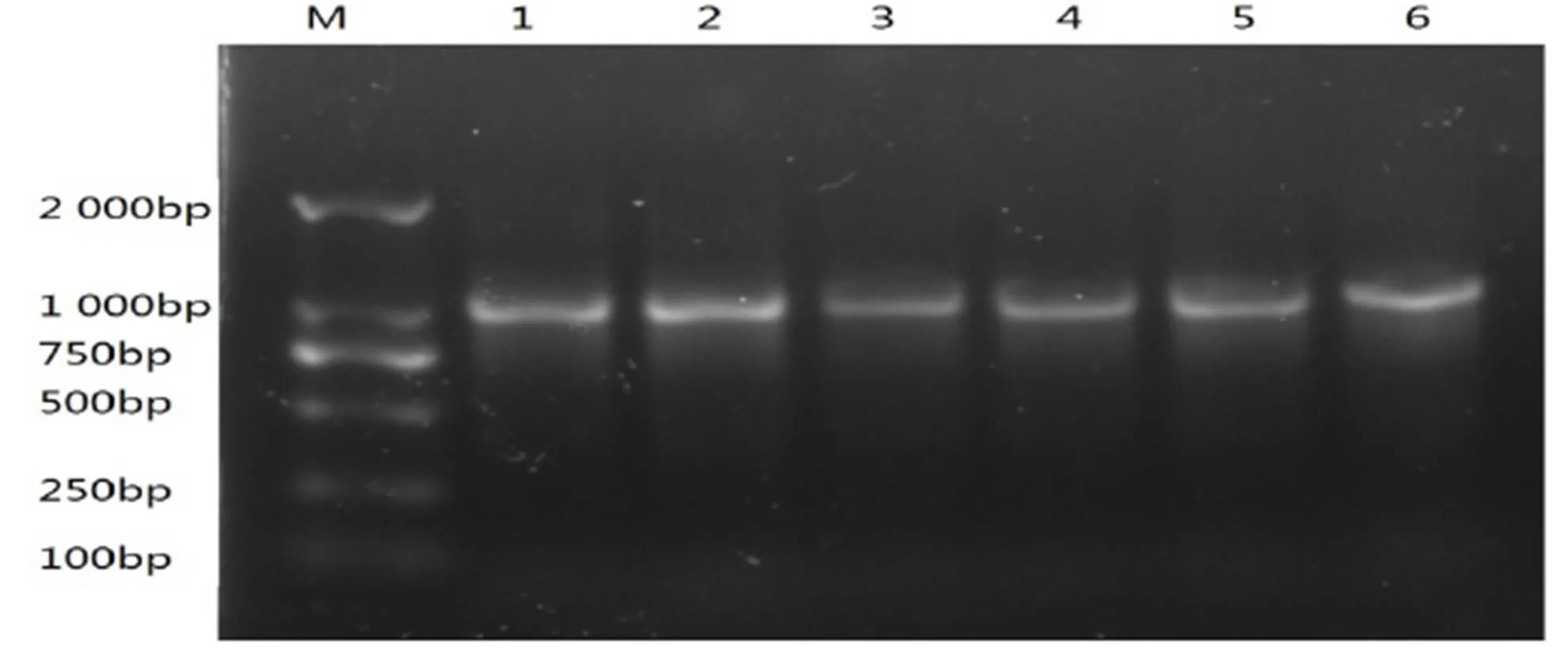
M-DNA Marker 2000;1-‘南林895’杨周围土壤微生物总DNA;2~6-转PeTLP基因‘南林895’杨周围土壤微生物总DNA。
Figure 5 Total DNA of soil microbes by PCR amplification with 16S rDNA

M-DNA Marker 2000;1-质粒;2-‘南林895’杨周围土壤微生物总DNA;3~7-转PeTLP基因‘南林895’杨周围土壤微生物总DNA。
Figure 6 Total DNA of soil microbes by PCR amplification withⅡ
将土壤稀释液涂布于两类含有卡那霉素(50 mg·L-1)的培养基(OGYE和PTYG)上,获得抗性菌株,其中其他细菌18株,放线菌8株,真菌9株。对抗性菌株中提取的DNA进行PCR扩增,结果如图7所示,以质粒作为阳性对照获得了目的片段,但在筛选的抗性菌株DNA中均未检测到目的基因的扩增产物,表明外源基因并未向周围土壤微生物发生基因扩散现象。
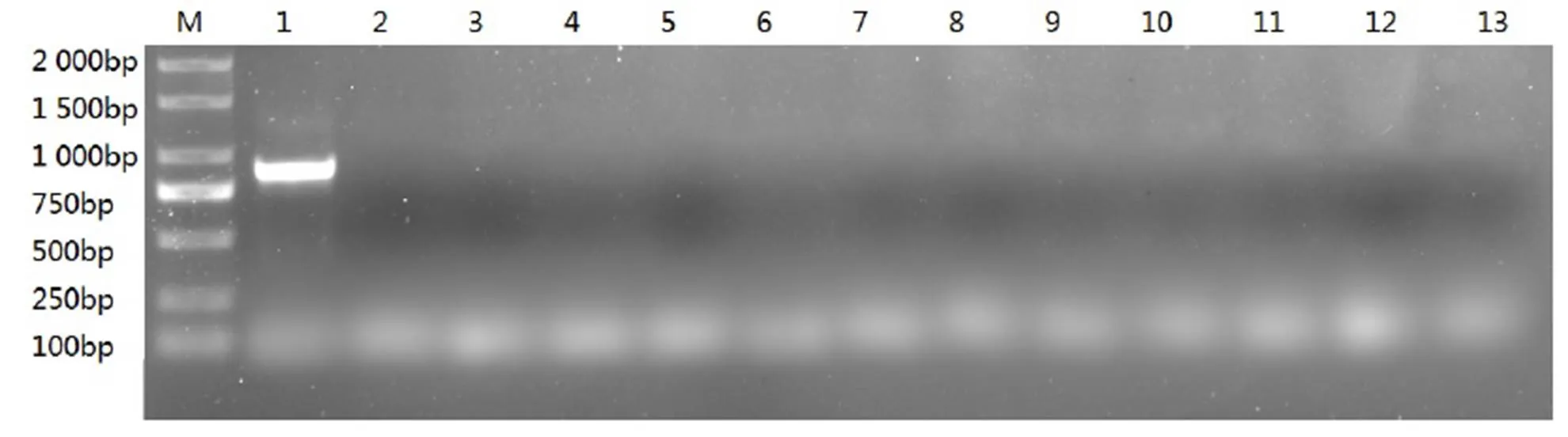
M-DNA Marker 2000;1-质粒;2~4-土壤微生物总DNA;4~7-放线菌DNA;7~10-其他细菌DNA;11~13-真菌DNA。
Figure 7 Horizontal exogenous gene transfer into soil by PCR amplification
2.5 叶片化感作用效应检测
杨树作为我国人工林发展的重要树种,是生态防护林的主要成员。防护林树种对农林生态系统的影响,尤其是对农作物的化感作用影响是一个备受关注的问题[26-29]。因此,本文通过Sandwich实验方法探究了转基因‘南林895’杨和非转基因‘南林895’杨对生菜种子萌发和幼苗生长的影响(图8,图9)

图8 利用“Sandwich”实验方法所获得的生菜下胚轴长度
Figure 8 Length of hypocotyl ofL. var.Hort.by Sandwich Sandwich by Sandwich method
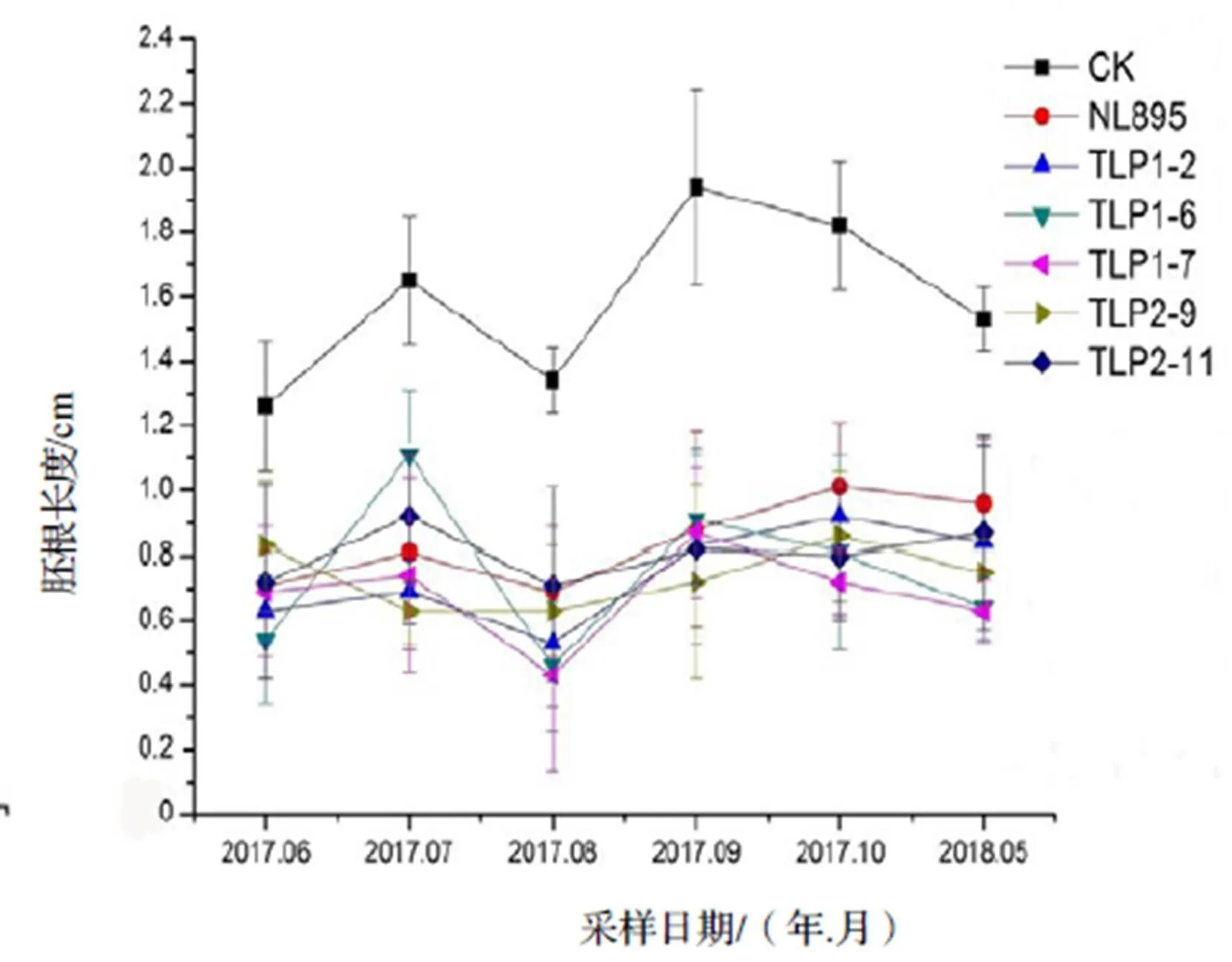
图9 利用“Sandwich”实验方法所获得的生菜胚根长度
Figure 9 Length of ofL. var.Hort. by Sandwich method
利用两因素方差分析(表2)结果显示,生菜下胚轴(α=0.01)、胚根(α=0.01)长度随着月份的变化有着极显著差异,但是不同的叶片(转基因植株与非转基因植株叶片)对生菜生长的影响无显著性差异。但当和对照组(培养基中不含任何叶片)相比时,培养基中含有叶片的实验组中生菜下胚轴、胚根的长度与对照组相比有极显著差异(α=0.01)。

表 2 转基因与非转基因植株叶片对生菜种子生长影响方差分析
3 结论与讨论
转基因植物释放到大田后可能存在的风险主要包括:导入的基因通过花粉传播和杂交使近缘物种获得该基因;通过水平转移到其他生物特别是微生物中;外源基因在受体植物中是否能够长期稳定表达;因抗性产生和发展而导致所转入基因效能的丧失,并由此而造成农作物产量和质量的巨大损失;所导入的抗性基因对非靶标动物、植物和微生物造成的不利影响,以及由此引发的生态系统的紊乱等[30]。
外源基因能否在受体植物中长期稳定存在是检测转基因植物生物安全性的前提[19]。为此在转基因‘南林895’杨进入田间试验后一年,我们对转基因杨树进行了分子检测。结果显示转基因杨树在进入田间试验后一年,基因仍然稳定地存在于转基因植株基因组中。
本研究材料使用转基因‘南林895’杨,‘南林895’杨为雌株,不产生花粉,因此不存在花粉传播而引起的基因污染。土壤微生物是土壤的重要组成部分,在土壤有机物质的降解、营养物质的矿化与固定、植物病理的调控以及土壤结构的改善等方面发挥着重要作用[31-33]。转基因植物在进入大田后就会与土壤中的整个微生物区系相互作用,有可能会对土壤微生物的种类、数量等造成一定的影响。本研究结果显示真菌、放线菌、其他细菌的菌落数量随着季节的变化有着极显著性差异(α=0.01),但是转基因植物与非转基因植株之间土壤微生物的菌落数量无显著性差异,表明该转基因杨树的种植并未对试验地土壤微生物造成显著性影响。朱文旭和吕秀华也获得了相似的结果,朱文旭[34]等研究8年生转基因库安托杨‘Guariento’发现,转基因杨树的种植未对周围土壤微生物造成显著性影响。吕秀华[35]等研究转基因银中杨‘Berolinensis’对土壤根际微生物的影响,结果显示转基因银中杨对其根际土壤微生物主要类群的数量影响不显著。
本研究使用Ⅱ基因引物对土壤微生物总DNA进行PCR扩增,结果显示土壤微生物总DNA中并未扩增出Ⅱ基因目的片段。Ⅱ基因编码新霉素磷酸转移酶,能赋予细胞抗卡那霉素的能力。为进一步验证Ⅱ基因是否发生了外源基因的水平转移,我们用两类含有卡那霉素(50 mg·L-1)的培养基筛选抗性菌株,获得了35株抗性菌株。单纯的检测土壤中卡那抗性微生物的菌落并不能反映转基因植物中外源基因转移到微生物[36],因为微生物自带卡那抗性和其他抗卡那基因的存在等可以提高微生物对于卡那霉素的抵抗力,目前所知道的卡那抗性基因至少有10种。为此我们将获得的卡那抗性菌株提取DNA,用35S启动子序列作为上游引物,目的基因下游序列作为下游引物进行PCR扩增,结果显示抗性菌株并未扩增出目的片段,检测结果表明本研究使用的外源基因并未发生水平转移。Smalla等人[37]也得到了相似的结果,他们在种植含Ⅱ的转基因甜菜L.大田里筛选到了抗性菌株,但PCR和杂交鉴定并没有发现基因水平转移。
转基因杨树在获得某种抗性的同时是否会因为“外源基因”的插入而改变其原来的生理生化特征,使其化感作用的能力与非转基因树种相比大幅增强,进而演变为“外来物种”入侵的趋势。因而在本实验中,我们通过Sandwich实验方法探究了转基因植株叶片的化感作用,结果显示生菜下胚轴、胚根长度随着月份的变化有着极显著差异(α=0.01),但是不同的叶片(转基因植株与非转基因植株叶片)对生菜的生长无显著性差异,说明转基因植株叶片并未对生菜种子的生长造成显著性影响。
由于杨树生长周期长,因此转基因杨树对周边生态环境影响持久,并且可能会在相对较长的时间内逐渐表现。因而本研究所开展的基因稳定性检测、外源基因是否发生水平转移以及叶片化感作用的检测仅为初步结果,仍有必要持续对转基因杨树进行生物安全检测分析。
[1] RISHI A S,NELSON N D,GOYAL A,. Genetic modification for improvement of Populus[J]. Physiol Mol Biol Plants,2001,7(1):7-21.
[2] RISHI A S,NELSON N D,GOYAL A,. Improvement of Populus through Genetic Engineering[J]. Ind J Plant Physiol,2006(2):119-126.
[3] 丁莉萍,王宏芝,魏建华. 杨树转基因研究进展及展望[J]. 林业科学研究,2016,29(1):124-132.
[4] 刘潮,韩利红,王海波,等. 植物类甜蛋白基因家族研究进展[J]. 生物技术通报,2018,34(3):9-17.
[5] LOON L C V,PIERPOINT W S,BOLLER T,. Recommendations for naming plant pathogenesis-related proteins[J]. Plant Molecular Biology Reporter,1994,12(3):245-264.
[6] MACKINTOSH CA,LEWIS J,RADMER L E,. Overexpression of defense response genes in transgenic wheat enhances resistance to Fusarium head blight[J]. Plant Cell Rep,2007,26(4):479-488.
[7] RAJAM M V,CHANDOLA N,GOUD P S,. Thaumatin gene confers resistance to fungal pathogens as well as tolerance to abiotic stresses in transgenic tobacco plants[J]. Biologia Plantarum,2007,51(1):135-141.
[8] Chen W P,Chen P D,Liu D J,. Development of wheat scab symptoms is delayed in transgenic wheat plants that constitutively express a rice thaumatin-like protein gene[J]. Theor App Gen,1999,99(5):755-760.
[9] 金红,岳东霞,周良炎,等. 利用类甜蛋白基因诱导表达提高马铃薯对晚疫病的抗性研究[J]. 华北农学报,2001,16(1):67-72.
[10] Wang Q,Li F,Zhang X,. Purification and characterization of a CKTLP protein fromseeds that confers antifungal activity[J]. PLos One,2011,6(2):e16930.
[11] KALPANA K,MARUTHASALAM S,RAJESH T,. Engineering sheath blight resistance in elite indica rice cultivars using genes encoding defense proteins[J]. Plant Sci,2006,170(2):203-215.
[12] WANG L K,YANG L H,Zhang J,Cloning and characterization of a thaumatin-like protein gene PeTLP in× P.cv.‘Nanlin895’[J]. Acta Physiol Plant,2013,35(10):2985-2998.
[13] 李霞,刘鹏,刘庆,等. 转基因动、植物的研究进展及其安全性分析[J]. 生命科学仪器,2008,6(1):9-13.
[14] HJALTERN J,LINDAU A,WENNSTROM A,. Unintentional changes of defence traits in GM trees can influence plant-herbivore interactions[J]. Basic & Applied Ecology,2007,8(5):434-443.
[15] PRESCOTT V E,HOGAN S P. Genetically modified plants and food hypersensitivity diseases:usage and implications of experimental models for risk assessment [J]. Pharmacol Therap,2006,111(2):374-383.
[16] 康向阳,刘志明,李胜功,等. 论转基因林木的潜在生态风险性[J]. 应用生态学报,2004,15(7):1281-1284.
[17] 沈孝宙,钱迎倩,张树庸,等. 基因工程树的现状、生态风险与对策[J]. 高技术通讯,2002,12(4):100-105.
[18] JAMES C. 2014年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志,2015,35(1):1-14.
[19] 贺熙勇,陈善春,彭爱红. 转基因植物的分子检测与鉴定方法及进展[J]. 热带农业科技,2008,31(1):39-44.
[20] Yu X,KIKUCHI A,SHIMAZAKI T,. Assessment of the salt tolerance and environmental biosafety ofharboring a mangrin transgene[J]. J Plant Res,2013,126(1):141-150.
[21] VIAUD M,PASQUIER A,BRYGOO Y,. Diversity of soil fungi studied by PCR-RFLP of ITS[J]. Mycol Res,1994,104(9):1027-1032.
[22] J. 萨姆布鲁克,D.W. 拉塞尔,拉塞尔,等. 分子克隆实验指南[M]. 化学工业出版社,2008.
[23] F UJII Y,PARVEZ S S,PARVEZ M M,. Screening of 239 medicinal plant species for allelopathic activity using the sandwich method[J]. Weed Biol Manag,2010,3(4):233-241.
[24] FUJII Y,SHIBUYA T,NAKATANI K,. Assessment method for allelopathic effect from leaf litter leachates[J]. Weed Biol Manag,2010,4(1):19-23.
[25] PERRY J N,Ter Braak C J,DIXON P M,. Statistical aspects of environmental risk assessment of GM plants for effects on non-target organisms[J]. Environ Biosaf Res,2009,8(2):65-78.
[26] 毛瑢,曾德慧.农林复合系统植物竞争研究进展[J]. 中国生态农业学报,2009,17(2):379-386.
[27] JOSE S,GILLESPIE A R,PALLARDY S G. Interspecific interactions in temperate agroforestry[J]. Agrofor Syst,2004,61-62(1-3):237-255.
[28] 万开元,陈防,陶勇,等. 杨树对莴苣的化感作用[J]. 东北林业大学学报,2009,37(1):21-22.
[29] 吴锦容,彭少麟. 化感—外来入侵植物的“Novel Weapons”[J]. 生态学报,2005,25(11):3093-3096.
[30] 杨敏生,高宝嘉,王进茂,等. 转双抗虫基因杨基本特性分析[J]. 林业科学,2005,41(1):91-98.
[31] 刘冬艳,张斌,曹杨宇,等. 转抗虫基因杨树外源基因表达的研究进展[J]. 河北林果研究,2015,30(3):243-247.
[32] 魏功峰. 土壤中的微生物[J]. 生物学通报,1995,38(2):48-48.
[33] 李海峰,刘岩,康颖,等. 转基因小黒杨对土壤微生物群落结构的影响[J]. 南京林业大学学报:自然科学版,2014,38(2):75-80.
[34] 朱文旭,丁昌俊,张伟溪,等. 八年生转基因库安托杨外源基因转移及对土壤微生物数量影响的检测[J]. 林业科学研究,2017,30(2): 349-353.
[35] 吕秀华. 转基因银中杨对根际土壤微生物的影响[J]. 基因组学与应用生物学,2018,37(5):1965-1970.
[36] CERDEIRA A L,DUKE S O.The current status and environmental impacts of glyphosate-resistant crop:a review[J]. J Environ Qual,2006,35(5):1633-1658.
[37] SMALLA K,VAN OVERBEEK L S,PUKALL R,. Prevalence of npt II and Tn5 in kanamycin-resistant bacteria from different environments.[J]. Fems Microbiology Ecology,1993,13(1):47-58.
Effect of Transgenic×cv.‘Nanlin 895’ withon Soil Microbes and Molecular Analysis on Exogenous Genes
MA Xiao-xing1,SUN Wei-bo1,WEI Hui1,LIU Ling1,YU Xiang2,WANG Pu1,ZHUGE Qiang1
(1. Co-Innovation Center for Sustainable Forestry in Southern China, College of Biology and Environment, Nanjing Forestry University, Nanjing 210037, China; 2. RIKEN Plant Science Center, Yokohama 230-0045, Japan)
Transgeniccv. ‘Nanlin 895’ withgene were selected for molecular analysis and biosafety analysis. The results showed that the exogenous gene could be detected after one year plantation of transgenic poplars in the open field. There was no significant difference in the quantity of soil microbes around root system between transgenic and non-transgenic plants, indicating that the transgenic plants withhad no significant effects on soil microbes. Molecular analysis on total DNA of soil microbes showed that the exogenous gene did not transfer to the soil microbes. Allelopathy effect of leaf of transgenic ‘Nanlin 895’ showed that it had no significant effect on the seed growth ofL. var.Hort.
transgenic plants;×cv. ‘Nanlin 895’; field trial; biosafety;
10.3969/j.issn.1001-3776.2018.04.005
S792.11
A
1001-3776(2018)04-0028-10
2018-05-15;
2018-06-22
转基因生物新品种培育重大专项(2018ZX08020002);国家林业局生物安全与遗传资源管理项目(KJZXSA2018004);国家自然科学基金项目(31570650);江苏高校优势学科建设工程项目(PAPD)
马晓星,硕士研究生,主要从事分子生物学研究;E-mail:1098130946@qq.com。
诸葛强,教授,博士生导师,主要从事杨树遗传改良研究;E-mail:qzhuge@njfu.edu.cn。
