白色念珠菌侵入口腔黏膜上皮体外模型的构建
2018-11-09张冬梅徐婉悦潘佳雨徐秋芳
张冬梅 徐婉悦 潘佳雨 徐秋芳
白色念珠菌作为人体正常菌群之一,可存在于口咽、胃肠道和阴道粘膜表面。同时白色念珠菌也是重要的机会致病性真菌,当宿主局部微环境失调或粘膜屏障受损时,白色念珠菌可造成粘膜感染,引发鹅口疮、霉菌性阴道炎、间擦疹等疾病[1-4]。在引发疾病的过程中,白色念珠菌侵入宿主上皮细胞,在致病初期起至关重要的作用。甚至在某些情况下,白色念珠菌还可侵入粘膜上皮引起易感人群血行播散性感染[5],侵犯皮肤、组织、器官等引起不同程度的白色念珠菌病。
近20 年来,国外已有多种组织工程模型如阴道上皮模型、口腔上皮模型、食管上皮模型和皮肤模型用于念珠菌感染的研究[6-7]。现阶段,国内对白色念珠菌的黏附、侵入、及对组织细胞破坏作用的研究主要集中在体外真菌培养和动物实验方面,但体外真菌培养不能反映宿主因素,而动物实验的生理环境与人类差异较大[8]。本研究拟利用口腔黏膜上皮细胞及胶原凝胶证实构建口腔黏膜上皮体外模型的可行性,进一步建成白色念珠菌侵入的口腔黏膜上皮体外模型,为后期白色念珠菌—宿主上皮的相互关系研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞及真菌来源 口腔粘膜上皮细胞(KB细胞株,ATCC CCL17)由中国医科大学附属口腔医院中心实验室提供。白色念珠菌标准菌株 (ATCC 11006)购自中科院微生物研究所。
1.1.2 实验试剂及仪器 DMEM低糖培养基、沙堡琼脂培养基(YPD 固体培养基)、沙堡液体培养基(YPD液体培养基)(Gibco公司,美国);0.4 μm Transwell 24孔细胞培养板(Corning公司,美国)。 胶原溶液(Sigma-Aldrich公司,美国)。
1.2 方法
1.2.1 制备中和溶液 2.7 g DMEM粉末溶于60 ml双蒸水,过滤除菌。加入10 ml 7.5%碳酸氢钠溶液、7.5 ml 3M HEPES, 20 ml热灭活的胎牛血清、2 ml 10 mol/L氢氧化钠溶液。
1.2.2 胶原凝胶制备 200 μl 2 mg/ml的胶原溶液置于Transwell 24孔细胞培养板小室中,加入10 μl中和溶液,37 ℃下孵育15 min,待胶原溶液聚合成凝胶状。
1.2.3 细胞培养 常规复苏KB细胞,培养于含10%胎牛血清低糖DMEM培养液中,37 ℃、5%CO2下培养。DMEM培养液重悬处于对数生长期的KB细胞,使浓度为1×106个活细胞/ml,取100 μl细胞悬液接种至已制备好的Transwell 24孔板凝胶上,取600 μl DMEM培养液置于Transwell下室,37 ℃、5%CO2下培养24 h,待细胞单层融合后,形成口腔黏膜上皮体外模型。
1.2.4 白色念珠菌培养及悬液制备 将白色念珠菌以划线法接种到YPD固体培养基,37 ℃恒温培养。取新形成的成熟白色念珠菌菌落,转种到YPD液体培养基中, 30 ℃、200 r/min 摇床中培养18 h。低温离心收集菌细胞,低糖DMEM培养液重悬将其浓度调整至1 个麦氏浓度(108个孢子/ml) 。
1.2.5 构建白念株菌侵入的组织口腔上皮的体外模型 KB细胞换液,向Transwell下室加入600 μl DMEM培养液,取20 μl白色念珠菌悬液滴加至组织工程口腔黏膜上皮表面,37 ℃ 5%CO2条件下分别培养8、24和48 h。
1.2.6 过碘酸雪夫(PAS) 染色 口腔黏膜上皮体外模型经4%甲醛固定、浸蜡、石蜡包埋、切片和PAS试剂盒染色,显微镜下观察。
2 结 果
2.1 口腔黏膜上皮体外模型
KB细胞在胶原凝胶中孵育24 h后,得到结构良好的口腔黏膜上皮体外模型。正常对照的KB细胞成多角形,贴壁生长;同时期培养的口腔黏膜上皮体外模型,从培养初始到培养后48 h,上皮结构、形态无明显变化,随培养时间延长,口腔黏膜上皮细胞排列紧密,细胞间隙变小(图 1)。
2.2 白念株菌侵入的口腔黏膜上皮体外模型
白色念珠菌加入后8 h,PAS染色见口腔黏膜上皮连续,结构完整;白色念珠菌呈深紫色,成簇黏附于口腔黏膜上皮表面,形成分散的大小不 一的圆形孢子,轮廓清晰,无菌丝形成。白色念珠菌加入后24 h,口腔黏膜上皮连续性不完整;局部有少许菌丝侵入上皮浅部,孢子相白念珠菌明显多于菌丝相 。白色念珠菌加入后48 h,口腔黏膜上皮进一步遭到损害,上皮松解,可见大量菌丝成辐射样分布、侵入上皮,且菌丝相白念珠菌明显多于孢子相 。上皮被大量菌丝代替,仅剩少许细胞残骸(图 2)。
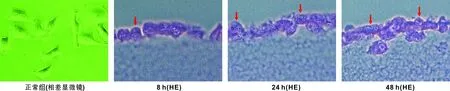
图 1 口腔黏膜上皮体外模型的显微镜下影像(×400)
3 讨 论
白色念珠菌可侵犯黏膜、皮肤、组织、器官等引起不同程度的白色念珠菌病。黏膜上皮是口腔防御系统的第一道屏障,也是白色念珠菌侵袭的主要部位[9]。
研究表明,为了躲避唾液的冲刷、食物的摩擦以及宿主的免疫,白色念珠菌通过黏附、定植和侵入的过程,感染宿主细胞。研究显示白色念珠菌可分泌天门冬氨酸蛋白酶,降解宿主组织屏障,破坏宿主防御分子,并消化宿主蛋白作为营养来源[10]。目前对于白色念珠菌的黏附、破坏作用都有相应的研究,但是对于白色念珠菌侵入组织细胞的机制研究较少[7]。

图 2 白色念珠菌感染侵入口腔黏膜上皮模型(PAS, ×400)
Jabaji等[11]和Li等[12]分别成功地利用胶原凝胶构建小肠上皮模型。Almela等[13]利用鼠尾进行分离、纯化,获得胶原凝胶,结合作为支架的磷酸羟基磷灰石/磷酸三钙和3 种组织细胞建成骨—口腔粘膜复合模型,耗时3 个多月,更接近真实口腔黏膜上皮。Hernandez等[14]报道利用鼠尾取得胶原凝胶,然后单层口腔上皮细胞系(TR146细胞系)生长在胶原凝胶上建立口腔粘膜模型。这些研究证实了胶原凝胶构建的上皮基底对上皮细胞的生长没有显著的影响,而且胶原凝胶结合单层上皮细胞构建的上皮模型可以模拟人类黏膜上皮的状态。
本研究构建口腔黏膜上皮体外模型,再以白色念珠菌对其进行感染,初步建立白色念珠菌侵入的口腔黏膜上皮体外模型。白色念珠菌有芽生孢子和假菌丝两种存在形式,即菌丝相和孢子相,假菌丝是孢子大量繁殖的致病形式[9,15]。本研究结果表明,随感染时间延长,菌丝生长渐旺盛,上皮层逐渐被菌丝代替。可见大量菌丝成辐射样分布,且菌丝相白念珠菌明显多于孢子相 。提示白色念珠菌毒力增强,上皮结构破坏更趋明显,上皮被大量菌丝代替,仅剩少许细胞残骸。
Jayatilake等[16]利用口腔上皮细胞来源的TR146细胞构建人多层细胞的口腔上皮模型,可以较好地观察白色念珠菌与宿主细胞的相互关系。与其他作者[6-7,16]报道的复杂模型相比较,本研究直接利用成品凝胶溶液,将其在支持膜上胶化,然后将胶原凝胶作为上皮细胞的支持表面,使其能更简洁、直观、详细地观察白色念珠菌侵入的过程。根据细胞类型不同,通常上皮细胞接种胶原凝胶数天后,上皮模型即可用于进一步研究。同样上皮模型后期可以嵌入其他类型细胞以完成更复杂的上皮模型。为了研究粘膜表面细菌定植的影响,在感染白色念珠菌期间,也可以将来自正常人的菌群细菌添加到该模型中。
总之,白色念珠菌侵入的口腔黏膜上皮模型的成功构建,使动态观察白色念珠菌侵入上皮的过程成为可能;而且口腔黏膜上皮体外模型更接近人体结构,具有可重复性,对于开展白色念珠菌侵入宿主细胞后的致病机理研究具有重要意义。
