HPLC法同时测定山楂中展青霉素和5-羟甲基糠醛的含量
2018-11-09吴仲,张勋
吴 仲 ,张 勋
(1.福建中医药大学药学院,福建福州350122;2.福建农林大学园艺学院,茶学福建省高等学校重点实验室,福建福州350002)
蔷薇科植物山楂适应性强[1],在我国各地均有分布,常用作园林绿化植物[2],其干燥果实作为一种药食同源的药材,含有丰富的生物活性物质[3-4],具有健脾开胃、消食化滞等作用,在临床上有广泛的应用[5-6]。在休闲食品[7-8]、动物饲料[9-11]等领域的应用也越来越受到关注,推广山楂可谓兼具生态效应和经济效益[12]。展青霉素(Patulin)又称棒曲霉素,是曲霉属、青霉属、丝衣霉属等菌种的次级代谢产物,是一种神经毒素,具有潜在的致癌、致畸、致突变性,且可以稳定存在[13-15]。其在水果制品中广泛存在,山楂和山楂片中均有发现展青霉素的报道[16-17]。目前,GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》对山楂中展青霉素最高允许量做出了明确规定,而欧盟标准更加严格[17]。5-羟甲基糠醛(5-hydroxymethylfurfural,HMF)主要由美拉德反应和己糖酸性条件下脱水产生[18]。HMF本身仅具弱毒性,但其能在体内形成具有强致癌和基因毒性的羟甲基糠醛次硫酸盐等[19-20]。如果山楂产品因加工或贮藏不当等原因产生HMF和展青霉素,可能会威胁消费者的身体健康。
因此,建立山楂中展青霉素和HMF的科学有效的检测方法,对于山楂制品质量安全显得尤为重要。目前,国内检测展青霉素和HMF采用HPLC法应用最为普遍[17,20]。HMF与展青霉素均带有羟醇、基,结构相似,简单的提取和净化过程中二者很难分离[21]。
为有效分离展青霉素和HMF,本研究尝试采用20%乙腈提取,Myeosep@228AflaPat柱净化,以建立一种专属、准确、能同时检测HMF和展青霉素含量的测定方法,为山楂质量控制提供试验依据,保障其食用安全。
1 材料和方法
1.1 材料
5份供试山楂样品从当地不同超市购买,常温放置72 h,60℃干燥,粉碎。
1.2 试剂
展青霉素/棒曲霉素标准品(批号:O14099,山海安浦实验科技股份有限公司);5-羟甲基糠醛(批号:H810986,上海麦克林生化科技有限公司);甲醇、甲酸、乙腈均为色谱纯(默克化工技术有限公司);试验用水皆为实验室自制二次蒸馏水。
1.3 主要仪器
多功能高速粉碎机(型号:BO-100T,永康市铂欧五金制品有限公司);电子天平(型号:AR224CN,奥豪斯仪器(常州)有限公司);数控超声清洗器(型号:KQ-500DE,昆山市超声仪器有限公司);涡旋仪(型号:VOREX-5,海门市其林贝尔仪器制造有限公司);Myeosep@228AflaPat柱(批号:228088-1512,浙江月旭材料科技有限公司);Waters e2695高效液相色谱仪(美国Waters公司);NEVAP-12氮吹仪(美国Orgranomation公司);一体化超纯水机(型号:MILLI-QDirect16,美国Millipore公司)。
1.4 试验方法
1.4.1 色谱条件 色谱柱:Ultimate@XB-C18(4.6nm×250 nm,5 μm),流动相洗脱条件为等度洗脱乙腈-0.02%甲酸(13∶87)溶液;流速为 1 mL/min;柱温为30 ℃,进样量为 10 μL。
1.4.2 标准品溶液的配制 展青霉素—5-羟甲基糠醛混合标准品储备液:精密称量并配制100μg/mL展青霉素、125 μg/mL HMF标准品母液,分别量取1 mL展青霉素标准品母液和1.6 mL HMF标准品母液于10 mL容量瓶中,加乙腈适量溶解并稀释至刻度,摇匀,制得展青霉素质量浓度为10 μg/mL和HMF质量浓度为20 μg/mL的标准品储备液。
1.4.3 供试品溶液的配制 精密称取山楂样品粉末1 g,置25 mL容量瓶中,用20%乙腈溶液定容至刻度,称质量,400 W功率超声提取5 min,提取温度为40℃,冷却后再称质量,用20%乙腈补足至原质量,摇匀后静置片刻,取约10 mL上清液于净化柱玻璃试管中,将净化柱插入试管中,至上而下缓慢推进,净化后的样品提取液经吸附剂进入柱子的上端,精密量取4 mL净化后的提取液于试管中,微弱氮气吹至近干,加入20%乙腈水溶液至2 mL后涡旋振荡30 s,用0.45 μm滤膜过滤,即得供试品溶液。
1.4.4 检测波长的选择 将混合标准品稀释液在200~450 nm的波长范围内进行光谱扫描,以确定检测波长。
1.4.5 流动相的选择 将流动相甲酸设0.02%,0.05%等2个浓度,比较其对展青霉素和HMF色谱峰型的影响。
1.4.6 提取溶剂的选择 将提取溶剂甲醇、乙腈分别设10%,20%,40%,60%,80%等不同浓度,比较其对超声提取HMF和展青霉素效果的影响。
1.4.7 净化柱的选取 采用Myeosep@228AflaPat柱进行净化,与不使用净化柱相比较,分析其对测定山楂中展青霉素和HMF含量准确性的影响。
1.4.8 标准曲线绘制 精密吸取混合标准品储备液1 mL于10 mL量瓶中,20%乙腈定容,依次对半稀释得9组不同浓度的标准品混合液,编号1~9。进样量为10 μL,按照1.4.1的液相色谱条件进行测定。以标准品溶液的浓度(C,μg/mL)为横坐标(X),液相色谱峰的平均峰面积(A,mAU)为纵坐标(Y),绘制标准曲线,得到回归方程和相关系数。
1.4.9 精密度试验 取母液稀释10倍混合标准品溶液(其中展青霉素、HMF的质量浓度分别是10,20 μg/mL)10 μL,进行测定。一天内连续进样 6 次,记录峰面积。
1.4.10 稳定性试验 取1份山楂样品制备供试品溶液,室温环境下分别在 0,2,4,6,8,10,12,24,48 h时进样10 μL,进行测定。
1.4.11 重复性试验 取同批山楂样品6份,1份1 g,按供试品制备方法制备供试品溶液,进行测定。
1.4.12 加样回收率 取山楂样品6份,1份1 g,分别加入3个质量浓度的标准品混合液(每个浓度3份),依法进行测定,平行测定3次,计算平均回收率及RSD值。
2 结果与分析
2.1 检测波长的选择
混合标准品稀释液在200~450 nm的波长范围内检测,HMF的吸收峰峰位在282 nm附近,展青霉素的吸收峰峰位在276 nm附近。检测波长设定在280 nm时,二者均可出峰,且峰面积较其他波长大,干扰组分的影响也较小,所以,本研究确定检测波长为280 nm。
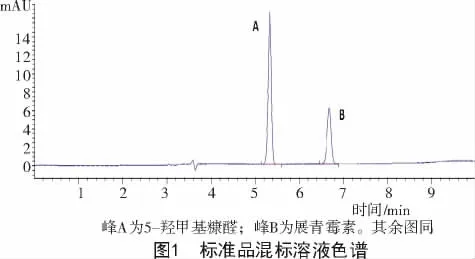
在标准品色谱(图1)上,各对照品色谱峰理论塔板数均>5 000,并且拖尾因子均<2.0;在供试品色谱(图2)上,HMF和展青霉素色谱峰与相邻色谱峰的分离度均>2.0,表明本法可用于HMF(峰A)和展青霉素(峰B)的检测。

2.2 流动相的选择
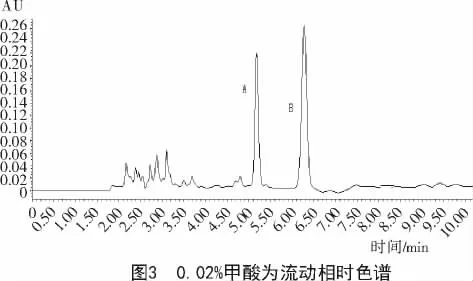
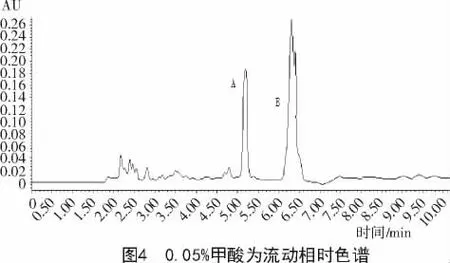
由图3,4可知,0.02%的甲酸可以防止展青霉素和HMF拖尾,峰型较佳,故选择乙腈-0.02%甲酸做为流动相。
2.3 提取溶剂的选择
试验发现,不同浓度甲醇提取的展青霉素出峰情况不佳;当乙腈浓度在10%~20%时,乙腈浓度与展青霉素、HMF的提取率呈正相关,而40%的乙腈提取率反而低于20%的乙腈提取率,因此,选择20%的乙腈作为展青霉素和HMF提取溶剂。
2.4 净化柱的使用
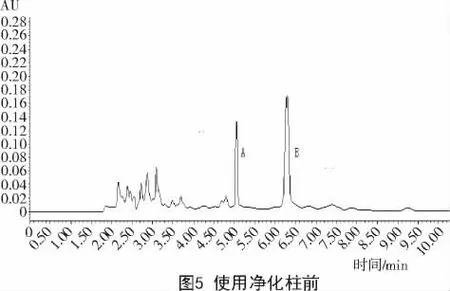
净化柱使用前后色谱峰如图5,6所示,结果显示,采取Myeosep@228AflaPat净化柱后展青霉素和HMF的吸收峰更高。展青霉素和HMF在山楂中为痕量存在,净化处理能更准确地测定其在山楂中的含量。

2.5 标准曲线绘制
展青霉素和HMF的回归方程和相关系数如表1所示,结果表明,二者在线性范围内线性关系良好。
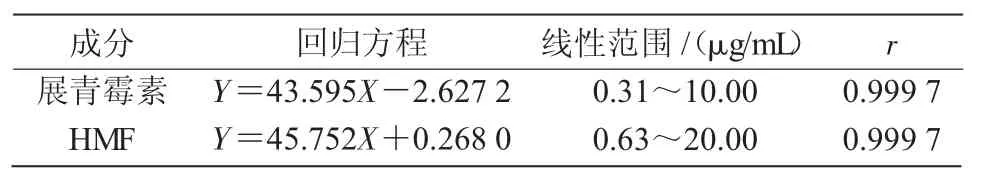
表1 标准品的线性回归方程
2.6 精密度试验
精密度试验结果表明,展青霉素、HMF峰面积的RSD分别为0.53%,0.51%,表明仪器精密度良好。
2.7 稳定性试验
稳定性试验结果表明,展青霉素、HMF峰面积的RSD分别为2.23%,5.54%,表明山楂供试品溶液中展青霉素和HMF在48 h内稳定性良好。
2.8 重复性试验
重复性试验结果表明,展青霉素、HMF峰面积的RSD分别为1.03%,1.20%,表明本方法重复性良好。
2.9 加样回收率
加样回收率试验结果列于表2。由表2可知,展青霉素、HMF平均回收率分别为104.01%,100.93%;RSD值分别为1.06%,1.03%,表明该法回收率较理想,适合样品的处理。
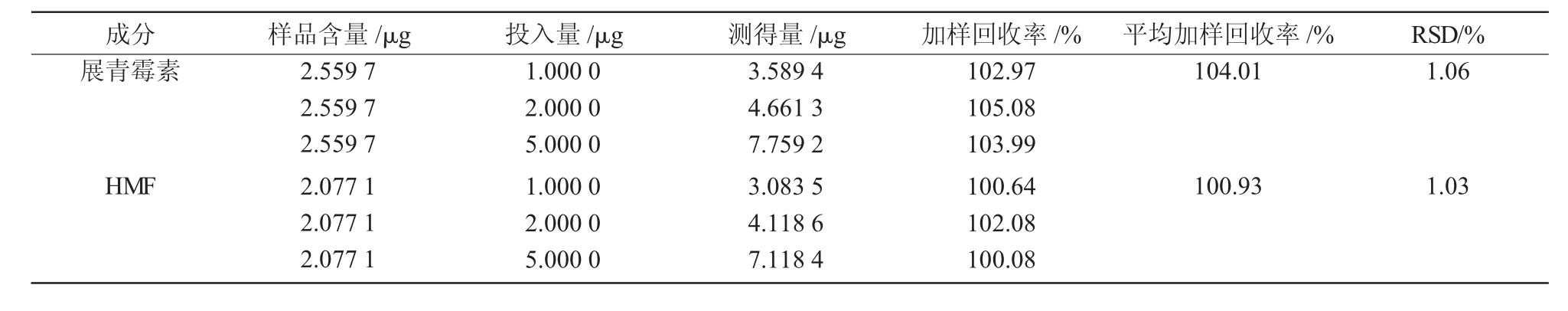
表2 加样回收率试验结果(n=3)
2.10 样品检测
所有山楂样品测定后,按外标法计算HMF和展青霉素的含量,结果列于表3。目前,我国仅规定了蜂蜜中HMF的限量为40 mg/kg,其他食品尚未明确制定限量标准,而欧盟食品安全委员会认为,每人每天摄入HMF的上限为1.6mg[19]。GB2761—2017规定以苹果、山楂为原料制成的食品中展青霉素的为限量50 μg/kg。结果表明,市售山楂可能会因贮藏不当等原因存在HMF和展青霉素的污染风险,以山楂为原料进行休闲食品、保健食品的开发需强化HMF和展青霉素的质量控制。
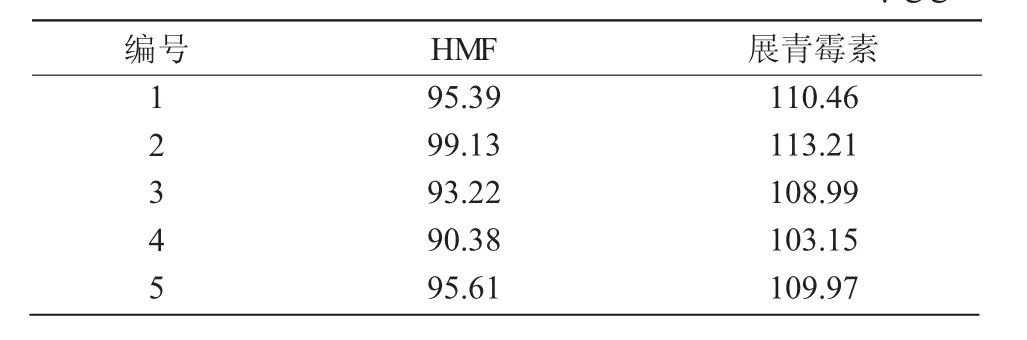
表3 市售山楂中HMF和展青霉素的含量 μg/g
3 结论
本研究采用HPLC法测定山楂中展青霉素和HMF,以乙腈-0.02%甲酸做为流动相,在280 nm波长处检测,结果表明,该法能有效分离二者,采取Myeosep@228AflaPat净化柱处理基本能消除脂肪等有机质对检测的干扰,该方法的精密度、稳定性和线性关系均满足分析检测的要求。以这种方法检测山楂中展青霉素和HMF,可满足对其进行质量控制的要求。
