光谱法研究G-四链体与盐酸巴马汀的相互作用
2018-11-07李俊芬李鹏霞
李俊芬, 张 琳, 樊 鸽, 李鹏霞, 董 川
(1.山西大学化学化工学院,山西太原 030006;2.山西大学环境科学与工程研究中心,山西太原 030006)
1962年,Gellert[1]课题组证实富G核酸单链中的四个鸟嘌呤残基通过Hoogsteen氢键形成四分体结构,四分体与四分体间利用π-π作用连接便形成G -四链体[2]。根据DNA单链的来源和数目不同,G -四链体可分为分子内G -四链体和分子间G -四链体两种;根据DNA单链的走向和loop连接方式的不同,G -四链体可分为平行G -四链体结构、反平行G -四链体结构和混合G -四链体结构[3]。G -四链体在调控基因的复制与表达、延长端粒序列等方面起着至关重要的作用[4]。研究表明,人类染色体末端富G序列形成的G -四链体可以阻断在肿瘤细胞中高活性表达的端粒酶对端粒DNA引物的识别,从而达到抗肿瘤的目的[5];c -myc启动子序列中的Pu27形成的G -四链体DNA可以显著抑制肿瘤的生长,原癌基因c -kit、bcl-2、RET等序列也可形成G -四链体结构,调控相关基因的表达[5]。能够稳定G -四链体结构或者诱导富G序列形成G -四链体结构的配体分子已成为近年来开发抗癌药物的热点。

图1 巴马汀的结构式Fig.1 Structure of palmatine
盐酸巴马汀是存在于黄连中的一类生物碱成分,具有高效的生物活性和较好的水溶性,且能够增强白细胞的吞噬能力,具有抗菌杀毒作用[6],巴马汀的结构式见图1。郝润等[7]发现小檗碱和巴马汀对端粒G -四链体和原癌基因启动子区域G -四链体都有着较好的相对亲和性和选择性,有望成为靶向G -四链体的高效抗癌药物。目前有关盐酸巴马汀与G -四链体相互作用的光谱研究还没有系统报道。
本文通过荧光滴定光谱、紫外滴定光谱、圆二色谱(CD)以及1H NMR谱探究了盐酸巴马汀与G -四链体之间的相互作用。实验发现,盐酸巴马汀和DNA有很强的结合作用,结合作用模式为末端堆积。
1 实验部分
1.1 仪器与试剂
F-4500型荧光分光光度计(日本,日立公司);U-2910型紫外-可见分光光度计(日本,日立公司);MOS 450型多功能圆二色谱仪(法国,Bio-Logic公司);LX-200型迷你型离心机(7 000 r/min),AVANCE ⅢHD核磁共振仪(德国,布鲁克公司);Multiskan GO全波长酶标仪(美国,赛墨飞世尔科技)。
Tris(Biosharp生物科技);盐酸巴马汀(中国药品生物制品检定所);ABTS(Sigma);核酸适配体PS2.M(5′-GTGGGTAGGGCGGGTTGG -3′,上海强耀生物科技有限公司)。实验所用其他试剂均为分析纯,用水为去离子水。
1.2 实验方法
1.2.1溶液的配制盐酸巴马汀用Tris-HCl缓冲液配制成2.5×10-3mol/L储备液。DNA用Tris-HCl缓冲溶液溶解,在90 ℃水浴锅中恒温加热10 min,自然冷却至室温后,放置于冰箱(4 ℃)中,其准确浓度由260 nm处吸光度值计算。以上溶液使用时适当稀释。pH=7.40的Tris-HCl缓冲溶液参照文献方法配制。核磁实验所用的Tris-HCl由90%去离子水和10%氘代水配制而成。H2O2(20 mmol/L)、Hemin(20 mmol/L)及ABTS(20 mmol/L)均用Tris-HCl缓冲液配制。
1.2.2实验方法(1)紫外可见光谱滴定:向1 cm比色皿中加入2.5 mL Tris-HCl缓冲溶液和8 μL盐酸巴马汀储备溶液,Tris-HCl溶液做参比,以微量进样器每次分别向样品和参比液中滴加0.5 μL DNA,搅拌静置30 s后扫描吸收光谱。(2)荧光滴定光谱:固定盐酸巴马汀的浓度为1.25×10-5mol/L,每次滴加0.5 μL DNA,搅拌静置30 s后扫描荧光光谱,直至荧光强度几乎不变(激发和发射狭缝分别为5.0 nm和10.0 nm,激发波长为320 nm)。(3)圆二色谱:移取350 μL Tris-HCl缓冲溶液和2.5 μL G -四链体DNA于1 cm石英比色皿中,每次滴加10 μL盐酸巴马汀进行扫描,直到谱图强度无明显变化。(4)核磁共振谱:将500 μL 1.1×10-3mol/L DNA、150 μL 3.71×10-3mol/L DNA和350 μL 1.73×10-3mol/L盐酸巴马汀的混合液分别加入核磁管中,扫描1H NMR。(5)盐酸巴马汀/G -四链体/Hemin配合物的过氧化酶抑制实验[8]:向96孔板中加入10 μL 20 mmol/L G -四链体DNA,100 μL 20 mmol/L盐酸巴马汀,用缓冲溶液定容至190 μL,室温放置2 h。加入10 μL 20 mmol/L Hemin,搅拌静置1 h,最后加入4 μL 20 mmol/L的2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)溶液,当加入6 μL 20 mmol/L H2O2时,反应开始,用酶标仪检测其在415 nm波长处的吸光度,连续测试35 min并绘制曲线。
2 结果与讨论
2.1 盐酸巴马汀与G -四链体DNA的紫外滴定光谱
配体与G -四链体作用后,其发色团会因与G -四链体DNA的相互作用而产生不同程度的减色(红移)/增色(蓝移)现象。从图2可以看出盐酸巴马汀在波长340 nm和418 nm附近的最大吸收峰的吸光度随着G -四链体DNA的加入不断减弱,减色率分别为39.5%和41.2%,最大吸收波长分别红移了14 nm和18 nm,并且在356、366、450 nm附近出现等吸收点,说明盐酸巴马汀通过π-π堆积作用与G -四链体发生了较强的结合,插入到两个G -四分体平面之间,形成夹心结构或者堆积到了G -四链体末端的G -四分体平面上[9]。
2.2 盐酸巴马汀与G -四链体DNA的荧光滴定光谱
盐酸巴马汀的水溶液荧光较弱,但随着G -四链体DNA的逐渐加入,盐酸巴马汀在波长534 nm附近的荧光强度逐渐增强,如图3所示,再次表明盐酸巴马汀的刚性平面结构与G -四链体发生了π-π堆积作用,其周围环境极性降低,减弱了溶剂对盐酸巴马汀荧光的猝灭作用,从而荧光强度增强。另外,盐酸巴马汀的最大发射峰从530 nm蓝移至522 nm,这可能是由于盐酸巴马汀与G -四链体形成了缔合体,减少了分子碰撞从而减少能量损失[10]。
采用连续等摩尔变化曲线法考察盐酸巴马汀与G -四链体DNA作用的结合位点数[11],由荧光强度对两者摩尔比作图,如图4所示。由图可见盐酸巴马汀与G -四链体DNA之间是单一的键合模式,结合比为1∶1。此时可遵循Scatchard方程计算结合常数[11 - 12],曲线见图5。由直线的斜率和截距得到结合常数K=4.83×106L/mol,结合位点n=0.75。说明盐酸巴马汀与G -四链体产生了较强的结合。

图2 G -四链体DNA与盐酸巴马汀的紫外滴定光谱Fig.2 Ultraviolet titration spectra of palmatine chloride with G -quadruplex DNAcpalmatine=1.6×10-5 mol/L,curves from up to down:cDNA=0 - 1.3×10-5 mol/L.
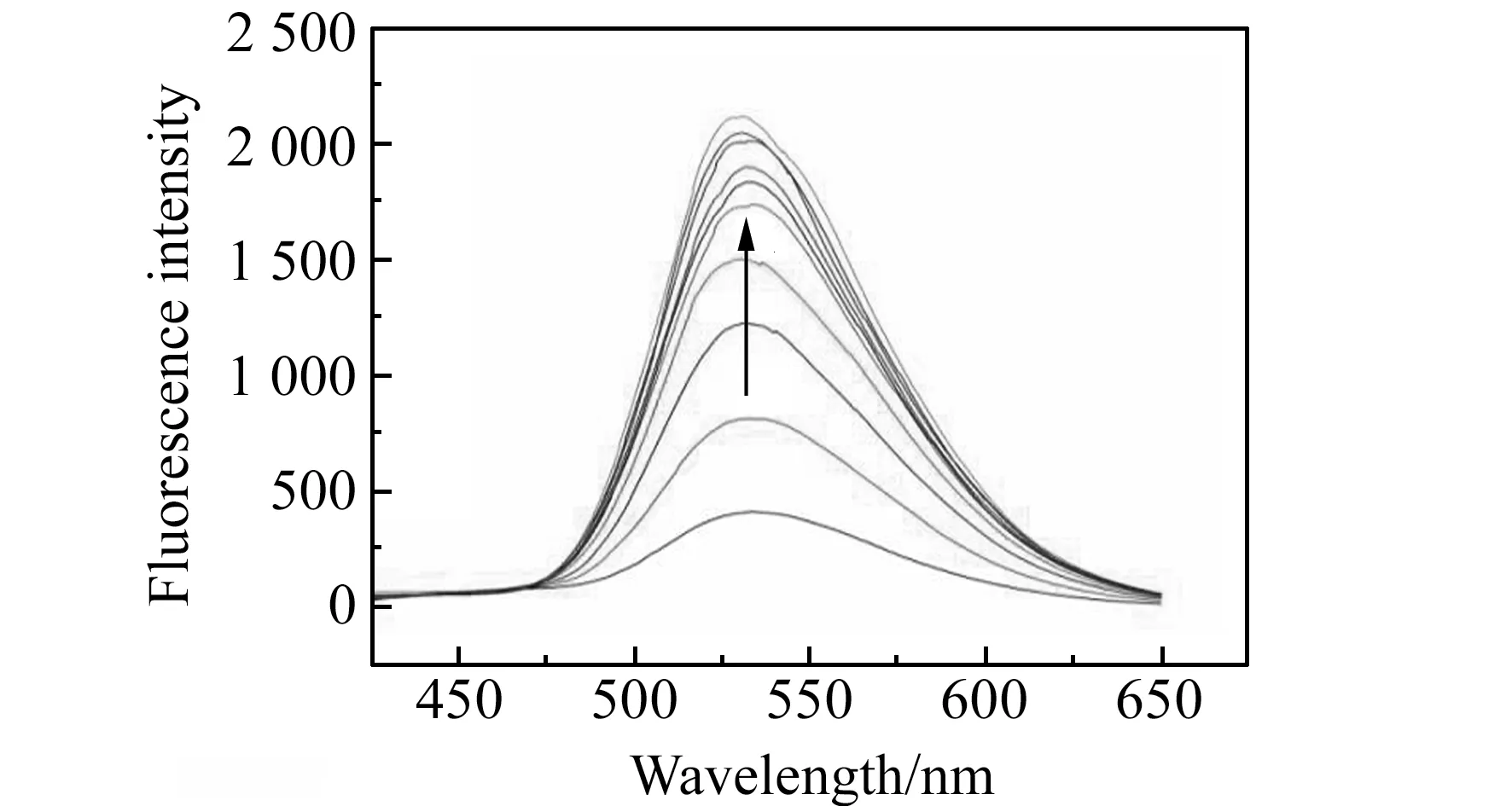
图3 G -四链体DNA与盐酸巴马汀的荧光滴定光谱Fig.3 Fluorescence titration spectra of palmatine chloride with G -quadruplex DNAcpalmatine=1.25×10-5 mol/L,curves from down to up:cDNA=0 - 3.2×10-5 mol/L.

图4 G -四链体DNA与盐酸巴马汀的等摩尔变化曲线Fig.4 Job’s plot of the interaction between G -quadruplex DNA and palmatine chloride obtained by different concentration ratios
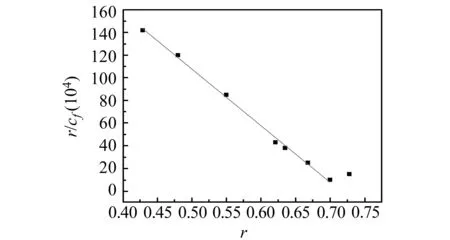
图5 G -四链体与盐酸巴马汀作用的Scatchard图Fig.5 Scatchard plot showing the interaction between G -quadruplex DNA and palmatine chloride
2.3 盐酸巴马汀与G -四链体相互作用的圆二色谱研究
圆二色谱(CD)常被用于研究小分子配体与DNA的相互作用或化合物构象的变化规律[13]。图6为盐酸巴马汀与G -四链体相互作用的圆二色滴定曲线。由图可看出,CD谱图在263 nm附近出现正的最大峰值,在242 nm附近出现负的最大峰值,这说明PS2.M在K+的存在下形成了平行的分子内G -四链体结构[14]。加入盐酸巴马汀后,G -四链体位于240 nm处的负吸收峰和263 nm附近正吸收峰强度改变,但峰位置没有显著变化。以上结果表明,盐酸巴马汀与G -四链体DNA形成了复合物,稳定了G -四链体结构,同时G -四链体构象未发生变化。
2.4 盐酸巴马汀与G -四链体DNA相互作用的 1H NMR研究
Watson-Crick碱基对(NH…N)氢键存在时,亚胺质子化学位移在13~14 ppm;而形成G -四链体结构时,鸟嘌呤氢键(NH…O)的化学位移在 10.5~12 ppm范围内[15]。本文利用二维NOE 增强谱(NOESY),在300 ms,25 ℃条件下研究了G -四链体结构及其与巴马汀的相互作用。亚氨基质子交换缓慢,一般可研究50~300 ms范围的1H NMR图,从而得到更详细的G -四链体结构信息[16]。图7中,G -四链体本身谱图的低场区出现了四个峰,表明四分体的形成;加入盐酸巴马汀后,其中两个峰消失,另外两个峰位置移动,且峰强度减弱,表明巴马汀与G -四链体产生了作用。

图6 盐酸巴马汀与G -四链体DNA的圆二色滴定曲线Fig.6 CD titration curves of palmatine chloride with G -quadruplex DNAcDNA=3.5×10-5 mol/L,a-g:c palmatine =0 - 7.1×10-5 mol/L.

图7 盐酸巴马汀与G -四链体的 1H NMR谱Fig.7 1H NMR spectra of the mixture of palmatine chloride with G -quadruplex DNA"a" is the 1H NMR curve of the interaction between palmatine chloride and G -quadruplex DNA;"b" is the 1H NMR curve of G -quadruplex DNA.
这可能是由于盐酸巴马汀与G -四链体作用后加大了G -四链体亚氨基质子周围的电子云密度,屏蔽效应增强,导致G -四链体峰位向高场移动[17]。由于G -四链体的质子交换一直处于动态变化中,且实验所需的DNA浓度较大,具体结合位点还有待进一步研究。
2.5 过氧化酶抑制实验
利用竞争实验可以探究盐酸巴马汀与G -四链体的结合方式是否为末端堆积。Yang等[18]报道Hemin堆积到G -四链体上后会释放过氧化酶,在H2O2存在时,会对ABTS2-产生氧化作用,其催化氧化产物在415 nm附近有紫外吸收。当G -四链体的其他配体与Hemin具有相同的结合位点时,它将与Hemin竞争结合G -四链体,并减缓G -四链体/Hemin复合物产生过氧化酶的速率,从而降低相应催化氧化产物的吸光度。图8为盐酸巴马汀G -四链体/Hemin配合物的过氧化酶抑制活性曲线,由图可知,在不含盐酸巴马汀的对照组中,G -四链体/Hemin的催化氧化产物在415 nm处的吸光度随时间变化先迅速增强后缓慢下降,加入盐酸巴马汀后,其催化氧化产物吸光度的增加明显受到抑制,说明盐酸巴马汀与Hemin具有相同的结合位点,据此,我们推测盐酸巴马汀与G -四链体的作用模式为末端堆积。盐酸巴马汀与G -四链体的作用及其与Hemin的竞争模拟见图9。

图8 盐酸巴马汀与G -四链体/Hemin配合物的过氧化酶抑制活性Fig.8 Inhibition effect of palmatine chloride on the peroxidase activity of G4 DNA/Hemin complex"a" is the curve of the peroxidase activity of G4 DNA/Hemin complex;"b" is the curve of inhiblition effect of polmatine on the peroriolase activity of G4 DNA/hemin complex.
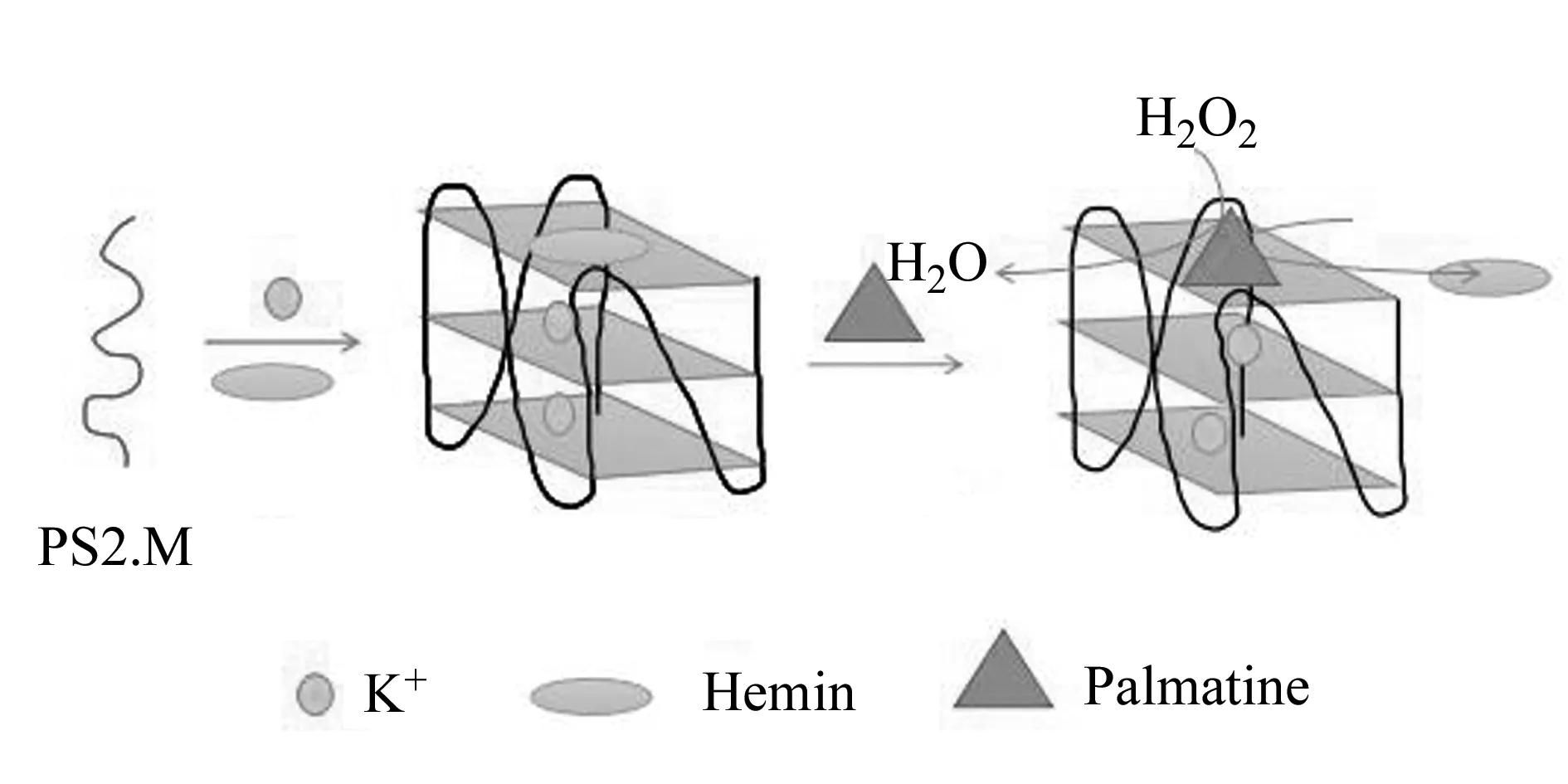
图9 盐酸巴马汀与G -四链体的作用及其与Hemin的竞争实验模拟图Fig.9 The simulation of the interaction between G -quadruplex and palmatine chloride and competition of palmatine with hemin
3 结论
采用多种光谱手段探究了盐酸巴马汀与G -四链体之间的相互作用。紫外滴定光谱及荧光现象表明盐酸巴马汀通过π-π堆积作用使G -四链体结构达到稳定;根据Scatchard方程计算结合常数K为4.83×106L/mol,结合比n为1∶1;圆二色谱证实在K+存在下,核酸适配体PS2.M形成了平行的G -四链体结构,盐酸巴马汀没有改变G -四链体的构象;1H NMR也表明盐酸巴马汀能够与G -四链体发生相互作用并稳定G -四链体结构。盐酸巴马汀/G -四链体/Hemin配合物的过氧化酶抑制实验表明:两者作用模式为末端堆积。
