一道电离平衡常数试题的三种解法
2018-11-07黄应平
黄应平
龙岩市高级中学 福建龙岩 364000
弱碱(或弱酸)及其盐混合溶液的平衡与电离平衡常数的求解等问题学生普遍感到困难。本文介绍一道有关一水合氨电离平衡常数试题的三种解法,敬请同行们斧正。
一、试题内容及标准答案
1.试题内容:现代传感技术在化学实验中有广泛的应用。某小组用传感技术研究喷泉实验(装置如图1所示),并测定室温下氨水的电离常数Kb。
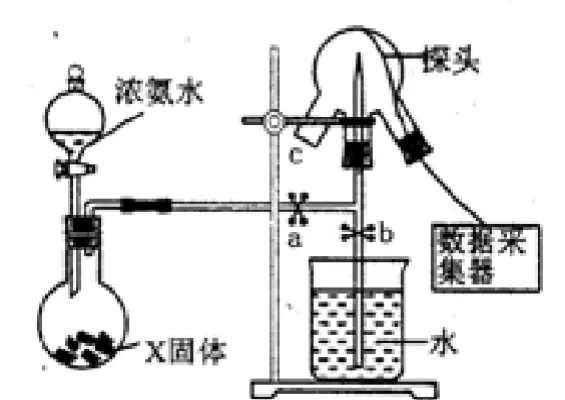
图1 氨气喷泉实验

图2 盐酸滴定氨水的pH曲线
取图1三颈瓶中氨水25.00 mL于锥形瓶中,用0.0500 mol L-1HCl滴定,混合溶液的pH变化曲线如图2所示。室温下,NH3 H2O的Kb≈_______________。(保留两位有效数字)
2.标准答案:Kb≈2.2
二、解题的一般过程
步骤1:确定所取氨水中NH3H2O的物质的量浓度。由试题图3不难判定C点为滴定的终点,NH3H2O与HCl恰好完全反应。22.50毫升0.0500mol L-1HCl中HCl的物质的量为1.125×10-3mol;根据反应方程式NH3H2O+HCl=NH4Cl+H2O,可解得NH3H2O的物质的量也为1.125×10-3mol;浓度为 0.045 mol L-1。
步骤2:通过电离方程式NH3H2ONH4++OH—,计算Kb。
具体解法为:由试题图3可知氨水的PH值为11,即该溶液OH-浓度为10-3mol L-1。忽略水电离出的OH—,NH3H2O电离平衡时各组分的关系如下:

三、笔者的解题过程
笔者的解题方法有三种,方法一与上述的解法相同。方法二:由试题图3的C点可得,NH3H2O与HCl恰好完全反应时溶液的PH值为5.5,溶液之所以呈酸性,是因为生成的NH4+发生了水解。此时溶液中 NH4Cl的物质的量为1.125×10-3mol,溶液体积为 25ml+22.50 ml=0.04750L,故NH4Cl的浓度为 1.125×10-3÷0.04750=0.02368 mol L-1。忽略水电离出的H+,NH4+水解平衡时各组分的关系如下:

方法三:由试题图3的b点可得,当溶液为中性时,25ml氨水中加入 HCl的物质的量为 22.40×10-3×0.0500 mol=1.12×10-3mol,根据 NH3H2O+HCl==NH4Cl+H2O,可得生成的NH4Cl也为1.12×10-3mol。由上述“解题的一般过程”可知25ml氨水中NH3H2O的物质的量为1.125×10-3mol,故在 b点时剩余的 NH3H2O 为 1.125×10-3mol-1.12×10-3mol=5×10-6mol。此时的溶液可以看着是体积为25ml+22.40ml=0.04740L,含有 1.12×10-3molNH4Cl与 5×10-6mol-NH3H2O的混合水溶液。NH4+水解产生了 NH3H2O和H+,而NH3H2O电离产生了NH4+和OH—,由于溶液为中性,说明NH4发生水解与NH3H2O发生电离的物质的量相等,因此溶液中NH4+与NH3H2O的物质的量和浓度都不变。混合溶液中各组分的关系如下:
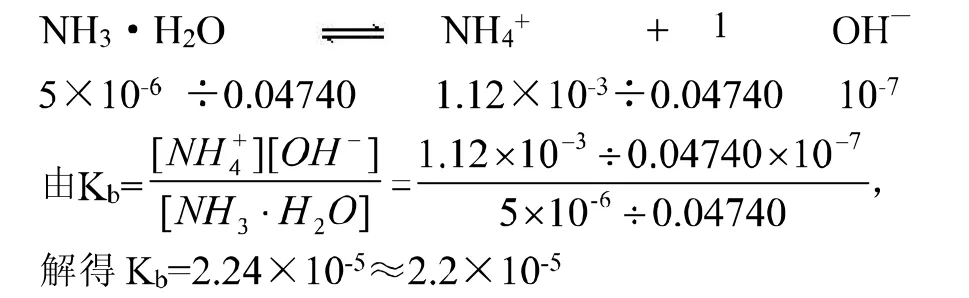
以上三种不同的解法,解法本身无疑都是正确的。前两种都采用了近似值解法,只有方法三是精确解法。
