迷走复合体和迷走神经在炎症反应中的可塑性
2018-11-06王天
, , 王天,
(1. 山东农业工程学院 环境科学与工程学院, 山东 济南 250100; 2.山东师范大学 生命科学学院, 山东 济南 250014)
胆碱能抗炎通路是最近发现的一种神经系统与免疫系统相结合的重要的炎症调节通路,并通过外周迷走神经介导,快速、有效地调节机体局部或全身的炎症反应[1-2]。该抗炎通路的发现将有利于炎症发生机制的进一步研究,为临床上寻求更好的炎症治疗措施提供依据。
胆碱能抗炎通路类似于炎症反射, 并且有一套完整的反射弧, 包括感受器、 传入神经、 反应中枢、 传出神经、 效应器。 迷走神经是一种复合型神经, 既包括迷走传入神经, 也包括迷走传出神经, 在中枢与外周免疫系统间起着双向信息交流的作用。 迷走复合体(dorsal vagal complex,DVC)作为炎症反射的中枢系统, 主要由迷走神经背核(dorsal motor nucleus of vagus nerve, DMV)和孤束核(nucleus tractussolitarious, NTS)组成。 DMV为迷走传出神经起始点, 司运动; NTS为迷走传入神经终止点, 司内脏感觉。 NTS与DMV之间有纤维投射,位置关系紧密。Hermann等[3]研究发现,在炎症反应过程中,NTS和DMV中Fos阳性神经元数量增加;黄健等[4]研究表明,在炎症反应过程中,迷走神经放电频率增大,递质释放增多,因此胆碱能抗炎通路参与了炎症反应。目前,炎症反应过程中迷走神经放电频率与NTS和DMV中Fos阳性神经元表达的相关性研究未见报道。
本文中通过制备大鼠内毒素脂多糖(lipopolysaccharide,LPS)炎症模型,比较LPS注射后对迷走神经放电频率和DVC神经元Fos表达的影响,分析DMV和NTS神经元的Fos表达与迷走神经放电频率的相关性,以进一步探究DVC和迷走神经在炎症反应调节中所起的作用。
1 材料与方法
1.1 材料
实验用大鼠为体质量是180~220 g、 品系为Wistar的雄性大鼠,由山东大学实验动物中心提供,许可证号为SCXK(鲁)2003-0004。在室温为(22±2)℃和自然光照条件下单笼饲养。
主要试剂包括:LPS,美国Sigma公司;肿瘤坏死因子α(TNF-α)ELISA检测试剂盒,北京达科为生物技术有限公司;正常山羊血清(NGS),江苏晶美生物科技有限公司;SP试剂盒和显色试剂盒,北京中杉金桥生物技术有限公司;兔抗Fos抗体SC-52,美国Santa Cruz生物公司。
主要仪器包括:856型冰冻切片机,美国AO Histostat Microtome公司;DG3022A型酶联免疫检测仪,华东电子管厂;JS-21型高速冷冻离心机,美国Beckman公司;光学显微镜,日本Olympus公司;双极性黄金电极,成都仪器厂;保温台,自制;雷磁PHS-3D型pH计,上海精密科学仪器有限公司;BS200S型电子天平,北京赛多利斯天平有限公司;BL-420F型生物机能实验系统,四川成都泰盟仪器公司。
1.2 方法
1.2.1 LPS炎症动物样本的制备
实验分为生理盐水对照组和LPS炎症组2组。
实验前,LPS组大鼠禁食24 h,自由饮水。实验开始时,用质量分数为20%的乌拉坦腹腔注射(大鼠每千克体质量注射5 g)麻醉大鼠,仰卧位固定四肢于37 ℃恒温台上。左右腹股沟部、左侧颈部用眼科剪剪毛,酒精消毒,剪出长度为1~1.5 cm的皮肤切口,分别用玻璃分针分离出右股静脉(注射药物)和左股动脉(记录血压)并穿线备用[5],后者用玻璃分针分出左侧迷走神经干并穿单线备用。为了避免强烈的声光和外来电磁干扰对大鼠的刺激,整个实验过程均在屏蔽室中进行。神经放电和血压记录信号稳定后,股静脉注射质量浓度为2 g/L的LPS(大鼠每千克体质量注射5 mg)。对照组的其他操作同LPS组,股静脉注射等容量生理盐水。
1.2.2 迷走神经干放电的测定
轻提棉线将迷走神经干置于极间距为2 mm的双极黄金电极上[6],电极的2个夹子分别夹住颈部两侧剪开的皮肤,神经和电极接触良好即可,不可过松或过紧。黄金电极另一端连接至多通道生理记录仪记录神经放电,时间常数、采样率、滤波范围分别为0.001 s、 5 kHz/s、 100~1 000 Hz,以注射对照组和LPS组前的放电为基础放电,在6个时间点记录放电信号的变化,即LPS注射前以及注射后10、 30、 60、 120、 180 min。
1.2.3 股动脉血压的测定
分别用动脉夹夹住分离出的股动脉两端,并在其上剪出一个小切口,将静脉注射用针头插入向心端,将针尖缓慢送至动脉夹处,在含有针头的血管下方绕线并打一个虚结,松开动脉夹,继续将针头向前送至0.5~1 cm左右,打成死结。将另一端的压力换能器接于多通道生理记录仪记录血压变化,采样率、滤波范围分别设为5 kHz/s、100~1 000 Hz,最后用计算机进行血压信号采集并记录和储存。
1.2.4 血标本的采集处理及TNF-α含量的测定
配制标准品稀释液质量浓度分别为1 000、 500、 250、 125、 62.5、 31.3 ng/L共6个浓度梯度。标准孔各加入100 μL以上6个质量浓度的标准稀释液,样品孔加100 μL血清,空白孔加入物质的量浓度为0.02 mol/L的磷酸盐缓冲液作为洗涤液。标准孔、样品孔、空白孔各加入50 μL稀释后的生物素抗体(按生物素抗体与水的体积比为1∶1 000进行稀释),分别混匀后,封板膜封住,放于37 ℃水浴锅中90 min,洗板4次;每个孔加入100 μL的链亲和素辣根过氧化物酶(Streptavidin-HRP,含体积分数为10%的聚乙二醇辛基苯基醚(Triton X-100)稀释液,混匀后,封膜,放入37 ℃水浴锅90 min,洗板4次。每个孔加入100 μL四甲基联苯胺(TMB),于水浴锅中37 ℃避光温育5~30 min,每个孔加入100 μL终止液终止反应。在10 min内利用酶标仪检测波长为450 nm处光密度值。根据6个标准孔和1个空白孔的光密度值,求出标准曲线回归方程,进而求出样品孔血清TNF-α的浓度。
1.2.5 延髓脑组织切片制备
腹腔过量注射质量分数为20%的乌拉坦(大鼠每千克体质量注射5 g)处死动物,先用250 mL左右pH为7.4且物质的量浓度为0.01 mol/L的磷酸盐缓冲液进行心脏灌流,随后灌入500 mL左右pH为7.4且质量分数为4%的多聚甲醛(PFA)。
脑干剥离、固定、脱水,随后进行脑干连续恒冷冠状切片,切片厚度为30 μm,收集于物质的量浓度为0.01 mol/L的磷酸盐缓冲液中。
1.2.6 Fos蛋白免疫组织化学染色
脑片置于多孔板上,加入孵育液室温孵育30 min;封闭液室温处理30 min;加入兔抗Fos抗体在温度为4 ℃的冰箱中孵育24 h;加入体积分数为25%的生物素标记山羊抗兔IgG室温孵育2 h;链亲和素辣根过氧化物酶复合物(含体积分数为10%的Triton X-100)常温孵育60 min; 二氨基联苯胺(DAB)处理5~10 min;贴片,复染并封片;神经元Fos显微照相及处理,统计NTS和DMV阳性神经元在0.01 mm2面积上的个数和平均累积光密度(IOD)值。
1.3 统计学数据处理
采用SPSS 17.0软件分析数据, 利用t检验进行组间比较与组内比较。 若显著性检验水平P<0.05, 则差异显著;若P<0.01,则差异极显著。
2 实验结果
2.1 LPS炎症对动脉血压的影响
LPS注射后对动脉血压的影响见图1。由图可知,与对照组相比,LPS炎症组动脉血压变化差异不明显(P>0.05);LPS炎症组内毒素注射前及注射后各时间点动脉血压差异无统计学意义(P>0.05)。
2.2 LPS炎症对迷走神经放电频率的影响
LPS注射后对迷走神经放电频率的影响见图2、 3。 由图可知, 分别以注射对照和 LPS 前的放电为基础放电,对照组中各时间点与基础放电相比,未见明显变化(P>0.05);与其基础放电相比,LPS组放电频率明显增大(P<0.01);LPS组与对照组相比,注药后各时间点放电频率明显增大(P<0.01)。由此可知,迷走神经通过放电频率的增大来调节炎症反应。
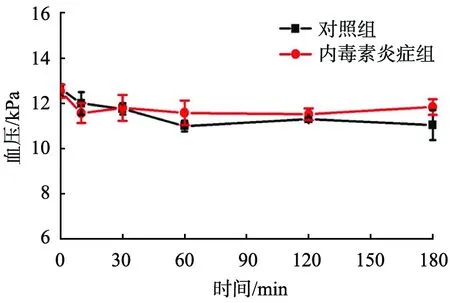
图1 脂多糖(LPS)炎症时动脉血压的变化
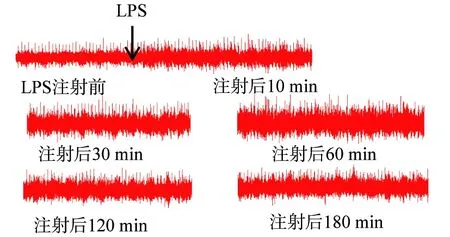
图2 脂多糖(LPS)炎症颈迷走神经各时间段放电变化
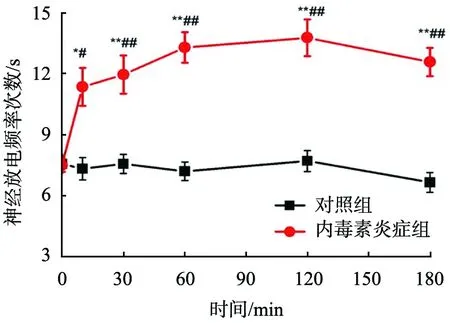
*—P<0.05;**—P<0.01,对照组与内毒素炎症组;#—P<0.05;##—P<0.01,LPS注射前与注射后。
2.3 LPS炎症对血清TNF-α水平的影响
测得LPS炎症组血清TNF-α的质量浓度为66.74 ng/L, 对照组血清TNF-α的质量浓度为2.59 ng/L, 因此,相对于对照组,LPS炎症组TNF-α的质量浓度明显增大,差异非常显著(P<0.01)。
2.4 LPS炎症对DVC神经元Fos表达的影响
LPS炎症对DMV和NTS神经元Fos蛋白表达的影响结果见图4。由图可知,在DMV和NTS中Fos阳性神经元呈棕黄色。
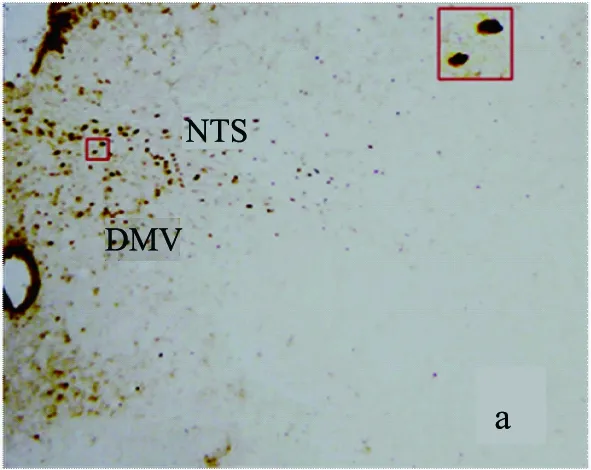
(a)对照组

(b)LPS组图4 迷走神经背核(DMV)和孤束核(NTS)中Fos蛋白表达结果(放大100倍)
注射LPS后,DVC中NTS和DMV神经元Fos表达统计比较结果见图5。由图可知,与对照组相比,LPS组Fos阳性神经元的数量在NTS和DMV均显著增多(P<0.01或P<0.05);同时DMV和NTS的Fos阳性神经元表达的强度(AIOD)也均有极显著增强(P<0.01)。由此推断,在LPS大鼠炎症模型中,DVC中的核团NTS和DMV参与了炎症反应。
3 讨论
LPS是多种革兰氏阴性菌的细胞壁成分,对宿主有毒性,能够引起机体免疫刺激的级联反应和机体的毒性病理生理活动,因此可作为强炎症诱导物,诱导机体内炎症细胞因子如IL-1、IL-6、TNF-α等的合成与分泌,诱导疾病研究的动物模型如炎症反应,急性肺损伤等[7]。
在LPS炎症模型反应中, 刺激机体产生炎症细胞因子, 并进一步诱导各脏器的损伤, 其中TNF-α是诱导组织损伤的最关键细胞因子。TNF-α在炎症反应中作为关键启动因子,与疾病发生程度有明显的相关性[8]。研究[9]表明,大鼠静脉滴注LPS,TNF-α水平明显升高,平均动脉血压很快下降并出现休克。与本实验静脉注射LPS后, TNF-α水平比对照组的显著升高,动脉血压降低的结果相一致。
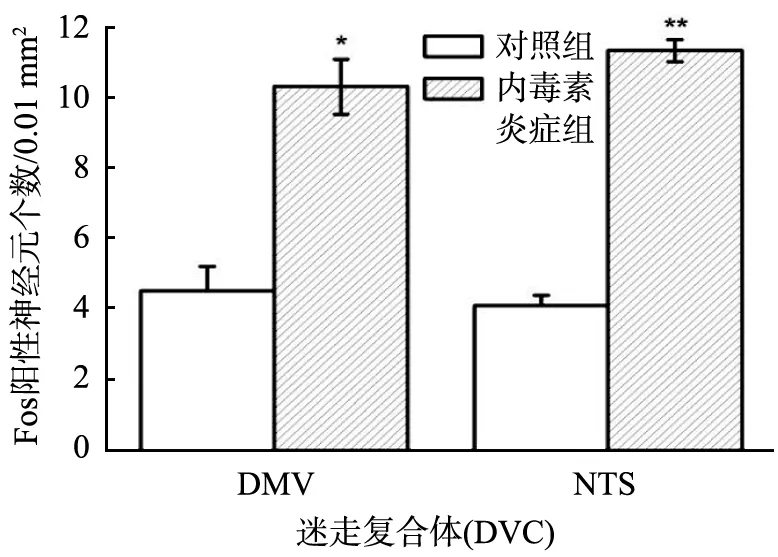
(a)神经元Fos表达
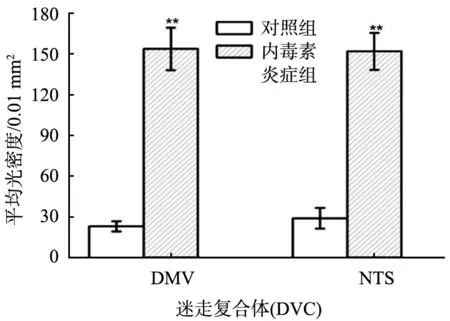
(b)平均光密度*—P<0.05;**—P<0.01,对照组与内毒素炎症组;DMV—迷走神经背核;NTS—孤束核。
研究[10-14]表明,免疫系统不仅受神经内分泌系统和交感神经系统的调节,还受迷走神经重要的调控作用,已成为近几年的研究热点。迷走神经可以直接把外周的炎症性刺激传到中枢神经系统,如把膈下迷走神经切断,可阻断由腹腔注射IL-1引起的发热反应[15]。另外,注射LPS所引起的大鼠发热可通过切断膈下迷走神经而得到缓解,同时室旁核神经元放电频率减小[16]。本文中的研究发现,静脉注射LPS后,迷走神经的放电频率比对照组的明显增大,进而可推测通过迷走传入神经向中枢传递的信息增多,或迷走传出神经从中枢向外周传递的冲动增加,说明迷走神经直接参与了炎症信息的传递。最新研究[17-18]表明,颈迷走神经刺激可显著抑制大鼠心肌缺血再灌注损伤的影响,迷走神经电刺激可活化胆碱能抗炎通路对LPS血症小鼠肠道上皮和肺的血气屏障的通透性的保护作用。Thomas等[19]通过缺血再灌注损伤引起的TNF-α增加可通过电生理刺激迷走神经来减少,从而缓解缺血再灌注引起的休克。黄健等[4]发现,夹伤迷走神经干外周端或中枢端并注射LPS后,迷走神经传入或传出纤维放电频率明显增大,均表明迷走神经参与了机体的抗炎症反应。
在注射LPS后,可引起下丘脑室旁核和视上核Fos表达增加,而且室旁核随着注射LPS剂量的增加Fos阳性神经元表达显著增强[20-23]。Hermann等[3]研究发现,在炎症反应过程中,NTS和DMV中Fos阳性神经元数量增加与本实验结果一致,说明迷走神经放电频率增大向中枢传递的冲动增多或中枢兴奋性增加向外周传递信息增多,引起中枢DVC中核团NTS和DMV的Fos阳性神经元数量增加,进而对胆碱能抗炎症通路的研究提供了实验基础。
4 结论
本文中通过制备大鼠LPS炎症模型,在迷走神经放电和DVC神经元Fos表达关联的基础上,比较LPS注射后对迷走神经放电频率和DVC神经元Fos表达的影响。结果表明,在炎症反应中,迷走神经放电频率增大,NTS和DMV的Fos蛋白表达增强,说明迷走神经可能参与了胆碱能抗炎通路,NTS和DMV可能为胆碱能抗炎通路的低位中枢,通过迷走传入神经纤维完成对外周信息的接受、处理和整合并将产生的冲动经迷走传出神经纤维调节炎症反应。
迷走神经是复合神经,在炎症反应中是迷走传入神经纤维放电频率增加还是迷走传出神经纤维放电频率增加的问题值得进一步研究和探讨。
