外源生长调节物质对甜高粱种子萌发过程中盐分胁迫的缓解效应及其生理机制
2018-11-06朱广龙宋成钰于林林陈许兵智文芳刘家玮焦秀荣周桂生
朱广龙 宋成钰 于林林 陈许兵 智文芳 刘家玮焦秀荣 周桂生,,*
外源生长调节物质对甜高粱种子萌发过程中盐分胁迫的缓解效应及其生理机制
朱广龙1,**宋成钰2,**于林林2陈许兵2智文芳2刘家玮2焦秀荣1周桂生1,2,*
1扬州大学农业科技发展研究院/ 教育部农业与农产品安全国际合作联合实验室, 江苏扬州 225009;2扬州大学江苏省粮食作物现代产业技术协同创新中心, 江苏扬州 225009
盐渍化土壤中盐胁迫是作物种子萌发和生长发育的主要限制因子, 探究盐分胁迫下提高种子萌发率的技术及机制对开发利用盐碱地有重要意义。本文以不同耐盐能力的高粱品种国甜2011和国甜106为材料, 研究了盐分对甜高粱种子萌发期生长过程的影响, 并比较了耐盐性差异。以耐盐性弱的国甜106为试材, 探究盐分胁迫下不同生长调节物质[γ-氨基丁酸(GABA)、赤霉素(GA3)、激动素(KT)和水杨酸(SA)]对甜高粱种子吸水萌发过程中生长特性的调节效应。表明, 盐分胁迫显著抑制种子的吸水萌发, 降低种子的吸水速率、发芽势、发芽率、发芽指数, 增加种子的相对盐害率和丙二醛(MDA)含量。外源生长调节物质可有效缓解盐害, 显著增加种子的吸水率、发芽率、可溶性糖含量、可溶性蛋白含量, 提高SOD (超氧化物岐化酶)、POD (过氧化物酶)、CAT (过氧化氢酶)的活性, 促进K+、Ca2+、Mg2+离子的吸收, 降低Na+和MDA含量。外源生长调节物质主要是通过提高保护酶活性、渗透调剂物质含量和维持体内离子平衡来提高耐盐性。GA3和GABA对盐害的缓解效应较好, 而KT促进种子对Mg2+的吸收效果较好。本研究表明外源生长调节物质(尤其是GA3和 GABA)可用于盐碱地高粱生产, 为减轻盐碱地对高粱的盐碱胁迫提供了理论依据。
甜高粱; 盐胁迫; 外源生长调节物质; 种子萌发; 生理特性
目前土壤盐碱化日益加剧, 已成为全球的生态和资源问题[1-2]。我国盐碱地达1×108hm2 [3], 近年面积逐步扩大[4], 其中约4/5未能开发利用, 因此盐碱地的改良和综合开发利用已成为农业生产急需解决的难题[5]。种植耐盐作物是开发利用盐碱地的有效途径之一。甜高粱([L.] Moench)是一种新兴的糖料、饲料和能源作物[6-7], 其原产于气候炎热干燥、土壤贫瘠的非洲热带大陆, 具有抗旱、耐涝、耐高温、耐盐碱、干物质生产效率高等特性[8]。然而, 当土壤盐分高于0.3% 时, 甜高粱种子的萌发、出苗受到影响, 产量降低[9]。因此, 盐分胁迫下解决甜高粱种子萌发、出苗困难等基础性问题, 是推广种植甜高粱和开发利用盐碱地资源的前提。
目前, 关于甜高粱对盐分胁迫响应方面的研究主要集中在耐盐水平的鉴定与耐盐种质资源的筛选、种子萌发和幼苗生长过程中的生理生化变化, 外施激素或养分对甜高粱在盐胁迫下生长及生理的影响等方面。高建民等[10]对66份高粱种质资源的耐盐性鉴定表明, 苏丹草类的高粱品种耐盐性较强, 而保持系类的高粱材料对盐分较为敏感。在不同浓度盐分胁迫下, 甜高粱的种子萌发均受到抑制, 出苗率下降, 生长减缓[11]。生理方面, 盐分胁迫导致甜高粱氧化损伤和渗透胁迫, 破坏细胞膜结构、降低光合速率、破坏离子平衡等[12-13]。盐胁迫抑制种子萌发和幼苗生长的主要因素是由渗透胁迫造成的生理干旱[14]。外施氮素[15]、植物生长调节剂[16-17]等可显著缓解盐分的危害。种子的萌发和出苗过程是自给自足的营养生长阶段, 对氮、磷、钾肥的吸收较少[18-22], 而施用外源生长调节物质和渗透调节物质可有效减缓和消除盐分胁迫导致的水势降低、离子毒害等影响[23]。上述研究大都集中于外施单一外源物质对盐胁迫的影响, 而较少关于不同种类外源生长调节物质对盐分胁迫的缓解效应及相关机制。
本文在前人研究的基础上, 外施γ-氨基丁酸(GABA)、赤霉素(GA3)、激动素(KT)和水杨酸(SA) 4种生长调节物质, 分析盐分胁迫下不同生长调节物质对甜高粱种子的萌发、生长和生理特性的调节效应, 为揭示植物的盐害机制和探究外源调节物质缓解盐分胁迫的作用机制提供参考。
1 材料与方法
1.1 试验设计
试验于2016年在扬州大学江苏省作物栽培生理重点实验室和教育部农业与农产品安全国际合作联合实验室进行。前期试验以2个耐盐的甜高粱品种国甜2011和国甜106作为试验材料进行耐盐性鉴定试验。然后以两者中耐盐性较敏感的国甜106为试材, 进行外源生长调节物质对耐盐性调节效应的研究。试验采用北京育种基地当年收获的种子(发芽率>85%)。
盐溶液由NaCl (分析纯)和蒸馏水配置而成, 耐盐性鉴定试验设置5个盐分梯度浓度, 即0、50、100、150、200 mmoL L–1; 生长调节物质调节试验设置 4个盐分浓度梯度, 0、50、100、150 mmoL L–1。
选取饱满、大小一致的种子, 用1%的次氯酸钠溶液消毒10 min, 蒸馏水反复冲洗干净, 风干备用。选内径15 cm的带盖玻璃培养皿, 内置直径为15 cm的滤纸(双圈牌, 杭州沃华滤纸有限公司, 中国), 每皿均匀放入种子100粒, 注入Hoagland[10]营养液50 mL, 每个处理3个重复。培养皿中分别加入相应的NaCl处理液10 mL, 然后将培养皿放入光照周期为12 h/12 h (昼/夜)、温度为25℃的培养箱, 在设定的时间开盖记录种子吸水和萌发情况。试验过程中每隔24 h换一次处理液以保证处理间盐分浓度的一致性。
选取500 μmol L–1γ-氨基丁酸(GABA)、300 μmol L–1赤霉素(GA3)、232.3 μmol L–1激动素(KT)、362 μmol L–1水杨酸(SA) 4种外源生长调节物质进行种子引发。这些处理浓度由预试验筛选得出。25℃条件下各生长调节物质浸种引发12 h, 浸种后将种子捞出, 用蒸馏水冲洗3次, 再用吸水纸吸干, 称量记录原始重量。然后将不同种类外源生长调节物质引发的种子放入不同浓度梯度的NaCl溶液中, 后续操作同上述耐盐性鉴定试验。
1.2 测定参数
试验开始后4~48 h期间, 定时测定种子的吸水量, 将每个培养皿中的种子取出, 用吸水纸吸去种子表面的水分后称重, 计算吸水率和吸水速率。每隔12 h计算各处理的发芽数、发芽势、发芽率、种子发芽指数、相对盐害率和种子发芽相对盐害率等指标。同时, 用游标卡尺测量胚根和胚芽长度。待萌发第5天, 选完整种子(包括芽)测定渗透调节物质含量和抗氧化酶活性。
1.2.1 种子萌发指标 种子吸水率(%) = [(X–0)/0]×100; 种子吸水速率(%h–1) = (X–X–1)/ [–(–1)], 式中,0为100粒甜高粱种子的原始重量(g);X为试验进行到小时100粒种子的重量(g)。
种子发芽率(%) = 第7天发芽种子数/供试种子数×100; 种子发芽势(%) = 第3天种子发芽数/供试种子数×100; 种子发芽指数(GI) = ∑G/D, 式中,G为时间的发芽数,D为相应的发芽天数。
种子发芽相对盐害率(%) = (对照种子发芽数–处理种子发芽数) /对照种子发芽数。
1.2.2 渗透调节物质的测定 采用硫代巴比妥酸(TBA)溶液法测定丙二醛(MDA)含量[13,16]。MDA = [6.45 × (D532–D600) –0.56D450] / 100 × 样品鲜重。采用蒽酮比色法测定可溶性糖含量[16]。可溶性糖含量(mg g–1) = (从标准曲线上算得葡萄糖的mg数×稀释倍数)/样品重(g)。采用考马斯亮蓝G-250染色法测定可溶性蛋白[17]。蛋白质含量(mg) = (从蛋白质标准曲线上算得蛋白质µg数×稀释倍数)/1000。
1.2.3 抗氧化酶活性测定 采用紫外吸收法进行测定过氧化氢酶(CAT)活性[8]。采用愈创木酚染色法测定过氧化物酶(POD)活性[18]。采用氮蓝四唑(NBT)比色法测定超氧化物歧化酶(SOD)活性[7]。
1.2.4 离子含量的测定 采用焰色反应进行测定K+和Na+; 采用原子吸收光谱法测定Ca2+和Mg2+。
1.3 数据分析
采用Microsoft Excel 2007录入数据、计算与绘图, 采用SPSS17.0统计软件对数据进行单因素方差分析(One-way ANOVA)和二因素方差分析(Two-way ANOVA), 多重比较采用最小显著差异法(LSD), 显著性水平设定为0.05。
2 结果与分析
2.1 不同浓度盐分胁迫对甜高粱种子萌发的影响
2.1.1 对种子吸水速率的影响 由图1可知, 种子的吸水速率随盐分浓度的增大而减小。种子的快速吸水时期在0~8 h。在开始的8 h和最后的12 h, 国甜2011的吸水速率显著大于国甜106, 而中间时刻两品种的吸水速率相差较小。在0、50、100 mmol L–1盐分条件下, 处理4 h时种子吸水速率最大, 8 h后种子吸水速率快速下降; 而在150 mmol L–1和200 mmol L–1盐分条件下, 处理8 h种子的吸水速率最大。
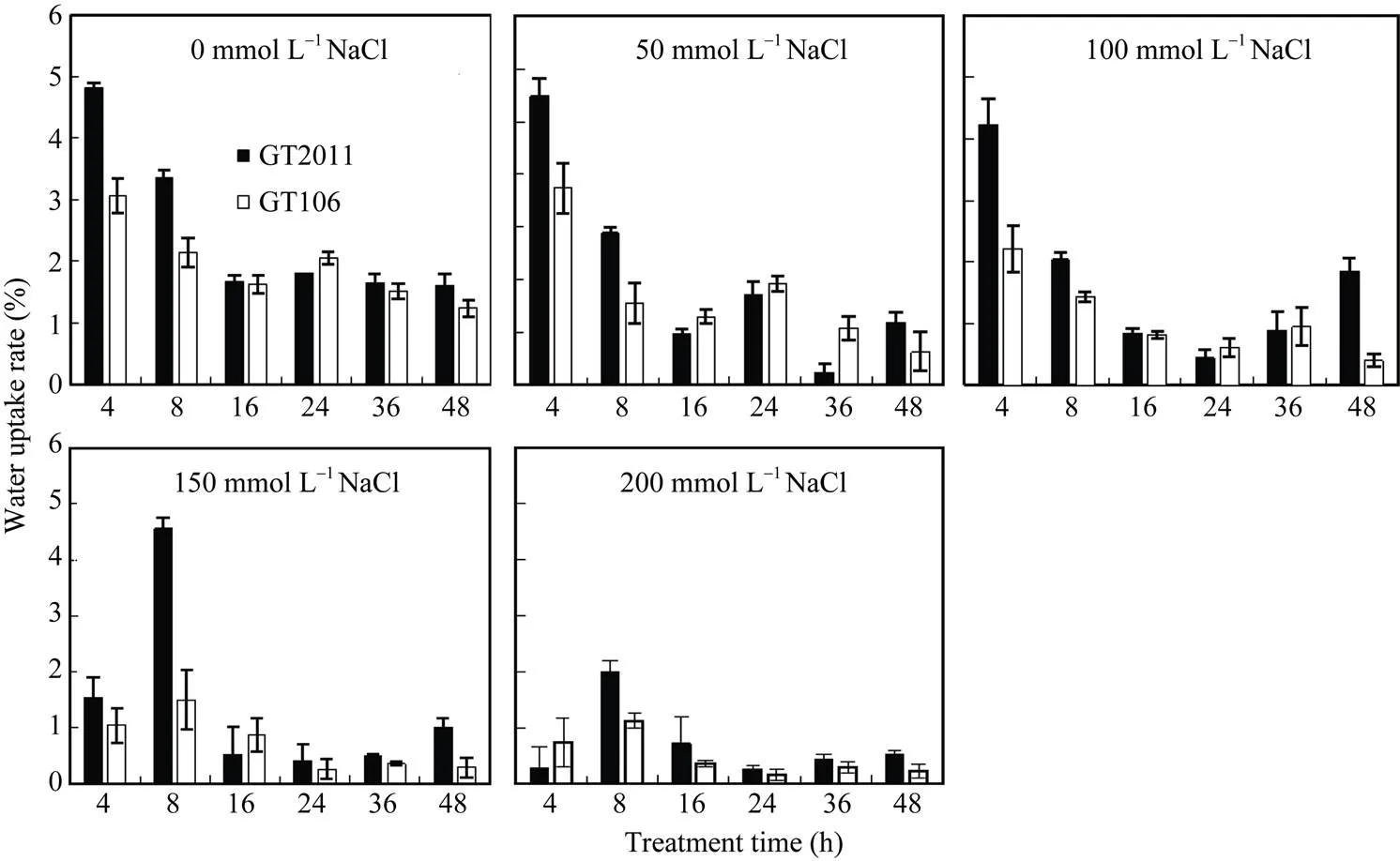
图1 不同盐分浓度处理对甜高粱种子吸水速率的影响
GT2011: 国甜2011; GT106: 国甜106。
GT2011: Guotian 2011; GT106: Guotian 106.
2.1.2 对种子发芽率、发芽势及发芽指数的影响
随盐分浓度增大, 2个品种的发芽势、发芽率和发芽指数均逐渐降低(表1)。与对照相比, 50 mmol L–1盐分浓度处理下, 国甜2011的发芽势、发芽率和发芽指数下降不显著, 而国甜106显著降低, 这表明国甜106对盐分较为敏感。当盐分浓度大于100 mmol L–1时, 2个品种的发芽势、发芽率和发芽指数均显著降低。各盐分浓度处理下, 国甜2011的发芽率、发芽势和发芽指数均显著高于国甜106。
2.1.3 对相对盐害率的影响 甜高粱种子的相对盐害率随盐分浓度的增加而增大(表2)。200 mmol L–1盐分浓度处理下, 2个品种的相对盐害率均达到最大。各萌发时期, 不同盐分浓度下国甜106的相对盐害率的增幅大于国甜2011, 且国甜106的相对盐害率显著高于国甜2011。这也表明国甜106对盐分胁迫较为敏感。
2.1.4 不同盐分浓度胁迫对种子MDA含量的影响
随盐分浓度增大, 两个甜高粱种子的MDA含量显著增加(表3)。与对照相比, 在50、100、150和200 mmol L–1NaCl处理下, 国甜2011的MDA含量分别增加了1.6、1.7、2.3和2.5倍; 而国甜106则分别增加了 1.4、1.6、2.1和2.2倍。盐分胁迫下, 国甜106的MDA含量显著高于国甜2011。各盐分处理浓度下, 国甜106的MDA含量比国甜2011分别高69.6%、50.0%、55.0%、56.6%和50.9%。
2.2 盐分胁迫下外源生长调节物质对甜高粱种子萌发的影响
2.2.1 种子吸水率 表4方差分析可知, 盐分胁迫对种子吸水萌发的影响主要在处理8 h后达到显著水平, 0~8 h无显著影响。外源生长调节物质对种子吸水萌发的影响在各时间点均达到极显著水平。盐分浓度和外源生长调节物质的交互作用对种子吸水萌发的影响仅在处理24~36 h达到极显著水平, 其余处理时间段均不显著。

表1 甜高粱品种在不同盐分处理下的种子发芽势、发芽率和发芽指数
同列标以不同字母的数值在0.05水平差异显著。
Values followed by a different letter within a column are significantly different at the 0.05 probability level.

表2 不同盐分浓度胁迫下甜高粱种子的相对盐害率
同列标以不同字母的数值在0.05 水平差异显著。
Values followed by a different letter within a column are significantly different at the 0.05 probability level.

表3 不同盐分胁迫下甜高粱种子中MDA含量
同列标以不同字母的数值在0.05水平差异显著。
Values followed by a different letter within a column are significantly different at the 0.05 probability level.
由表5可知, 随萌发时间的延长, 甜高粱种子的吸水率逐渐增加, 其快速吸水期均出现在处理后的16~24 h。种子吸水率在50 mmol L–1盐分处理下显著增大, 而盐分处理浓度大于100 mmol L–1时, 种子吸水率急剧降低。在各盐分浓度处理下, 外源生长调节物质可有效缓解盐分胁迫对种子吸水率的影响。在50、100和150 mmol L–1盐分条件下, GA3调节下种子的吸水率最高, 其次是GABA。各盐浓度分处理下, 不同类型外源生长调节物质对种子吸水率的调节效应在萌发前期不显著(0~16 h), 萌发后期效果明显(16~48 h)。

表4 不同外源生长调节物质对不同盐分浓度下甜高粱种子吸水率影响的方差分析
ns: 差异不显著;*和**分别表示在0.05和0.01水平差异显著。
ns means no significant;*and**mean significantly different at the 0.05 and 0.01 probability levels, respectively.

表5 不同外源生长调节物质对不同盐分浓度下甜高粱种子吸水率的影响
KT: 激动素; GA3: 赤霉素; SA: 水杨酸; GABA: γ-氨基丁酸。同列标以不同字母的数值在0.05 水平差异显著。
KT: kinetin; GA3:gibberellin; SA:salicylic acid; GABA: γ-aminobutyric acid. Values followed by a different letter within a column are significantly different at the 0.05 probability level.
2.2.2 种子发芽率 在种子萌发过程中, 盐分浓度和外源生长调节物质对甜高粱种子发芽率的影响均达到极显著水平, 而两者的交互作用对种子萌发的影响仅在萌发初期(12 h)和萌发末期(72 h)达到显著水平(表6)。随着盐分浓度增加, 种子发芽率逐渐降低; 外源生长调节物质可显著提升种子的发芽率, 在各盐分浓度下, 生长调节物质处理的种子的发芽率均高于对照; 其中GABA处理下的发芽率最大, 其次是SA和GA3(图2)。
2.2.3 对种子内渗透调节物质的影响 方差分析表明, 盐分胁迫、外源生长调节物质及两者的交互作用对甜高粱种子内可溶性蛋白和可溶性糖含量的影响均达到极显著水平(< 0.01), 而对丙二醛含量的影响仅在盐分胁迫下达到极显著水平(< 0.01), 外源生长调节物质及与盐分的互作对MDA含量无显著影响(表7)。随着盐分浓度的增加, 甜高粱种子的MDA含量逐渐升高, 与对照相比, 50、100和150 mmol L–1NaCl处理下MDA含量分别平均增加12.4%、11.4%和21.7%。在外源生长调节物质调节下MDA的含量显著降低, 在0、50和150 mmol L–1NaCl处理下, GABA调节下的MDA含量最低; 而100 mmol L–1NaCl溶液处理下GA3调节下的MDA含量最低(表8)。
相似地, 可溶性蛋白和可溶性糖含量随盐分处理浓度的增加而增加。整体来看, 与对照相比, 在各盐分处理下, 可溶性蛋白分别增加了19.3%、45.3%和74.9%, 可溶性糖分别增加了19.1%、52.1%和83.2%。在各盐分浓度处理下, 外源生长调节物质显著提高了种子内可溶性蛋白和可溶性糖的含量, 与对照相比增加的幅度达到1倍以上。在0、50和100 mmol L–1NaCl处理下, SA和GABA调节下可溶性蛋白和可溶性糖的含量最高, 而在150 mmol L–1NaCl溶液处理下, KT和GABA调节下的种子的可溶性蛋白含量最高, 而可溶性糖的含量在GA3调节下的含量最高。
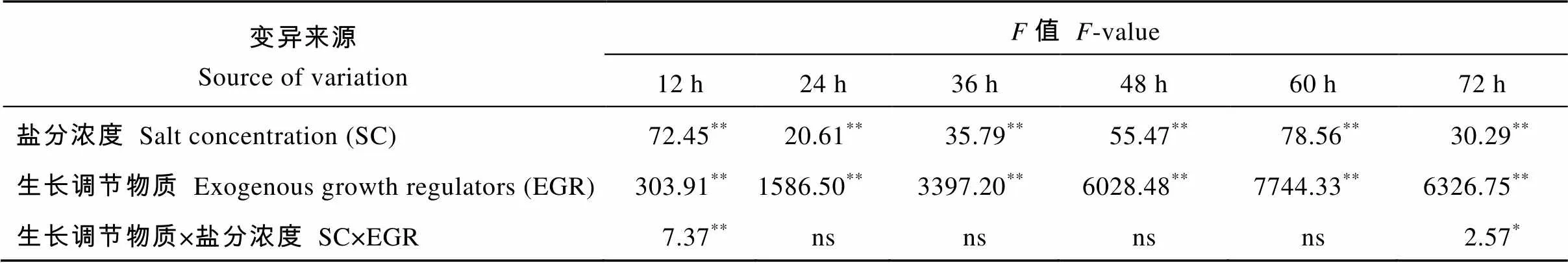
表6 不同生长调节物质对不同盐分浓度下甜高粱发芽率影响的方差分析
ns: 差异不显著;*和**分别表示在0.05和0.01水平差异显著。
ns means no significant;*and**mean significantly different at the 0.05 and 0.01 probability levels, respectively.

图2 外源生长调节物质对不同盐分浓度下甜高粱种子发芽率的影响
KT: 激动素; GA3: 赤霉素; SA: 水杨酸; GABA: γ-氨基丁酸。
KT: kinetin; GA3: gibberellin; SA: salicylic acid; GABA: γ-aminobutyric acid.

表7 不同外源生长调节物质对盐分胁迫下甜高粱种子内渗透调节物质影响的方差分析
ns: 差异不显著;*和**分别表示在0.05和0.01水平差异显著。
ns means no significant;*and**mean significantly different at the 0.05 and 0.01 probability levels, respectively.
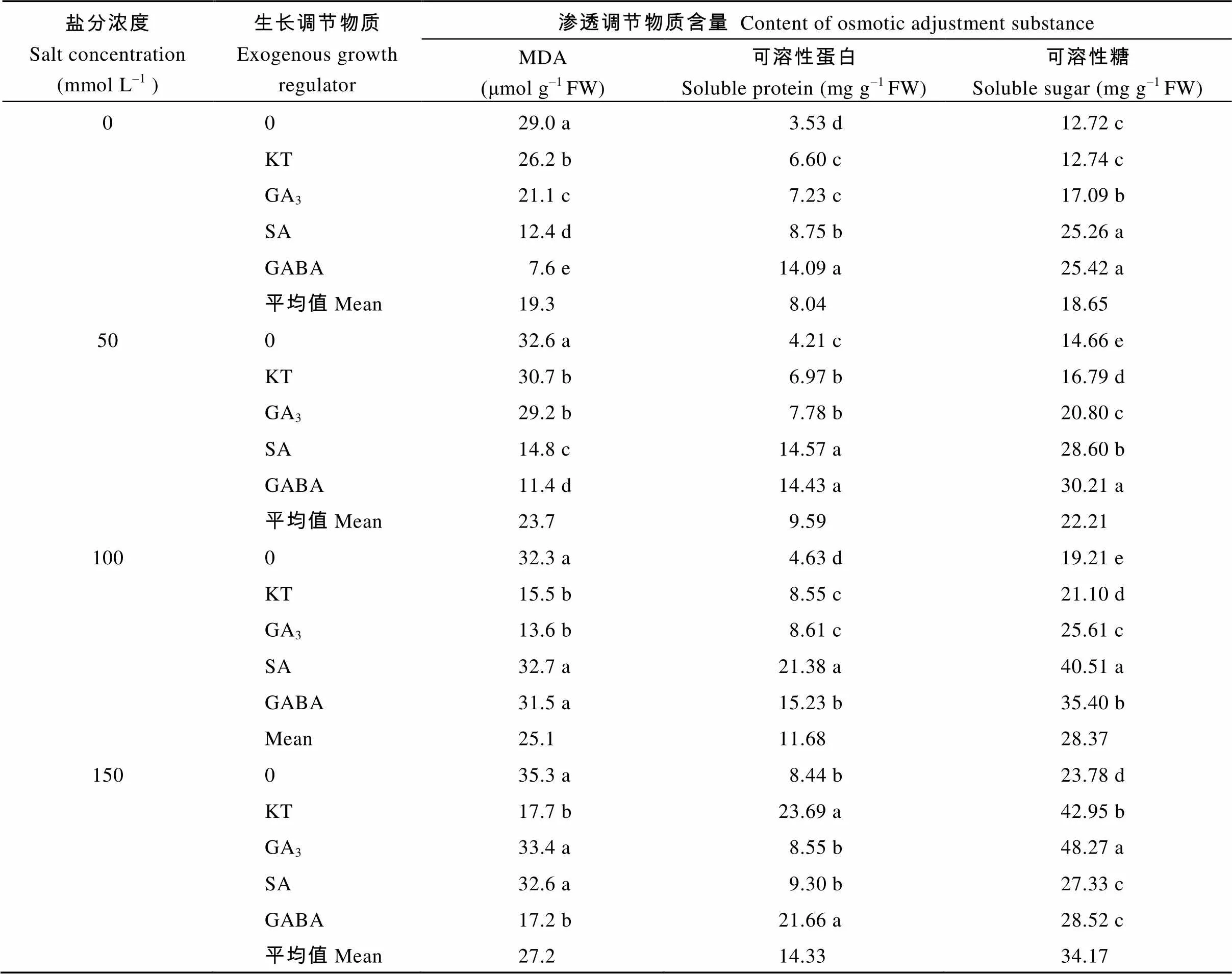
表8 不同外源生长调节物质对盐分胁迫下甜高粱种子渗透调节物质含量的影响
KT: 激动素; GA3: 赤霉素; SA: 水杨酸; GABA: γ-氨基丁酸。同列标以不同字母的数值在0.05水平差异显著。
KT: kinetin; GA3: gibberellin; SA:salicylic acid; GABA: γ-aminobutyric acid. Values followed by a different letter within a column are significantly different at the 0.05 probability level.
2.2.4 对抗氧化酶活性的影响 由表9可知, 随盐分浓度的增加, 3种抗氧化酶的活性先升高后降低, 在50 mmol L–1盐分处理下SOD、POD和CAT的活性均达到最大值。在各盐分处理下, 外源生长调节物质可显著增加3种保护酶的活性。在0和50 mmol L–1盐分处理下, SA和GABA对3种酶活性的增效最佳, SA处理下酶活性分别比对照增加了97.8%和131.6% (SOD)、107.3%和109.4% (POD)、74.2%和75.2% (CAT)(0 mmol L–1NaCl), GABA处理下3种酶活性分别比对照增加了86.6%和96.3% (SOD)、70.7%和60.0% (POD)、43.7%和45.9% (CAT)(50 mmol L–1NaCl)。100 mmol L–1盐分处理下SA作用下的SOD和POD活性最高, 比对照分别增加了304.4%和142.9%, 而GABA作用下CAT的活性最高, 比对照提高了80.9%。而在150 mmol L–1盐分处理下, SOD在KT调节下的活性最高, 比对照增加了365.0%, 而POD和CAT在SA作用下的活性最高, 分别增加了147.1%和50.5%。
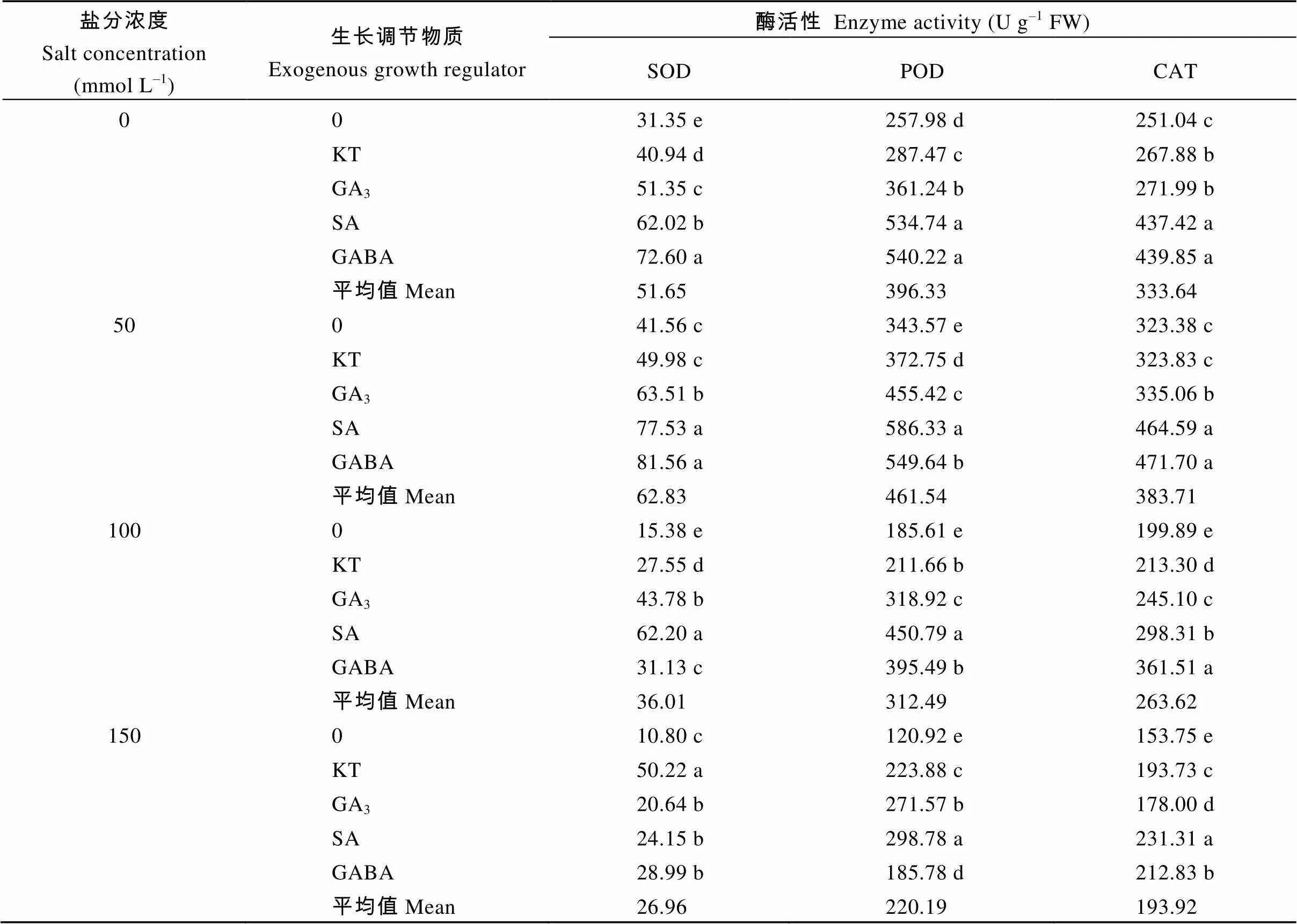
表9 盐分胁迫下不同生长调节物质对甜高粱种子抗氧化酶活性的影响
KT: 激动素; GA3: 赤霉素; SA: 水杨酸; GABA: γ-氨基丁酸。同列标以不同字母的数值在0.05 水平差异显著。
KT: kinetin; GA3: gibberellin; SA:salicylic acid; GABA: γ-aminobutyric acid. Values followed by a different letter within a column are significantly different at the 0.05 probability level.
2.2.5 对离子含量的影响 由表10可知, 随着盐分浓度增大, 甜高粱种子内Na+含量逐渐增加, 而K+、Ca2+和Mg2+含量逐渐降低。与各对照组相比, 50、100和150 mmol L–1NaCl处理下Na+含量分别增加了29.8%、66.7%和104.6%, 而K+含量分别降低了4.1%、4.6%和8.2%, Ca2+含量分别降低了20.0%、26.7%和40.0%, Mg2+含量分别降低了6.0%、8.0%和14.0%。外源生长调节物质可有效缓解盐胁迫的危害, 与对照组相比, 外源生长调节物质可显著降低Na+在种子中的积累、提高种子对K+、Ca2+和Mg2+的吸收。就Na+而言, 各盐分处理下GABA调节下种子对Na+的吸收量最少, 对盐害的缓解效应最佳。0和50 mmol L–1盐分处理下K+和Ca2+在GABA调节下含量最高, 而100和150 mmol L–1盐分处理下GA3调节下种子对K+和Ca2+的吸收量最多。此外, KT可促进Mg2+的吸收, 在各盐分胁迫下KT处理下的Mg2+含量均最高。

表10 盐分胁迫下不同生长调节物质对甜高粱种子离子含量的影响
KT: 激动素; GA3: 赤霉素; SA: 水杨酸; GABA: γ-氨基丁酸。同列标以不同字母的数值在0.05水平差异显著。
KT: kinetin; GA3: gibberellin; SA:salicylic acid; GABA: γ-aminobutyric acid. Values followed by a different letter within a column are significantly different at the 0.05 probability level.
3 讨论
盐分对作物的影响具有双重效应, 一方面表现抑制效应, 对植株的生长造成危害[24-25]; 另一方面使种子发生休眠而躲避盐害[26]。在本研究中, 以盐害的抑制效应为主, 各盐分浓度胁迫下甜高粱种子的萌发指标均显著降低, 这与沙汉景等[24]、周桂生等[25]的研究结果一致。其主要原因是盐分胁迫引发渗透胁迫造成的生理干旱, 盐分胁迫形成的高渗环境导致种子吸水困难, 种子萌发过程中胚乳内淀粉的水解和各种酶的活化缺少必要的水环境, 因此萌发困难、发芽率较低[14]。
高盐分浓度造成的渗透胁迫, 致使细胞膜损伤, 破坏膜的通透性和离子调节功能, 进而增加了相对盐害率[27]。相对盐害率的增加导致种子内离子平衡破坏, 引起胞内Na+的吸收和积聚, 而抑制对其他离子的吸收[12]。在本研究中, 甜高粱种子的相对盐害率随盐分浓度的增加而增大, Na+在种子内的富集, 抑制了种子对K+、Ca2+和Mg2+的吸收, 这种离子平衡的破坏会引发单盐毒害[28], 类似的结果出现在Farooq等[12]和Nimir等[27]的研究中。
此外, 有研究表明, 在盐分胁迫下, 植物体内产生大量的活性氧(ROS), 引发膜脂过氧化反应(产生丙二醛)和脱酰化, 直接破坏核酸和蛋白质等代谢活动[29]。本研究中各盐分浓度处理下, 国甜106的MDA含量均高于国甜2011, 表明国甜2011的耐盐性高于国甜106。丙二醛是反映细胞膜脂过氧化对质膜损伤程度的重要指标, 其含量与质膜损伤程度成正比、与品种抗性成反比[30]。各盐分浓度处理下, SOD、POD、CAT的活性先升高后降低, 在50 mmol L–1盐分处理下活性最高, 这表明低浓度的盐分有利于种子吸水萌发和提高代谢水平, 而高浓度的盐分胁迫则抑制种子萌发代谢, 这在种子的吸水率、吸水速率、发芽率、发芽指数等参数上表现一致, 类似的结果也呈现在周桂生等[25]和Nimir等[27]的研究中, 其机制尚无定论。
外源生长调节物质可有效缓解盐害, 促进甜高粱种子萌发, 其可能的作用机制可归纳为以下4点: (1)外源生长调节物质可诱导种子快速打破休眠, 提高种子活力而处于萌发状态, 加快了对水分的吸收而促进萌发[27]。(2)外源生长调节物质通过提高抗氧化酶的活性, 加速清除产生的活性氧和自由基, 从而缓解盐害。SOD可将(O2–)歧化成H2O2和O2, H2O2再通过CAT和POD的作用被分解为无毒害的H2O和O2, 从而使植株免受伤害[31]。(3)植物可统过非酶系统来缓解盐害, 即通过渗透调节中和或缓解有害物质的损伤[32]。在外源生长调节物质作用下, 渗透调节物质可溶性糖和可溶性蛋白含量显著增加, 渗透调节物质一方面为种子萌发提供能量和物质基础, 另一方面鳌合或中和产生的有害物质, 从而降低对种子的损伤。在亚细胞结构上, 渗透调节物质的作用可保护膜蛋白、修复损伤的DNA、增加蛋白合成速率, 提高种子萌发[33]。(4)外源生长调节物质主要通过调节体内离子平衡来缓解、降低盐害。盐分胁迫下, Na+的过多积累可抑制K+离子及其他离子的吸收, 破坏了体内离子的平衡。一方面过多的Na+可造成单盐毒害和缺素[34-35]; 另一方面Na+可直接进入细胞, 破坏膜的结构和影响细胞质的代谢活动[36]。外源生长调节物质能够促进种子吸水萌发、缓解盐害主要是因为其降低了对Na+的吸收, 维持了体内的离子平衡[37]。不同外源生长调节物质对盐害的缓解效应不同, 总体来看, GA3和GABA对种子吸水萌发时盐害的缓解效应较好, 而KT促进种子对Mg2+的吸收效果较好。这可能与各外源生长调节物质的代谢途径不同有关, 其相关机制有待进一步研究。
4 结论
盐胁迫通过抑制水分吸收、加剧氧化损伤和破坏离子平衡影响甜高粱种子的萌发过程。外源生长调节物质主要通过打破休眠促进吸水、提高抗氧化酶活性、增加渗透调节物质含量和调节离子平衡等途径缓解盐害。其中, GA3和GABA对甜高粱种子盐害的缓解效应较好, KT促进种子对Mg2+的吸收效果较好。表明外源生长调节物质(尤其是GA3和GABA)可用于高粱的耐盐生产, 促进盐碱地中高粱的推广种植及盐碱地开发利用。
[1] 赵可夫, 李法曾, 樊守金, 冯立田. 中国的盐生植物. 植物学报, 1999, 16: 201–207 Zhao K F, Li F Z, Fan S J, Feng L T. Halophytes in China., 1999, 16: 201–207 (in Chinese with English abstract)
[2] 李彬, 王志春, 孙志高, 陈渊, 杨福. 中国盐碱地资源与可持续利用研究. 干旱地区农业研究, 2005, 23(2): 154–158 Li B, Wang Z C, Sun Z G, Chen Y, Yang F. Resources and sustainable resource exploitation of salinized land in China., 2005, 23(2): 154–158 (in Chinese with English abstract)
[3] 孙德智, 韩晓日, 彭靖, 范富. 外源水杨酸对NaCl胁迫下番茄幼苗PSII光化学效率及光能分配利用的影响. 园艺学报, 2016, 43: 1482–1492 Sun D Z, Han X R, Peng J, Fan F. The effect of exogenous salicylic acid on PSII photochemical efficiency and distribution and utilization of luminous energy in tomato seedlings., 2016, 43: 525–537 (in Chinese with English abstract)
[4] 孙健, 赵宏伟, 王敬国. 水稻孕穗期剑叶形态和蒸腾特性与耐盐性的关系. 华北农学报, 2012, 27(6): 84–91 Sun J, Zhao H W, Wang J G. Relationship of sword leaf morphology and transpiration characteristic at booting stage with salt tolerance., 2012, 27(6): 84–91 (in Chinese with English abstract)
[5] 徐明岗, 李菊梅, 李志杰.利用耐盐植物改善盐土区农业环境. 中国土壤与肥料, 2006, (3): 6–10 Xu M G, Li J M, Li Z J. Salt-tolerance plants used for improving agricultural environments in saline soil regions., 2006, (3): 6–10 (in Chinese with English abstract)
[6] 马春红, 李运朝, 刘旭, 及增发, 李晓煜, 何晓棣, 崔四平, 王立安, 贾银锁. 生物质能源研究进展与前景展望. 河北农业科学, 2011, 15(3): 117–121 Ma C H, Li Y C, Liu X, Ji Z F, Li X Y, He X D, Cui S P, Wang L A, Jia Y S. Research progress and prospects on biomass energy., 2011, 15(3): 117–121 (in Chinese with English abscract)
[7] Vasilakoglou I, Dhima K, Karagiannidis N, Gatsis T. Sweet sorghum productivity for biofuels under increased soil salinity and reduced irrigation., 2011, 120: 38–46
[8] 赵立欣, 张艳丽, 沈丰菊. 能源作物甜高粱及其可供应性研究. 可再生能源, 2005, 122(4): 37–40 Zhao L X, Zhang Y L, Shen F J. A study on sweet sorghum and its availability., 2005, 122(4): 37–40 (in Chinese with English abstract)
[9] 邱晓, 张孝峰, 林志城, 张玉贵. 不同含盐量的田间自然土下甜高粱耐盐性初探. 中国农学通报, 2012, 28(3): 66–70Qiu X, Zhang X F, Lin Z C, Zhang Y G. Study of salt tolerance in different varieties of sweet sorghum under different salt soil., 2012, 28(3): 66–70 (in Chinese with English abstract)
[10] 高建明, 夏卜贤, 袁庆华, 罗峰, 韩芸, 桂枝, 裴忠有, 孙守均. 高粱种质材料幼苗期耐盐碱性评价. 应用生态学报, 2012, 23: 1303–1310 Gao J M, Xia B X, Yuan Q H, Luo F, Han Y, Gui Z, Pei Z Y, Sun S J. Salt-alkaline tolerance of sorghum germplasm at seedling stage., 2012, 23: 1303–1310 (in Chinese with English abstract)
[11] 高凤菊. 盐度对不同类型甜高粱品种萌发、生长发育及产量的影响. 山东农业大学硕士学位论文, 山东泰安, 2011Gao F J. Effects of Salinity on Germination, Growth and Development, and Yield of Sweet Sorghum. MS Thesis of Shandong Agricultural University, Tai’an, Shandong, China, 2011 (in Chinese with English abstract)
[12] Farooq M, Gogoi N, Hussain M, Barthakur S, Paul S, Bharadwaj N, Migdadi H M, Alghamdi S S, Siddique K H M. Effects, tolerance mechanisms and management of salt stress in grain legumes., 2017, 118: 199–217
[13] 葛江丽, 石雷, 谷卫彬, 唐宇丹, 张金政, 姜闯道, 任大明. 盐胁迫条件下甜高梁幼苗的光合特性及光系统Ⅱ功能调节. 作物学报, 2007, 33: 1272–1278 Ge J L, Shi L, Gu W B, Tang Y D, Zhang J Z, Jiang C D, Ren D M. Photosynthetic characteristic and the regulation of photosystem II function in salt-stressed sweet sorghum seedlings., 2007, 33: 1272–1278 (in Chinese with English abstract)
[14] 杨帆, 魏晓岑, 张士超, 王宝山.不同甜高粱品种萌发期抗盐和抗旱性比较. 植物生理学报, 2015, 51: 1604–1610 Yang F, Wei X C, Zhang S C, Wang B S. Comparison on salt and drought resistances of different varieties of sorghum bicolor at germination stage., 2015, 51: 1604–1610 (in Chinese with English abstract)
[15] 穆静, 刘小京, 徐进, 毛任钊, 魏巍, 杨莉琳. 氮素对NaCl胁迫下甜高粱种子萌发及芽苗生长与生理的影响. 中国生态农业学报, 2012, 20: 1303–1303 Mu J, Liu X J, Xu J, Mao R Z, Wei W, Yang L L. Effects of nitrogen on sweet sorghum seed germination, seedling growth and physiological traits under NaCl stress., 2012, 20: 1303–1309 (in Chinese with English abstract)
[16] 禤维言, 张涛, 黄永禄, 冯斗, 胡蔚东. 喷施多效唑对甜高粱生长及生理特性的影响. 作物杂志, 2011, (5): 73–76Xuan W Y, Zhang T, Huang Y L, Feng D, Hu W D. Effects of paclobutrazol on development and physiological properties of sweet sorghum., 2011, (5): 73–76 (in Chinese with English abstract)
[17] 陆世渊. 盐分胁迫下甜高粱对水杨酸调节的响应. 扬州大学硕士学位论文, 江苏扬州, 2015 Lu S Y. Responses of Sweet Sorghum to Exogenous Salicylic Acid under Salinity Stress Condition. MS Thesis of Yangzhou University, Yangzhou, Jiangsu, China, 2015 (in Chinese with English abstract)
[18] Ravikovitch R. Effects of brackish irrigation water and fertilizers on millet and corn., 1973, 9: 181–188
[19] Papadopoulos I, Rendig V V. Interactive effects of salinity and nitrogen on growth and yield of tomato plants., 1983, 73(1): 47–57
[20] Awad A S, Edwards D G, Campbell L C. Phosphorus enhancement of salt tolerance of tomato., 1990, 30: 123–128
[21] 李彦, 张英鹏, 孙明, 高弼模. 盐分胁迫对植物的影响及植物耐盐机制研究进展. 中国农学通报, 2008, 24(1): 25–265Li Y, Zhang Y P, Sun M, Gao B M. Research advance in the effects of salt stress on plant and the mechanism of plant resistance., 2008, 24(1): 258–265 (in Chinese with English abstract)
[22] 乔旭, 黄爱军, 褚贵新. 植物对盐分胁迫的响应及其耐盐机制研究进展. 新疆农业科学, 2011, 48: 2089–2094Qiao X, Huang A J, Chu G X. Research progress in the effects of salt stress on plant and the mechanism of plant resistance., 2011, 48: 2089–2094 (in Chinese with English abstract)
[23] Mohammad H I, Javad R, Yahya E, Mohammad P, Ahmad T. Effects of salinity stress on physiological performance of various wheat and barley cultivars., 2014, 37: 520–531
[24] 沙汉景, 胡文成, 贾琰, 王新鹏, 田雪飞, 于美芳, 赵宏伟. 外源水杨酸、脯氨酸和γ-氨基丁酸对盐胁迫下水稻产量的影响. 作物学报, 2017, 43: 1677–1688 Sha H J, Hu W C, Jia Y, Wang X P, Tian X F, Yu M F, Zhao H W. Effect of exogenous salicylic acid, proline and γ-aminobutyric acid on yield of rice under salt stress., 2017, 43: 1677–1688 (in Chinese with English abstract)
[25] 周桂生, 安琳琳, 童晨, 刘贵娟, 夏玉荣, 陆建飞, 封超年. 盐胁迫对甜高粱种子吸水和萌发的影响. 江苏农业科学, 2012, 40(12): 84–86 Zhou G S, An L L, Tong C, Liu G J, Xia Y R, Lu J F, Feng C N. Effects of salt stress on water uptake and germination of sweet sorghum seeds., 2012, 40(12): 84–86 (in Chinese with English abstract)
[26] Papastylianou P, Bakogianni N N, Travlos I, Travlos I, Roussis I. Sensitivity of seed germination to salt stress in black cumin (L.)., 2018, 46: 202–205
[27] Nimir N E, Zhou G S, Guo W S, Ma B L, Lu S Y, Wang Y H. Effect of foliar application of GA3, kinetin, and salicylic acid on ions content, membrane permeability, and photosynthesis under salt stress of sweet sorghum [(L.) Moench]., 2017,97: 525–535
[28] Sudhir P, Murthy S D S. Effects of salt stress on basic processes of photosynthesis.2004, 42: 481–486
[29] Wang J Z. Changes in photosynthetic properties and antioxidative system of pear leaves to boron toxicity., 2011, 10: 19693–19700
[30] 丛靖宇, 张烨, 杨冠宇, 田瑞华, 段开红, 王瑞刚. 不同品种甜高粱幼苗的耐盐能力. 中国农学通报, 2010, 26(19): 128–135 Cong J Y, Zhang Y, Yang G Y, Tian R H, Duan K H, Wang R G. Salt-tolerance in different varieties of sweet sorghum seeding., 2010, 26(19): 128–135 (in Chinese with English abstract)
[31] Gong J, Zhao A, Zhang L, Zhang X. A comparative study on anti-oxidative ability of several desert plants under drought stress., 2004, 24: 1570–1577
[32] Cervilla L M, Blasco B, Ríos J J, Romero L, Ruiz J M. Oxidative stress and antioxidants in tomato () plants subjected to boron toxicity., 2007, 100: 747–756
[33] Varier R A, Outchkourov N S, Graaf P D, Schaik F M A V, Ensing H J L, Wang F W, Higgins J M G, Kops J P L, Timmers H M. A phospho/methyl switch at histone H3 regulates TFIID association with mitotic chromosomes., 2010, 29: 3967–3978
[34] Bonilla I, El-Hamdaoui A, Bolańos L. Boron and calcium increaseseed germination and seedling development under salt stress., 2004, 267: 97–107
[35] Qin J, Dong W Y, He K N, Yu Y, Tan G D, Han L, Dong M, Zhang Y Y, Zhang D, Li A Z, Wang Z L. NaCl salinity-induced changes in water status, ion contents and photosynthetic properties of(Pursh) Nutt. seedlings., 2010, 56: 325–332
[36] Cha-Um S, Kirdmanee C. Effect of glycinebetaine on proline, water use, and photosynthetic efficiencies, and growth of rice seedlings under salt stress., 2010, 34: 517–527
[37] Kaya C, Tuna A L, Okant A M. Effect of foliar applied kinetin and indole acetic acid on maize plants grown under saline conditions., 2010, 34: 529–538
AlleviationEffects of Exogenous Growth Regulators on Seed Germination of Sweet Sorghum under Salt Stress and Its Physiological Basis
ZHU Guang-Long1, **, SONG Cheng-Yu2,**, YU Lin-Lin2, CHEN Xu-Bing2, ZHI Wen-Fang2, LIU Jia-Wei2, JIAO Xiu-Rong1, and ZHOU Gui-Sheng1,2,*
1Institutes of Agricultural Science and Technology Development, Yangzhou University / Joint International Research Laboratory of Agriculture and Agri-Product Safety, Yangzhou 225009, Jiangsu, China;2Co-Innovation Center for Modern Production Technology in Grain Crops of Jiangsu Province, Yangzhou University, Yangzhou 225009, Jiangsu, China
Salinity is a major abiotic constraint affecting crop seed germination and growth. It is vital to exploit and utilize salinity soil by exploring the technologies for promoting seed germination under salt stress. In this experiment, two contrasting sorghum genotypes (Guotian 2011 and Guotian 106) were used to study the salt stress (0, 50, 100, 150, and 200mmol L–1NaCl solution) effect on seed germination, and different concentrations of exogenous growth substances of γ-aminobutyric acid (GABA), gibberellin (GA3), kinetin (KT), and salicylic acid (SA) were used to regulate seed germination on salt-sensitive sorghum genotype Guotian 106. The seed germination was significantly inhibited under salt stress. Water uptake rate, germination potential, germination rate, germination index all decreased under salt stress, but relative salt damage rate and MDA (malondialdehyde) prominently increased in salinity condition. Exogenous growth regulators could effectively relieve the salt stress. With applied the exogenous growth substances, the seed uptake rate, germination rate, contact of soluble sugar and soluble protein, activities of SOD (superoxide dismutase), POD (peroxidase), and CAT (catalase) were all significantly increased, the absorption of K+, Ca2+, and Mg2+enhanced in the same time, but the contents of Na+and MDA decreased. Overall, GA3and GABA performed a better alleviating effect on salt stress, KT showed positive effect on promoting Mg2+absorption. These results suggested that the exogenous growth substances (especially GA3and GABA) can be applicated in sorghum production under salt condition, laying a foundation for improving and utilizing saline soil.
sweet sorghum; salt stress; exogenous growth regulators; seed germination; physiological characteristics
2017-11-21;
2018-08-20;
2018-09-04.
10.3724/SP.J.1006.2018.01713
通信作者(Corresponding author): 周桂生, E-mail: gszhou@yzu.edu.cn**同等贡献(Contributed equally to this work)
朱广龙, E-mail: zhuguang2007@163.com
本研究由江苏省重点研发计划项目(BE2016345), 江苏省农业自主创新资金项目(cx[16]1005-5)和江苏省高校自然科学基金项目(17KJB210008)资助。
This study was supported by the Key Research and Development Program of Jiangsu Province (BE2016345), the Agricultural Independent Innovation Program of Jiangsu Province (cx[16]1005-5), and the Natural Science Foundation of Jiangsu Higher Education Institutions (17KJB210008).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180903.0917.004.html
