灯盏益肾颗粒对糖尿病肾病大鼠肾脏组织病理影响的研究
2018-11-05杜义斌谢铭君段艳蕊易欢
杜义斌,谢铭君,段艳蕊,易欢
1.云南中医学院第一附属医院,云南 昆明 650021;2.云南中医学院,云南 昆明 650500
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病(Diabetes mellitus,DM)重要的微血管并发症,可导致终末期肾脏疾病(End Stage Renal Disease,ESRD),从而致残、致死[1~2]。既往的临床和实验研究发现灯盏益肾颗粒可改善包括DM等多种原发病导致的人或大鼠的慢性肾功能衰竭,减轻慢性肾功能衰竭大鼠肾间质炎性细胞浸润,从而防治肾小球硬化及间质纤维化[3~4]。但对DN尚未开展深入研究。本实验通过观察灯盏益肾颗粒对DN大鼠肾脏组织形态学的影响,探讨灯盏益肾颗粒对DN肾脏病理的影响,为实验药物治疗DN提供依据。
1 材料与方法
1.1 实验动物 雄性成年SD大鼠,健康清洁,体质量(230±20)g,8周龄,共90只。购养于昆明医科大学动物实验学部,许可证号:SCXK(滇)2016-0003。
1.2 实验药物、试剂及主要仪器 药物:灯盏益肾颗粒,天江药业有限公司生产,生产批号:1509341,由灯盏花、黄芪、薏苡仁、杜仲、山药、淫羊藿、苍术、千层纸、党参及生大黄10味药组成。洛汀新(盐酸贝那普利片),北京诺华制药有限公司生产,生产批号:X2209。
试剂:链脲佐菌素(Streptozotocin,STZ),美国Sigma公司;PAS染色试剂盒,京索莱宝科技有限公司;HE染色试剂盒,天津致远化学试剂有限公司;Masson染色试剂盒,北京索莱宝科技有限公司;目测尿蛋白试纸,广州市花都高尔宝生物技术有限公司。
主要仪器:血糖分析仪及试纸,三诺生物传感技术有限股公司;罗氏全自动生化仪Modular P800,德国罗氏公司;VK-X系列激光扫描共聚焦显微镜,中国基恩士公司。
1.3 动物分组及模型建立 将大鼠随机分正常组(A组)、模型组(B组)、盐酸贝那普利组(C组)、灯盏益肾颗粒低剂量组(D组)、灯盏益肾颗粒中剂量组(E组)和灯盏益肾颗粒高剂量组(F组),共6组,每组各15只。6组大鼠,禁食12 h,称重后,将B、C、D、E、F 5组制备DN模型。将柠檬酸2.1 g加入100 mL双蒸水中配成A液,将柠檬酸钠2.94 g加入100 mL双蒸水中配成B液,将A、B液按1∶1混合,pH值为4.2,再使用1%柠檬酸盐缓冲液溶解STZ,按55 mg/kg的剂量一次性左侧腹腔注射[5]。A组用等量生理盐水腹腔注射。各组均给予标准饮食,更换垫料,定期消毒笼具。造模处理后72 h连续测3天空腹血糖,血糖值>16.7 mmol/L为DM模型制备成功。造模后的大鼠喂养1周后测随机血糖>16.7 mmol/L,尿量为A组的1.5倍及以上,考马斯亮蓝法测定24 h尿蛋白(24-hour Urinary Protein,24-hrUP)为A组的1.5倍及以上,则为DN模型制备成功[5~8]。
1.4 实验干预方法 造模成功后,进行药物治疗。A组、B组均予10 mL/kg生理盐水灌胃,每天1次;C组予1.05 mg/kg的盐酸贝那普利片;D组、E组、F组予灯盏益肾颗粒,分别按1.89 g/kg、9.45 g/kg、18.9 g/kg给药。C、D、E、F组分别用10 mL/kg生理盐水溶解药物后灌胃,每天1次。各组连续灌胃6周。
1.5 检测方法、指标 造模前、造模后1周测定血糖和24-hrUP,灌胃6周结束前1天,禁食,正常饮水,收集尿液,记录尿量,取4 mL,3 000 r/min,离心15 min,取上清液,-20℃低温保存。实验最后1天,用10%水合氯醛按照4 mL/kg剂量腹腔注射麻醉大鼠,腹主动脉取血,分离血清(3 000 r/min,离心15 min)-20℃低温保存。用罗氏全自动生化仪Modular P800检测24-hrUP、尿素氮(Blood Uria Nitrogen,BUN)、 胱 抑 素 C(CystatinC, CysC)、 肌 酐 (Serum Creatinine,SCr)。取肾脏,去除被膜,用生理盐水灌洗肾脏血管,以除去血液,滤纸干燥,电子天平称重,用10%甲醛液固定,病理制片,HE染色、PAS染色、Masson染色,用Nikon ECLIPSE 50i研究型系统生物显微镜观察组织形态、细胞成分、染色特征以及有无病理变化,再按病变程度及范围,进行评分。
随机取互不重叠的10个视野,观察肾小球/肾小管间质的病变,进行半定量评分,共包括7项具体的项目。计量每个肾小球/肾小管间质病变程度和范围并计分,求其均值确定为肾小球和肾小管间质病变分值。损伤程度分为0~3级,肾小球系膜基质增生按病理损害的病变程度计分为,无增生:0分;相应视野区域增生基质未超过毛细血管腔直径:1分;相应视野区域增生基质对毛细血管袢有一定的压迫和破坏:2分;相应视野区域增生基质对肾小球毛细血管袢有严重的压迫:3分。而肾小球基底膜增厚、肾皮质坏死、肾小管管腔扩张、肾小管上皮细胞空泡样变性、肾小管坏死、组织炎症细胞浸润等按病理损害的病变程度计分为:正常:0分;轻度损害(病变范围<30%):1分;中度损害(病变范围30%~60%):2分;重度损害(病变范围>60%):3分[9]。
1.6 统计学方法 采用SPSS19.0软件进行统计学分析。计量资料以(±s)表示,符合正态分布,造模前后比较采用配对样本t检验,组间比较采用单因素方差分析(先使用Levene检验检测方差齐性,方差齐时用SNK-q法,方差不齐时用Tamhane's T检验);不符合正态分布,则进行秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般状况 A组大鼠双目有神,反应灵敏,活动自如,皮毛光滑、干净,进食、饮水及大小便正常、无特殊气味。实验结束时体质量增加。与A组比较,B组大鼠皮毛枯燥黄染,下腹部、外阴潮湿,精神差,活动少,易激怒,进食量减少,小便量明显增多(尿量为A组的1.5倍以上),体质量减轻。与B组比较,D组、C组、E组和F组逐渐好转,恢复最明显为E组。实验结束时所剩大鼠分别为:A组13只、B组10只、C组11只、D组11只、E组12只和F组12只。
2.2 各组大鼠造模前后空腹血糖和24-hrUP定量结果比较见表 1。与 A组比较,B、C、D、E、F组大鼠血糖和24-hrUP升高,差异有统计学意义(P<0.05);与本组造模前比较,B、C、D、E、F组大鼠造模后的血糖和24-hrUP升高,差异有统计学意义(P<0.05)。
表1 各组大鼠造模前后空腹血糖和24-hrUP定量结果比较(±s)

表1 各组大鼠造模前后空腹血糖和24-hrUP定量结果比较(±s)
与A组比较,①P<0.05;与本组造模前比较,②P<0.05
组别A组B组C组D组E组F组n 血糖(m m o l/L) 2 4-h r U P(m g)1 3 1 0 1 1 1 1 1 2 1 2造模前3.6 4±0.4 0 3.3 7±0.6 0 3.6 1±0.5 0 3.5 9±0.5 0 3.5 3±0.5 6 3.6 3±0.6 9造模后3.8 2±0.2 9 1 7.8 7±2.6 2①②1 9.7 4±5.3 4①②1 8.8 2±2.8 4①②1 8.0 5±0.8 9①②1 7.9 0±0.6 2①②造模前1 3.8 5±0.5 0 1 4.2 2±0.8 8 1 4.0 3±0.8 0 1 3.7 7±0.5 8 1 3.9 4±0.7 8 1 4.0 5±0.6 2造模后1 4.0 7±1.0 9 3 9.0 0±5.3 8①②3 8.4 1±4.5 5①②3 8.7 7±4.8 5①②3 8.8 9±3.9 9①②3 9.4 0±3.8 1①②
2.3 各组大鼠尿微量白蛋白/尿肌肝(ACR) 检测结果比较见表2。与A组比较,B组ACR明显升高(P<0.01);与B组比较,C、D、E、F组ACR明显降低(P<0.05);与C、D组比较,E、F组ACR降低(P<0.05)。
表2 各组大鼠ACR检测结果比较(±s) mg/g
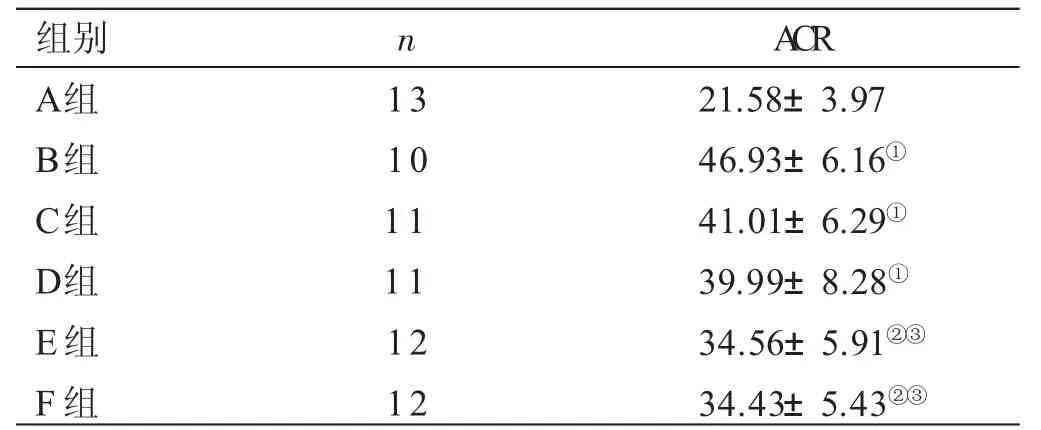
表2 各组大鼠ACR检测结果比较(±s) mg/g
与A组比较,①P<0.01;与B组比较,②P<0.05;与C、D组比较,③P<0.05
组别A组B组C组D组E组F组n 1 3 1 0 1 1 1 1 1 2 1 2 A C R 2 1.5 8±3.9 7 4 6.9 3±6.1 6①4 1.0 1±6.2 9①3 9.9 9±8.2 8①3 4.5 6±5.9 1②③3 4.4 3±5.4 3②③
2.4 各组大鼠肾功能比较 见表3。与A组比较,B组BUN、CysC明显升高(P<0.01);与B组比较,C、D、F组BUN降低(P<0.05),E组BUN降低(P<0.01),C、D组CysC降低(P<0.05),E、F组CysC降低(P<0.01);与C、D组比较,E、F组CysC降低(P<0.05)。各组间SCr两两比较差异无统计学意义(P>0.05)。
表3 各组大鼠肾功能比较(±s)
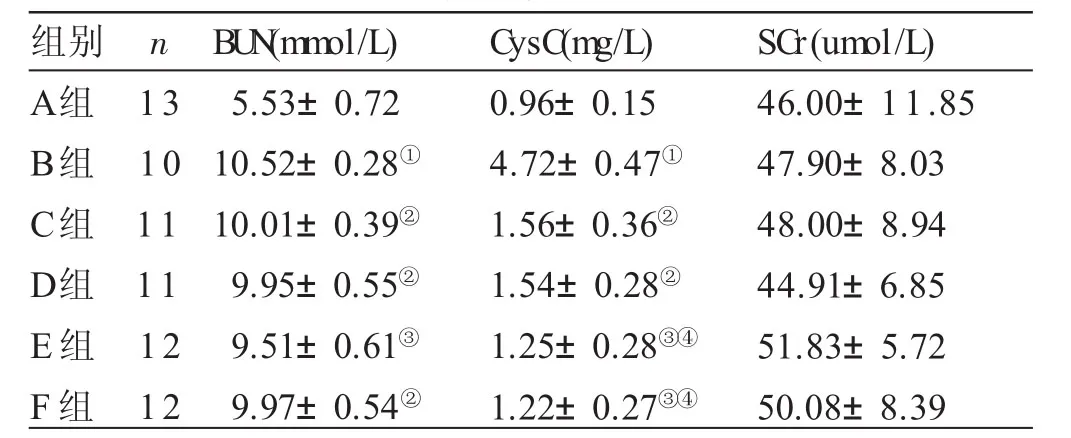
表3 各组大鼠肾功能比较(±s)
与A组比较,①P<0.01;与B组比较,②P<0.05,③P<0.01;与C、D组比较,④P<0.05
组别A组B组C组D组E组F组n 1 3 1 0 1 1 1 1 1 2 1 2 B U N(m m o l/L)5.5 3±0.7 2 1 0.5 2±0.2 8①1 0.0 1±0.3 9②9.9 5±0.5 5②9.5 1±0.6 1③9.9 7±0.5 4②C y s C(m g/L)0.9 6±0.1 5 4.7 2±0.4 7①1.5 6±0.3 6②1.5 4±0.2 8②1.2 5±0.2 8③④1.2 2±0.2 7③④S C r(u m o l/L)4 6.0 0±1 1.8 5 4 7.9 0±8.0 3 4 8.0 0±8.9 4 4 4.9 1±6.8 5 5 1.8 3±5.7 2 5 0.0 8±8.3 9
2.5 各组大鼠肾脏组织形态学改变比较 见图1、图2、图3、图4。A组肾脏基本正常,肾小球囊清晰可见,未见明显的系膜增生或毛细血管变性。管上皮细胞呈立方状,长柱状红染,肾小管管腔不明显。皮质、髓质无炎症。B组肾脏可见明显病变,表现为中重度肾小球增大,系膜基质增生明显,局部可见球囊融合,多个肾小管管腔明显,上皮细胞空泡化,有的肾小管上皮细胞脱落。此外,B组还出现肾脏皮质片状严重炎症,肾小管片状坏死,大量的炎症细胞局部浸润,并侵及肾小球。肾乳头部小灶状炎症,个别肾小管坏死。与A组相比肾脏病变明显,且全部有病变,说明造模成功。C组肾脏可见明显病变,表现为轻重不一的肾小球肾小管病变,重者肾小球增大,系膜基质增生明显,可见球囊融合,多个肾小管管腔明显,上皮细胞空泡化,有的肾小管上皮细胞脱落。轻者肾小球增大,系膜基质轻度增生,少数肾小管上皮细胞空泡化。此外,部分肾脏皮质片状中重炎症,部分轻度炎症。肾小球、肾小管的病变的轻于B组,体现了阳性药物的治疗作用。D、E、F组肾脏均可见与B组相似的病变,肾小球、肾小管的病变轻于B组,体现了灯盏花3个剂量组的治疗作用,肾小球系膜基质聚集、GBM增生、肾小管管腔扩张和肾小管上皮细胞空泡样变性等方面体现剂量效应关系。

图1 HE染色(×200)

图2 HE染色(×400)

图3 PAS染色 (×100)

图4 Masson染色 (×100)
各组大鼠肾脏组织形态学改变评分,见表4。与A组比较,B组肾小球系膜基质增生、肾小球基底膜(GBM)增厚、肾小管管腔扩张、肾小管上皮细胞空泡样变性明显、肾皮质坏死、肾小管坏死、肾组织炎性细胞浸润明显(P<0.01)。与B组比较,C、D、E、F组肾小球系膜基质增生、肾小球基底膜(GBM)增厚、肾小管管腔扩张、肾小管上皮细胞空泡样变性改善(P<0.05);D、E、F组肾皮质坏死、肾小管坏死、肾组织炎性细胞浸润改善(P<0.05)。与C、D组比较,E、F组肾小球系膜基质增生、肾小球基底膜(GBM)增厚、肾小管管腔扩张、肾小管上皮细胞空泡样变性改善(P<0.05)。与C组比较,D、E、F组肾皮质坏死、肾小管坏死、肾组织炎性细胞浸润改善(P<0.05)。
表4 各组大鼠肾脏组织形态学改变评分比较(±s) 分

表4 各组大鼠肾脏组织形态学改变评分比较(±s) 分
与A组比较,①P<0.01;与B组比较,②P<0.05;与C组比较,③P<0.05;与D组比较,④P<0.05
组别A组B组C组D组E组F组n 1 3 1 0 1 1 1 1 1 2 1 2肾小球系膜基质增生0 2.1 0±0.8 8①1.0 0±0.7 8②1.0 9±0.7 0②0.4 2±0.5 2②③④0.3 3±0.4 9②③④肾小球G B M增厚0 2.2 0±0.7 9①1.2 7±0.6 5②1.1 8±0.8 7②0.5 0±0.6 7②③④0.5 8±0.7 9②③④肾小管管腔扩张0 2.4 0±0.7 0①1.7 3±0.7 9②1.6 4±0.6 7②0.6 7±0.8 9②③④0.7 5±0.9 7②③④肾小管上皮细胞空泡样变性0 2.5 0±0.5 3①1.9 1±0.5 4②1.8 2±0.6 0②1.2 5±0.6 2②③④1.1 7±0.7 2②③④肾皮质坏死0 2.7 0±0.4 8①2.5 5±0.6 9 1.6 4±1.1 2②③1.7 5±1.0 6②③2.0 0±0.6 0②③肾小管坏死0 2.6 0±0.5 2①2.4 5±0.6 9 2.0 0±0.6 3②③1.9 2±0.6 7②③1.6 7±0.8 9②③肾组织炎性细胞浸润0 2.7 0±0.4 8①2.6 4±0.5 1 1.5 5±0.8 2②③1.5 8±0.7 9②③1.8 3±0.9 4②③
3 讨论
中医学将DN归于消渴、肾消、肾渴、水肿、关格等范畴。认为禀赋不足、饮食不节、劳欲太过、情志失调,导致肾脏亏虚,气化失司,发为本病。基本病机为本虚标实,虚实夹杂,虚为脾肾虚损。标实为瘀血、痰湿、浊毒。中医学认为脾为人体后天之本及气血生化之源。脾具有散精、升清以及固摄的功能。血糖为水谷精微,当脾气虚,运化失司,表现为胰岛素绝对或相对不足,则水谷精微积聚而生湿化浊,表现为血糖升高,发为DM。脾气虚则固摄无力,失于摄纳则精微流失,小便可出现尿蛋白。消渴病若失治误治,病情逐渐发展可影响到肾脏,导致脾肾两虚。脾虚摄纳无力,肾虚封藏无权,人体精微流失加重,表现为蛋白尿持续增加。DM的病情进展至DN阶段,已是“五脏穷极,必归于肾”,本虚是必然的。所以,DN大都以脾伤及脾虚为起始,后期波及肾脏[10]。笔者根据本病的发病机理,认为本病应补虚泄实,扶正祛邪。具体治法扶正以健脾补肾为主,祛邪以泄浊活血为重。灯盏益肾颗粒是云南省中医医院的院内科研制剂,有健脾补肾,泄浊活血的功效。本方以黄芪、灯盏花为君药,健脾益气、祛湿活血;山药、生大黄、淫羊藿为臣药,益气健脾、固精补肾、泄浊活血;党参、薏苡仁、苍术、杜仲、千层子益气补肾、燥湿泄浊为佐使药。全方扶正不恋邪,攻邪不伤正。
DN是DM常见而难治的微血管并发症。2015年中华医学会内分泌学分会组织内分泌与肾脏病学相关专家参照美国糖尿病学会(ADA)和美国国家肾脏基金会(NKF)制定了中国成人DN临床诊断的专家共识,共识指出DN典型的肾脏形态学改变包括:肾小球基底膜增生变厚、肾小球系膜基质增宽、肾小球局灶或全球硬化、基底膜足细胞丢失、肾小管萎缩及细胞凋亡增加、肾间质炎性浸润、肾间质纤维化、管周毛细血管稀疏、出入球小动脉壁玻璃样变[11~12]。DM引起肾小球形态学改变是DN的主要病理改变,早期表现为基底膜增厚和系膜基质增宽,晚期则演变为肾小球全球硬化。研究发现,慢性持续血糖增高除可以累及全肾,除肾小球各结构损害外,还包括肾间质(肾小管间质、肾脏血管)病变[13]。肾小管病变可在肾小球病变之前,之后或同时发生,早期表现为肾小管基底膜的增厚,晚期发生肾小管萎缩和间质的纤维化。
对DN早期肾功能损伤的检测受到广泛关注,CysC是一种半胱氨酸蛋白酶抑制剂,存在于各种组织的有核细胞和体液中,是一种低分子量,碱性非糖化蛋白质,能被肾小球滤过而不被重吸收,可以反映肾小球滤过率的高低,发现肾脏功能早期波动[14]。临床上SCr和BUN被广泛用于检测肾功能,但在肾小球滤过率尚未出现明显下降时两者并不会发生异常,只是随着病情进展到一定程度,SCr和BUN才会升高[15]。
肾素-血管紧张素-醛固酮系统(Renin Angiotensin Aldosterone System,RAAS)活性增强是DN重要的发病机制,可引起一系列病理改变,故抑制RAAS可延缓肾脏形态学改变,从而保护肾脏。血管紧张素转化酶抑制剂/血管紧张素受体拮抗剂(ACEI/ARB)类药物是RAAS抑制剂。循证医学研究已证明,应用ACEI/ARB类药物可以延缓DN的进展[12,16]。实验研究也发现,ACEI类药物和AT1拮抗剂可能是通过对血管紧张素Ⅱ而抑制肾内内皮素(ET)的生成,进而降低肾内转化生长因子TGF-β1的表达,起到抑制肾脏肥大及ECM过度生成的作用,从而延缓DN的发生发展[12,16~20]。ACEI类药物可通过减低肾小球内“三高”现象、减少细胞外基质形成、抑制基底膜增厚和细胞外基质的积聚,从而延缓肾小球纤维化。本试验结果也证实盐酸贝那普利可以抑制肾小球系膜基质增生,减轻GBM增厚,减轻肾小管管腔的扩张和肾小管上皮细胞的空泡样变性。
本实验结果提示,不同剂量灯盏益肾颗粒均可减轻DM对肾脏组织的病理损伤,主要表现为减缓肾小球系膜基质增生和GBM增厚,减轻肾小管管腔扩张和肾小管上皮细胞空泡样变性。随着药物剂量的增加上述治疗效应有增强的趋势;实验结果还发现灯盏益肾颗粒有减轻肾皮质坏死、肾小管坏死、肾组织炎性细胞浸润的作用,但这些治疗作用与药物剂量无相关性。灯盏益肾颗粒的上述治疗作用通过抑制糖尿病肾病的肾小球和肾小管病理损伤延缓了糖尿病肾病的自然进程,对肾功能和肾脏蛋白排泄量产生有益的影响,这种影响和已知的RAAS抑制剂盐酸贝那普利对糖尿病肾病的保护作用的研究结果有相似的效应。
综上,灯盏益肾颗粒可改善DN大鼠的基本状况,减轻肾功能损伤、减轻肾脏组织形态学病变。主要表现在抑制BUN和CysC升高,减轻肾小球系膜基质增生、GBM增厚、肾小管管腔扩张和肾小管上皮细胞空泡样变性的同时,减轻肾皮质坏死、肾小管坏死、肾组织炎性细胞浸润。盐酸贝那普利也有类似的效应。灯盏益肾颗粒是通过抑制RAAS发挥治疗作用还是其它机制,有待进一步研究。
