NOD2通过调控细胞外基质活性及炎性因子水平介导心肌梗死后心室重构
2018-11-02李香刘文俊曲春晓易凡
李香 刘文俊 曲春晓 易凡
250012 济南,山东大学医学院(李香、易凡); 250013 济南,山东省胸科医院药剂科(刘文俊、曲春晓)
炎症反应是心肌梗死(myocardial infarction,MI)发生、发展的重要机制。虽然MI的发病机制复杂,但临床试验和动物研究发现,内源性免疫系统激活诱导的炎症反应是MI的主要病理生理过程[1-2]。固有免疫系统通过模式识别受体(PRRs)识别病原相关分子模式(PAMPs)和损伤相关分子模式(DAMPs),诱导多种炎性介质和生长因子的释放,促使炎性细胞募集、血管生成、成纤维细胞增殖,导致疤痕形成和梗死愈合[3-4]。N样受体(NLRs)是模式识别受体家族中主要的受体,在NLRs家族中,共有22个成员,其中最具代表性的是核苷酸结合寡聚化结构域2(nucleotide-binding oligomerization domain containing 2,NOD2)。研究发现,NOD2基因的变异与克罗恩病(Crohn,s disease,CD)和Blau综合征(Blau syndrome,BS)有关[5]。大量研究发现,NOD2与动脉粥样硬化、老年痴呆和糖尿病等多种疾病的发病机制有关[6-9]。尽管Shigeoka等[10]第一次提出NOD2在肾缺血再灌注损伤中的作用,但到目前为止,未见NOD2在MI发病机制方面的相关报道。因此,本文探讨NOD2在永久结扎冠状动脉左前降支造成MI模型中的作用和相关机制。
1 材料与方法
1.1 实验动物
8~10周龄的雄性C57BL/6野生小鼠、NOD2基因敲除小鼠各40只,体重25~30 g,随机分为四组:野生/假手术组(WT/Sham组)和NOD2基因敲除/假手术组(NOD2-/-/Sham组)各15只,野生/心肌梗死组(WT/MI组)和NOD2基因敲除/心肌梗死组(NOD2-/-/MI组)各25只。通过永久结扎冠状动脉左前降支制造心肌梗死模型,假手术组仅穿线不结扎。
1.2 超声心动图
小鼠经1.5%异氟烷吸入麻醉后用Philips 7500小动物超声系统进行经胸超声心动图检查,探头采样频率为12 MHz。图像由M型、二维、脉冲波(PW)多普勒和声学密度获得。
1.3 炎性因子检测
采用酶联免疫吸附法(ELISA)测定心肌组织中的细胞趋化因子和细胞因子。
1.4 RNA提取和RT-PCR
Trizol法抽提心肌总RNA,real-time RT-PCR检测假手术、梗死区心肌、非梗死区心肌NOD2的mRNA水平。NOD2 的上游引物是5’-CCTGGTACGTGCCCAAAGTAG-3’,下游引物是5’-GCCAAGTAGAAAGCGCAAA-3’。
1.5 免疫印迹分析
采用免疫印迹法测定NOD2、MMP-9在心肌组织中的表达。NOD2抗体购自美国Protein Tech Group,MMP-9抗体购自美国Abcam。
1.6 免疫组化法
采用免疫组化法检测心肌组织梗死区域NOD2、CD68、α-SMA的表达。
1.7 明胶酶谱法
采用明胶酶谱法测定MMP-9的活性。
1.8 统计学方法
2 结果
2.1 NOD2在MI区域表达显著提高
在MI的0、3、7、14和28 d分别收集梗死区和非梗死区的心肌组织,通过qPCR检测NOD2 mRNA表达。如图1A,与WT/Sham组相比,WT/MI组非梗死区和梗死区NOD2 mRNA表达水平明显升高(均为P<0.05),其中梗死区NOD2的mRNA表达变化水平最高,且呈时效性变化,在MI第7天达到顶峰,28 d后回落,但与WT/Sham组比较仍有显著性差异(均为P<0.05)。取MI 28 d的梗死组织测NOD2蛋白浓度,与WT/Sham组相比,WT/MI组的NOD2浓度显著升高(图1B);免疫组化结果也证实MI 28 d后,NOD2表达仍增强(P<0.05)(图2)。
2.2 NOD2缺失能减弱MI后心脏功能失常和心肌重构的发生
在MI 28 d后通过超声心动图评价心脏功能。与WT/Sham组相比,WT/MI组EF、FS显著降低(均为P<0.05);而NOD2-/-/MI组EF、FS减弱程度降低。同时,MI后左室舒张末期内径、左室收缩末期内径及左室舒张末期容积增大(均为P<0.05),表明左室肥大;WT/MI组MI后左室舒张末期室间隔厚度和左室收缩末期室间隔厚度降低(均为P<0.05),表明左室壁变薄。而NOD2-/-/MI组左室肥大和室壁变薄现象减轻,心室重构现象减弱(表1)。
同时,Tunel染色显示MI 28 d梗死区心肌细胞凋亡较假手术组增加,但NOD2-/-/MI组细胞凋亡明显降低(P<0.05)(图3)。Masson染色提示,NOD2-/-/MI 组心肌纤维化程度远低于WT/MI组(P<0.05)(图4)。
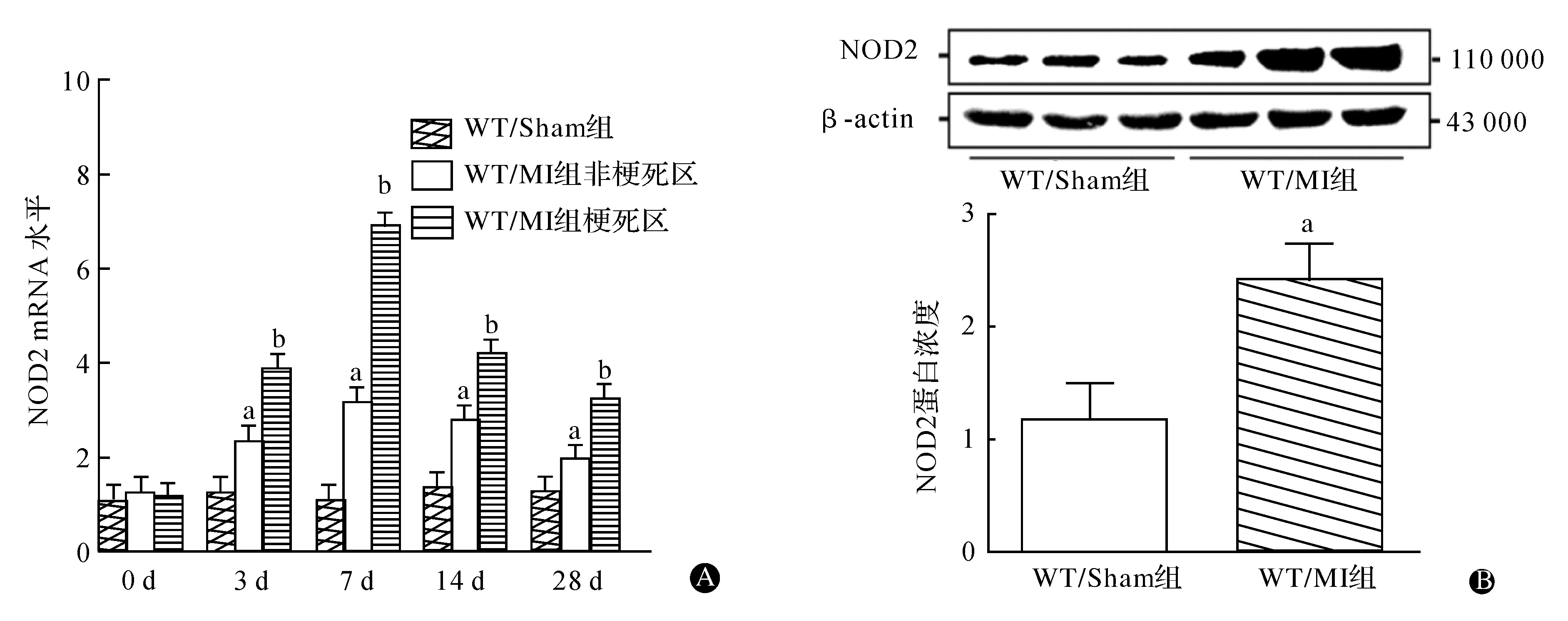
与WT/Sham组相比,aP<0.05 ;与WT/MI组非梗死区相比,bP<0.05图1 NOD2在梗死区和非梗死区心肌组织中的mRNA水平(A)和蛋白表达水平(B)

项目WT/Sham组(15只)NOD2-/-/Sham组(15只)WT/MI组(25只)NOD2-/-/MI组(25只)LVIDd(mm)2.79±0.572.82±0.383.56±0.40a3.23±0.47aIVSd(mm)0.71±0.100.75±0.110.43±0.17a0.58±0.19abIVSs(mm)0.97±0.071.01±0.120.65±0.12a0.77±0.17abLVPWd(mm)0.84±0.170.93±0.260.80±0.320.89±0.11LVPWs(mm)1.08±0.221.11±0.291. 05±0.381.14±0.13LVVd(μl)32.97±5.2230.39±6.7265.87±5.32a51.22±7.12abLVVs(μl)10.95±3.6312.04±2.6727.65±7.51a26.64±5.91aFS(%)34.92±5.6133.89±4.2925.11±3.97a28.22±2.90aEF(%)66.37±4.7765.22±6.1341.02±5.17a49.06±6.22ab
注:LVIDd: 舒张期左室内径; LVIDs: 收缩期左室内径; IVSd: 舒张期室间隔厚度; IVSs: 收缩期室间隔厚度; LVPWd: 舒张期左室后壁厚度; LVPWs: 收缩期左室后壁厚度; LVVd: 左室舒张末期体积; LVVs, 左室收缩末期体积; FS: 缩短分数; EF: 射血分数。与WT/Sham组相比,aP<0.05 ;与WT/MI组相比,bP<0.05

图2 NOD2在梗死区心肌组织中的蛋白表达

图3 Tunel染色表明NOD2缺失保护缺血诱导的细胞凋亡

图4 Masson染色显示NOD2缺失降低纤维化水平
2.3 NOD2缺失能降低MI炎性因子水平、炎性细胞浸润和MMP-9活性
MI初期,大量心肌细胞死亡引发了急性炎症反应,进而引起化学趋化因子和细胞因子的激活。MI后,IL-1β、TNF-α、TGF-β和MCP-1等炎性因子水平显著升高(均为P<0.05),而NOD2缺失降低了这些炎性因子的水平(图5A)。小鼠MI后MMP-9的蛋白和活性升高,NOD2缺失后减弱了MI导致的MMP-9蛋白和活性水平的提高(均为P<0.05)(图5B)。

与WT/Sham组相比,aP<0.05 ;与WT/MI组相比,bP<0.05图5 不同组别心肌组织的炎性因子水平(A)和MMP-9蛋白表达水平(B)
α-SMA是心肌成纤维细胞的特征标志物。α-SMA在心肌非梗死区域表达较少,而在梗死区域大量分布;NOD2缺失后α-SMA在梗死区域的分布减弱。因此,MI引起的炎性细胞浸润(CD68)在NOD2-/-鼠中显著降低(P<0.05)(图6)。

图6 WT及NOD2-/-心肌梗死区CD68和α-SMA染色
3 讨论
本研究发现NOD2在梗死的心肌组织中表达上调,NOD2缺失能显著减弱MI导致的心室重构。进一步研究表明,NOD2通过调控MMP-9的表达和活性以及炎性因子水平介导MI后左室重构。
内源性免疫系统在炎症疾病的发病中起重要作用。最近的研究发现内源性免疫应答和心血管疾病之间的关系。TLRs的激活参与心血管疾病的发生和发展,包括动脉粥样硬化、败血症和充血性心力衰竭引起的心功能不全等。此外,NLRs在心血管疾病中也起重要的作用。NLR家族目前包含22个成员,分为两大类,一类包含NOD1和NOD2等胞浆受体,介导MAPK和NF-κB信号通路;另一类包括NLRP1和NLRP3等胞内受体,介导炎症体复合物的组装,激活caspase-1、IL-1β和IL-18等炎性因子。NLRP3炎症体不但参与动脉粥样硬化,被胆固醇结晶激活,还介导心肌缺血再灌注损伤。研究证实,NOD1配体诱导特定部位的血管炎症,调节心肌纤维化和心肌细胞凋亡[11]。Liu等[12]研究证明,NOD2通过调节心肌细胞凋亡和炎症过程参与心肌缺血再灌注损伤。然而,关于NOD2在MI的作用仍不清楚。本研究发现,通过降低炎症水平及MMP-9表达和活性,NOD2在心梗组织中表达上调,NOD2-/-/MI组比WT/MI组心功能改善明显、心室重构减弱、心肌纤维化程度降低和心肌细胞凋亡减少。
MMP-9是心脏重构的一个潜在的生物标志物[13]。动物MI模型中,MMP-9表达显著增加,并与炎症、细胞外基质降解和心脏功能不全等有关。临床试验也证实MMP-9和心室重构及死亡率之间的关系,因此MMP-9是诊断和(或)治疗MI心室重构和充血性心力衰竭的生物标志物之一。本研究中,我们发现NOD2能增加MI模型MMP-9蛋白表达和活性。TLRs可介导MMPs的作用,例如MMP-9介导中性粒白细胞迁移到气道、应答流感病毒诱导的TLR信号[14];TLR4介导的信号诱导MMP-9依赖的B细胞表面CD23的断裂[15]。但较少研究报道NOD2介导MMPs方面的作用。我们发现,在MI老鼠心肌组织中,MMP-9蛋白表达和活性显著增强,而NOD2缺失后这种变化减弱。
NOD2缺失能降低MI导致的炎症反应。MI初期,大量心肌细胞死亡引发了急性炎症反应,激活化学趋化因子和细胞因子、趋化肥大细胞、中性粒细胞和单核细胞等炎性细胞到梗死组织,吸引巨噬细胞浸润,促进炎症反应。本研究中,MI后小鼠的巨噬细胞浸润和IL-1β、TNF-α、TGF-β、MCP-1的表达均显著增加,而NOD2缺失能显著降低MI诱导的炎性因子表达及巨噬细胞浸润。此外,肥大细胞可诱导成纤维细胞转分化为肌成纤维细胞,肌成纤维细胞具有编码胶原的基因且生成胶原能力较成纤维细胞显著提高。本研究发现,肌成纤维细胞在心肌梗死组织中大量表达,而NOD2-/-/MI组肌成纤维细胞的表达有所减少。
总之,本研究证实NOD2通过炎症和MMP-9活性,参与心肌损伤信号转导。NOD2在多个水平上介导的信号通路可成为治疗心血管疾病的药理学靶点。
利益冲突:无
