秸秆生物炭施用对玉米根际和非根际土壤微生物群落结构的影响
2018-11-01程扬刘子丹沈启斌杨小莹肖晓月张太平
程扬,刘子丹,沈启斌,杨小莹,肖晓月,张太平*
1. 华南理工大学环境与能源学院,广东 广州 510006;2. 淡江大学水资源及环境工程学系,台湾 25137
据农业部统计,中国每年秸秆产量约9×108t(陈玉华等,2018),如何有效利用好秸秆等农业废弃物是诸多研究者较为关注的问题。生物炭是生物质在缺氧条件下热解形成的富碳产物(Shen et al.,2016),具有比表面积大、孔隙结构发达、芳香化程度高、呈碱性、高C/N比(Li et al.,2016)等特点。将生物炭施用于农田土壤中能增强土壤肥力,调节土壤理化性质(Qian et al.,2013;Xu et al.,2014),同时还能改变土壤微生态,提高土壤生产力,固定土壤中的碳(Lee et al.,2010;Singh et al.,2012)并减缓温室气体排放(Zhang et al.,2016;Meyer et al.,2012;Xu et al.,2016)。因此,农作物秸秆炭化还田是一种秸秆资源化有效利用的新思路。
微生物群落是农田土壤生态系统中不可或缺的部分,在农田土壤生态系统循环中扮演着至关重要的作用。生物炭施用于土壤后,通过直接或间接的作用影响微生物代谢(姚玲丹等,2015),改变土壤中微生物群落组成及微生物多样性,进而对植物生长等产生影响。因此,研究生物炭对土壤微生物群落结构以及土壤微生态的影响吸引了较多国内外学者的关注。李明等(2015)研究发现,秸秆生物炭的添加会促进红壤性水稻土微生物的活动,增加了革兰氏阴性细菌、革兰氏阳性细菌、放线菌和真菌的生物量。Dai et al.(2016)认为生物炭会对酸性稻田土壤微生物群落结构产生生物刺激,且对根际土壤微生物群落结构的影响大于对非根际土壤微生物群落结构的影响。韩光明等(2012)将生物炭施加到种植菠菜(Spinacia oleracea L.)的农田里也得到相似的结论。目前,关于生物炭与微生物群落相互作用的机制还没有统一的说法,主要有:(1)生物炭的多孔结构为微生物提供适宜的庇护场所(Quilliam et al.,2013;Abit et al.,2012);(2)为土壤微生物提供营养成分;(3)生物炭中含有的某些抑制成分会抑制微生物细胞活性;(4)通过改变土壤物理、化学环境(如酸碱度、土壤肥力等)来影响土壤微生物群落组成和结构;(5)影响细胞间信号传递过程(Kołtowski et al.,2017)等。Masiello et al.(2013)认为生物炭施入到土壤中后,影响细胞间信号传递的基因表达,而且实验发现700 ℃制备的生物炭对细胞间信号传递的抑制作用比同质量300 ℃制备的生物炭的抑制作用高 10倍以上。Jaiswal et al.(2017)利用16S rRNA高通量测序技术探究生物炭对土壤微生物群落结构的影响时发现施加生物炭可以显著增加微生物多样性和功能多样性,引起微生物活动和碳源利用的总体转变。
目前,大部分相关研究都是从农田土壤取土后进行盆栽试验,直接进行实际田间试验的较少,而且大部分研究仅关注了生物炭施用对土壤微生物群落的影响,关于生物炭施用对农田土壤微生物群落功能的影响研究较少。本研究通过直接在田间进行试验,应用 16S rDNA高通量测序技术以及PICRUSt功能预测技术探究生物炭施用对玉米根际土壤及非根际土壤微生物群落结构和功能的影响,为生物炭农业化实际应用提供参考。
1 材料与方法
1.1 生物炭制备
实验所用生物炭购买自江苏华丰农业生物工程有限公司,原料为玉米秸秆,热解温度约600 ℃。使用多参数水质分析仪(DZS-708-A,上海雷磁)测定生物炭 pH(1:10,m:V),用 CHNS-O元素分析仪(Vario EL cube,德国Elementar)测定生物炭的C、H、N、S含量,通过差减法计算O的质量分数。使用电感耦合等离子体质谱仪(Agilent 7900,美国)测定生物炭中重金属质量分数。
生物炭主要性质:pH 8.05,C质量分数为21.11%,H 0.824%,N 0.65%,S 0.089%,O 77.327%,O/C 3.663,H/C 0.039,(O+N)/C 3.694,Pb 24.9 mg·kg-1,Zn 115.6 mg·kg-1,Mn 108.4 mg·kg-1,Cu 67.8 mg·kg-1,Fe 187.4 mg·kg-1。
1.2 供试土壤性质
供试土壤采自广东省惠州市博罗县某生态试验基地(北纬 23.238994°,东经 113.986145°),土壤为冲积土。根据《土壤农化分析》(鲍士旦,2008)中所述方法测定土壤含水率、pH、有机质、全氮、有效磷及速效钾等(测3次取平均值)。
土壤基本理化性质:含水率15.09%,pH 4.93,有机质质量分数 32.60 g·kg-1,全氮 41.90 g·kg-1,有效磷 125.45 mg·kg-1,速效钾 287.75 mg·kg-1。
1.3 试验设计及样品采集
玉米地生物炭试验采用随机区组设计,每处理组设置3个重复。每垅长50 m,宽1.6 m,垅间距0.3 m,株距 0.30 m,每穴 1株。试验设置 C(0 t·hm-2)、B1(5 t·hm-2)、B2(10 t·hm-2)3 个生物炭添加量梯度,在玉米施基肥后7 d将生物炭施加到田间。施加生物炭后7 d、14 d、21 d分别采集玉米根际土壤(抖根法)和两株玉米之间的非根际土壤(五点取样法),分别以 rC.1~rC.3、rB1.1~rB1.3、rB2.1~rB2.3 代表 C(0 t·hm-2)、B1(5 t·hm-2)、B2(10 t·hm-2)3个生物炭处理后第7天、14天、21天的根际土壤样品,以 C1~C3、B1.1~B1.3、B2.1~B2.3代表3个生物炭处理后第7天、14天、21天的非根际土壤样品。挑除土壤中的动物残体、植物残根、石块等杂志后,将一部分土壤样品(约30 g)保存于放有冰袋的保温箱中,带回实验室后立即存于-80 ℃冰箱中,供微生物分析用,另一部分土壤样品储存于4 ℃冰箱中备用。
1.4 实验方法
14.1 土壤样品细菌16S rDNA扩增
分别取根际土壤和非根际土壤样品,利用DNA提取试剂盒提取样品中的总 DNA。进行基因组DNA抽提后,利用 ω=1%的琼脂糖凝胶电泳检测DNA的完整性、纯度和浓度。以宏基因组DNA为模板,根据测序区域细菌V4区域的选择,使用带barcodearcode arcode的特异引物(515F-806R)进行 PCR 扩增。扩增体系(50 μL)如下:2x Premix Taq 25 μL;Primer-F(10 mmol·L-1)1 μL;Primer-R(10 mmol·L-1)1 μL;DNA(20 ng·mL-1)3 μL;Naclease-free water 20 μL。每个样本进行3个重复,并将同一样本的 PCR产物进行混合,PCR仪:BioRad S1000(Bio-Rad Laboratory,CA)。扩增结束后,用ω=1%的琼脂糖凝胶电泳检测PCR产物的片段长度和浓度,利用GeneTools Analysis Software(Version 4.03.05.0,SynGene)对PCR产物进行浓度对比后,按照等质量原则计算各样品所需体积,将PCR产物进行混合。使用 EZNA Gel Extraction Kit(Omega,USA)凝胶回收试剂盒回收 PCR混合产物,TE缓冲液洗脱回收目标DNA片段。
1.4.2 建库及测序
按照 NEBNext®Ultra™ DNA Library Prep Kit for Illumina®(New England Biolabs,USA)标准流程进行建库操作,使用Illumina Hiseq 2500平台对构建的扩增子文库进行PE 250测序。
1.4.3 数据分析
运用R软件包进行OTU各个分类等级相对丰度的统计及物种相对丰度热图的绘制;运用USEARCH软件进行样本间和物种的聚类分析;KRONA软件对单个样本的物种注释结果进行可视化;运用GraPhlAn软件得到基于GraPhlAn的单个样本的OTU注释圈图;运用Qiimme软件包中的Alpha_diversity.py脚本进行 Alpha多样性指数分析;运用Qiimme 2和Ggplot 2软件包进行PCoA分析并绘图;运用PICRUSt软件对微生物群落结构功能进行预测分析;运用R软件包进行热图绘制;运用SPSS 22.0进行统计分析。
2 结果与讨论
2.1 土壤微生物OTUs及Alpha多样性分析
表1所示为玉米根际土壤及非根际土壤微生物OTUs数量及Alpha多样性指数。由表可知,相比于空白组,施加生物炭后,玉米非根际土壤样品测得的OTUs数量随时间推移逐渐增加,说明其物种多样性增大。生物炭施加量为5 t·hm-2(B1)处理组对微生物群落多样性的增加效果更明显,施加生物炭后21 d样品中OTUs数相比于7 d时增加了174.56%,高于施加量为10 t·hm-2处理组(B2)的增长率(31.25%),说明生物炭施加量是导致土壤微生物群落发生改变的一个重要因素,该结果与Dempster et al.(2012)的研究结果一致。生物炭的施入影响土壤的物理化学性能,如土壤酸碱度、有机质含量、全氮、硝态氮、铵态氮、C/N比、速效磷、速效钾以及土壤湿度等,提高土壤的营养成分(Chathurika et al.,2016;盖霞普等,2016),从而使得微生物群落多样性发生变化。
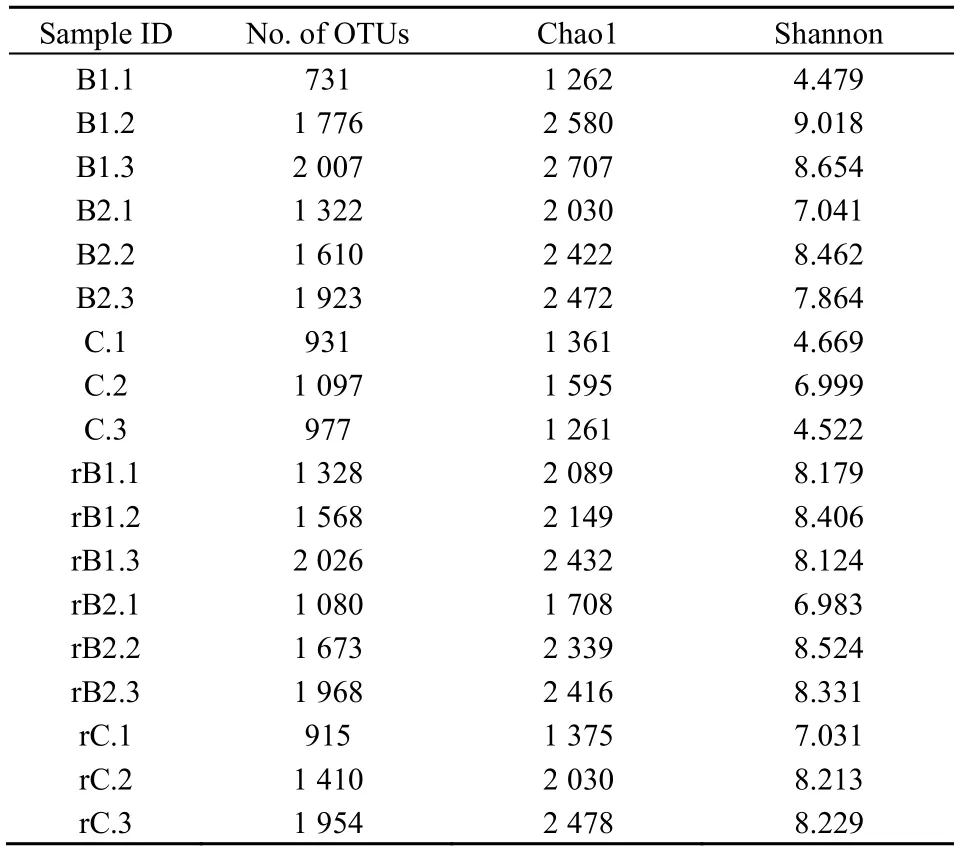
表1 土壤微生物OTU数量及Alpha多样性指数Table 1 The number of OTUs and Alpha diversity index of soil microbial
就玉米根际土壤而言,生物炭的施加对其微生物群落多样性无显著影响(P=0.177),施加生物炭21 d后空白组(rC)和实验组(rB1、rB2)的OTUs数量均在2000左右。此结果与Dai et al.(2016)的研究结果存在一些差异,可能与生物炭类型以及根际土壤中存在的植物根系分泌物对微生物群落的影响远大于生物炭对其产生的影响等有关。时间对根际土壤微生物群落多样性变化存在显著影响(P=0.002),3个处理组的OTUs数量均随时间推移而显著增大。
Alpha多样性是对单个样品中物种多样性的分析,包含物种组成的丰富度和均匀度两个因素,本研究中采用Chao1指数和Shannon指数进行分析。
Chao1指数可反映样品中群落的丰富度,即群落中物种的数量。根据表1,对比空白对照组,玉米非根际土壤在施加生物炭后微生物群落丰富度明显增加,且施加量为 5 t·hm-2比施加量为 10 t·hm-2对提高微生物群落丰富度的刺激作用更明显,21 d后生物炭施加量为5 t·hm-2的处理组(B1)chao1指数达到了2707。推测原因可能是:生物炭可以降低土壤酸度(Smebye et al.,2016),且生物炭中含有的营养元素可以被微生物利用,为微生物提供适宜的生存场所等。同时适量的生物炭会刺激微生物代谢,使得微生物群落物种丰富度增加,而生物炭中的某些重金属离子以及活性有机化合物等也会抑制微生物的生命代谢活动(Zhu et al.,2017),当施加量为10 t·hm-2时,生物炭中的金属离子(Pb2+、Cu2+等)等无机盐对微生物代谢的抑制作用变得明显,使得微生物群落物种丰富度增加效率受到限制。
Shannon指数可估算样本中微生物多样性,其值越大表示群落多样性越高。根据表 1,施加生物炭后21 d玉米非根际土壤样品Shannon指数分别为8.654、7.864,均高于同时期的空白组(Shannon指数为4.522),说明施加生物炭会促进土壤微生物多样性的增长。从时间上看,往土壤中添加生物炭后,空白组(C)和处理组(B1、B2)的Shannon指数在7~14 d阶段增长较快,14~21 d略有下降,对应的微生物多样性也是先升高后略有降低。就根际土壤而言,施加生物炭 21 d后各处理土壤样品的Shannon指数比较接近,可能与玉米根系分泌物对微生物多样性的影响以及生物炭施加方式(施加到两株玉米之间)有关。
2.2 土壤微生物在门水平的物种相对丰度分布

图1 门水平上根际土壤及非根际土壤物种相对丰度分布Fig. 1 Relative abundance distribution of species in rhizosphere and bulk soils at phylum level
玉米根际土壤与非根际土壤样品在门水平上相对丰度大于1%的古菌和细菌群落组成如图1所示。由图可知,相对丰度大于1%的物种有15种,分别为泉古菌门(Crenarchaeota)、广古菌门(Euryarchaeota)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、绿菌门(Chlorobi)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、OD1、浮霉菌门(Planctomycetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)、[Thermi],这些古菌和细菌构成了研究区玉米土壤中门水平上的微生物群落基本结构。
在玉米非根际土壤及根际土壤中,优势菌群均为变形菌门(Proteobacteria),占比为27.21%~72.00%。变形菌门作为细菌中最大的门类,包括诸如大肠杆菌(T. Escherich 1885)、沙门氏菌(salmonella)等在内的诸多病原菌。根际土壤中变形菌门相对丰度(占21.21%~56.64%)较非根际土壤(占36.08%~72.00%)低,原因是根系分泌物会抑制变形菌门的生长(罗永清等,2012)。施加生物炭21 d后,非根际土壤中变形菌门相对丰度相比于施加生物炭7 d时的相对丰度均有所降低,且两个处理组(B1,B2)变形菌门相对丰度均低于空白对照组(C)。这说明施加生物炭会抑制变形菌门活性,进而降低相关病原菌的相对丰度,利于玉米作物的生长。就根际土壤而言,施加生物炭对变形菌门相对丰度无显著影响(P=0.051),空白对照组(rC)和处理组(B1、B2)土壤样品中变形菌门相对丰度均随时间推移而降低,这可能是由于在玉米根际土壤中,相比于生物炭对微生物的影响,根系分泌物对微生物的影响起主导作用。
酸杆菌是土壤中的一类重要菌群,在土壤中可降解植物残体,参与铁循环、单碳化合物代谢以及光合作用等物质循环和生态环境构建过程(王光华等,2016)。本研究中,施加5 t·hm-2生物炭后玉米根际土壤酸杆菌门(Acidobacteria)相对丰度提高,但施加10 t·hm-2生物炭时酸杆菌门相对丰度降低,这可能与施加生物炭引起的土壤理化性质的改变(Huang et al.,2017),以及生物炭中含有的金属元素对酸杆菌门活性的抑制作用等有关。
2.3 土壤微生物在科水平的物种相对丰度分布

图2 科水平上根际土壤及非根际土壤物种相对丰度分布Fig. 2 Relative abundance distribution of species in rhizosphere and bulk soils at family level
图2所示为科水平上玉米根际土壤及非根际土壤物种相对丰度分布图。由图可知,玉米非根际土壤中以黄单胞菌科(Xanthomonadaceae)为优势种,占整个微生物群落的50%以上。黄单胞菌科隶属于变形菌门。施加生物炭后,非根际土壤黄单胞菌科(Xanthomonadaceae)明显受到抑制,施加21 d后处理组B1和B2的黄单胞菌科相对丰度分别从施加7 d后的57.50%和29.12%降至13.02%和16.68%,均低于空白对照组(55.62%)。该趋势与变形菌门在非根际土壤中的变化趋势一致。
在玉米根际土壤中,黄色单胞菌科相对丰度较低,空白组(rC)和实验组(rB1、rB2)中相对丰度均低于 10%,这可能与根系分泌物抑制致病菌生长等有关(罗永清等,2012)。施加生物炭与否及施加量多少对根际土壤黄色单胞菌科(Xanthomonadaceae)丰度高低的影响不显著(P=0.857),该结果与根际土壤中变形菌相对丰度变化趋势一致。
从图3还可知,施加生物炭后,随时间推移,玉米非根际土壤中的微生物群落中未被定义的微生物相对丰度增加,说明生物炭的施入会更明显地诱导非根际土壤中微生物群落结构发生改变。
2.4 土壤微生物主成分分析
根据样本的 OTU丰度信息计算 Weighted Unifrac和Unweighted Unifrac距离并构建矩阵,据此进行多变量统计学方法主坐标分析(PCoA),评估施加生物炭对玉米根际及非根际土壤微生物群落结构的影响(图3)。
由图3可知,主要成分1(PC1)和主要成分2(PC2)是造成不同样品间差异的最主要特征,贡献率分别为19.26%和15.46%。就玉米非根际土壤而言,施加生物炭可明显改变土壤微生物群落结构,施入生物炭后非根际土壤处理组(B1、B2)与空白组(C)之间在PC2上相距较远,说明施加生物炭后非根际土壤微生物群落结构发生改变。施加生物炭对玉米根际土壤则没有显著的影响,施入生物炭21 d后空白组(rC.3)和处理组(rB1.3、rB2.3)没有显著差异,在PC1和PC2上均相距较近,说明生物炭施加对玉米根际土壤微生物群落影响较弱。PCoA分析结果与上述OTUs聚类、Alpha多样性分析以及门、科水平上物种相对丰度结果一致。
2.5 PICRUSt功能预测分析
PICRUSt是基于KEGG宏基因组预测微生物群落功能的工具(Langille et al.,2013),通过将微生物群落的相对丰度与数据库进行比对,在无法直接观测的情况下推测微生物群落结构的功能信息(Li et al.,2017)。本研究利用PICRUSt程序来探究施加生物炭对玉米根际及非根际土壤微生物群落基因功能的影响。

图3 根际土壤及非根际土壤样品PCoA分析Fig. 3 PCoA analysis of rhizosphere and bulk soils
利用PICRUSt对基于KEGG pathyway(LV3)的基因功能进行预测,共发现6910个预测的功能。图4所示为预测的前30种功能热图,分别是其他功能,丙酮酸代谢,转录因子,ABC转运体,氨基糖和核苷酸糖代谢,转录机器,原核生物中的碳固定途径,精氨酸和脯氨酸代谢,丙氨酸、天门冬氨酸和谷氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,氨酰-tRNA生物合成,甲烷代谢,糖酵解/糖异生,蛋白酶,一般功能预测,嘌呤代谢,氧化磷酸化,嘧啶代谢,核糖体,氨基酸相关的酶,转运因子,其他离子偶联的转运体,未知功能,双组分系统,细菌运动蛋白,分泌系统,DNA修复和重组蛋白,核糖体生物合成,染色体,分子伴侣和折叠催化剂。这些代谢通路隶属于代谢、遗传信息处理、环境信息处理、细胞过程、有机体系、人类疾病等六大类代谢通路(LV1)。
通过PICRUSt基因预测聚类热图,可看出施加生物炭后微生物群落基因功能产生差异。施加生物炭后,玉米非根际土壤微生物群落的丙酮酸代谢、转录因子、ABC转运体等功能作用明显增强,氨基糖和核苷酸糖代谢,转录机器,原核生物中的碳固定途径,精氨酸和脯氨酸代谢,丙氨酸、天门冬氨酸和谷氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,氨酰-tRNA生物合成,甲烷代谢,糖酵解/糖异生等过程的作用也有所增强;而未知功能、双组分系统、细菌运动蛋白、分泌系统、DNA修复和重组蛋白、核糖体生物合成、染色体、分子伴侣和折叠催化剂等过程作用则有所减弱。在玉米根际土壤中,生物炭施用对微生物群落相关通路的影响则不同。
根据预测结果,生物炭的施入影响了玉米土壤微生物群落相关功能基因的丰度进而影响微生物群落的生长代谢、信息传递等过程。
3 结论
(1)生物炭施加到土壤后,在门和科水平上对玉米非根际土壤微生物群落的相对丰度及多样性产生了较大的影响,非根际土壤微生物群落的相对丰度和多样性明显提升,而根际土壤微生物群落的相对丰度及多样性变化较小。空白对照组和施炭实验组玉米根际土壤微生物群落多样性及相对丰度均随着时间推移而增加。

图4 PICRUSt基因预测聚类热图Fig. 4 Heatmap of PICRUSt gene predict function
(2)玉米根际土壤中,施加5 t·hm-2生物炭后酸杆菌门(Acidobacteria)相对丰度升高,当施加10 t·hm-2生物炭时酸杆菌门(Acidobacteria)相对丰度降低。施加生物炭后,玉米非根际土壤中黄色单胞菌科(Xanthomonadaceae)相对丰度明显降低,同时部分未被定义微生物相对丰度明显增加;在生物炭施加对根际土壤微生物的影响不显著(P=0.857)。
(3)PICRUSt预测结果表明,生物炭施入玉米土壤后会影响土壤微生物群落的基础生命功能及与周围环境的信息传递过程等,进而影响微生物在土壤环境中的生态效应。
