超声辅助酶解高温豆粕制备抗氧化产物
2018-10-31于冬蕾李婷婷吴海波朱秀清石彦国万兆祥刘春成
于冬蕾,李婷婷,吴海波,2,朱秀清,2,*,石彦国*,万兆祥,刘春成
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.国家大豆工程技术研究中心,黑龙江 哈尔滨 150028;3.哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
高温豆粕是由大豆浸油后,经高温脱溶而得的副产品,它含有大豆中全部蛋白质,具有很高的开发和利用价值[1]。但由于炼油工艺中高温脱溶步骤造成蛋白质的热变性,导致其蛋白质溶解性较差。目前高温豆粕主要用作饲料,少量用于发酵食品,未能发挥其潜在的应用价值,造成了资源的浪费[2]。
酶法处理是改善豆粕营养品质的有效方法,其作用条件温和,不但能够破坏或消除豆粕中的抗营养因子,且可将豆粕中蛋白质等降解为小分子物质,在提升生物效价的同时赋予更多的生物活性[3-4]。已有研究表明,酶解高温豆粕获得的小分子活性物质具有较高的抗氧化活性[5]。近年来,生物小分子抗氧化物质以其分子质量小、易吸收、活性高等特点越来越受到人们的青睐,成为研究的热点之一[6-9]。
超声波在介质中传播时,会产生热效应、机械效应和空化效应,引起介质的一些特性变化[10]。因为上述特性,在促进活性成分的提取[11]、辅助酶解[12]和促进蛋白乳化[13]等方面起到显著的效果,其中最为显著的是在超声辅助酶解方面,可以缩短酶解时间、提高酶解效率、增加产物得率[14]。目前已经将超声辅助酶解法应用到大豆[15]、麦麸[16]、红豆[17]、核桃[18]以及花生[19]等植物中以制备得到抗氧化活性物质。
抗氧化性在食品中主要用于阻止或延缓油脂的自动氧化,还可防止食品在贮藏中因氧化而使营养损坏、褐变、褪色等[20]。因此,开发和利用天然食物源抗氧化物质成为目前科研领域的研究热点。近年来,相继有学者以豆粕为原料,采用发酵[21]以及酶解[22]等方法制备抗氧化物质。赵亚琦等[23]研究发现豆粕固态发酵-酶解产物能够保持肉丸色泽,有效地抑制脂肪氧化及蛋白氧化,并减缓pH值上升,在4 ℃冷藏条件下可保质至13 d,显著延长货架期。目前对超声辅助酶解制备高温豆粕抗氧化产物的研究较少。
本研究以高温豆粕为原料,采用超声辅助酶解法制备抗氧化产物,在单因素试验基础上,通过响应面分析法对超声辅助酶解工艺进行优化,然后对酶解产物依次进行乙醇沉淀、DEAE-Cellulose52离子交换层析、SephadxeG-25凝胶色谱层析分离纯化以及抗氧化性研究,不仅提高了酶解速率,还使其产物抗氧化性增强,为高温豆粕抗氧化产物的实际生产及其在食品领域的开发与应用提供理论依据。
1 材料与方法
1.1 材料与试剂
过8 0 目筛后的高温豆粕粉(其含蛋白质(39.24±0.67)%、水分(8.69±0.77)%、灰分(6.23±0.21)%、粗脂肪(1.24±0.39)%) 黑龙江省哈高科大豆食品有限公司;纤维素酶(酶活力(368 250±72.2) U/g) 上海国药集团化学试剂有限公司;碱性蛋白酶(酶活力(15 963±25.1)U/g) 丹麦诺维信公司;中性蛋白酶(酶活力(95 248±63.8) U/g)上海金穗生物科技有限公司;酸性蛋白酶(酶活力(15 966±22.1) U/g) 天津奥博星生物公司;其他试剂均为国产分析纯。
1.2 仪器与设备
JY92-11N超声细胞粉碎机 宁波新芝生物科技有限公司;TU-1901双光束紫外分光光度计 北京普析通用仪器有限责任公司;GL-21M高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;蛋白质纯化仪 美国GE公司。
1.3 方法
1.3.1 高温豆粕抗氧化产物的制备及其得率计算
制备步骤:高温豆粕→超声波同步纤维素酶酶解→蛋白酶水解→酶灭活→调节pH值至4.5→离心取上清液→乙醇沉淀(加入体积分数75%乙醇溶液,4 ℃保存,静置48 h)→沉淀复溶→过滤→浓缩→DEAE Cellulose 52离子交换层析→Sephadex G-25凝胶色谱层析→冷冻干燥→高温豆粕抗氧化产物。按公式(1)计算抗氧化产物的提取得率:
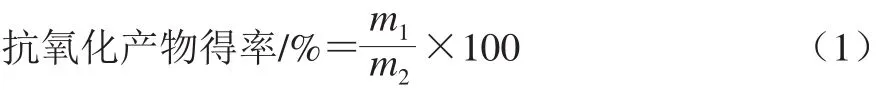
式中:m1为抗氧化产物质量/g;m2为高温豆粕总质量/g。
1.3.2 可溶性多肽含量测定
取1 mL上清液加入1 mL 10%三氯乙酸溶液,室温放置30 min后5 000×g离心10 min,利用快速Lowry法蛋白含量测定试剂盒测定多肽含量,以牛血清白蛋白为标准品。标准曲线方程为y=0.380 3x+0.101 9(R2=0.996 9)。可溶性多肽质量分数按公式(2)计算:
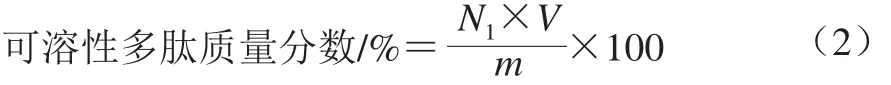
式中:N1为上清液蛋白质量浓度/(mg/mL);V为加入蒸馏水体积/mL;m为高温豆粕总质量/g。
1.3.3 可溶性多糖含量的测定
采用苯酚-硫酸法[24],以葡萄糖为标准品。标准曲线为y=13.293x+0.045 5(R2=0.991 8),线性范围为0.020~0.100 mg/mL。可溶性多糖质量分数按公式(3)计算:
式中:N2为上清液多糖质量浓度/(mg/mL);V为加入蒸馏水体积/mL;m为高温豆粕总质量/g。
1.3.4 水解度的测定
总氮的测定采用凯氏定氮法[25]。游离氨基氮测定采用甲醛滴定法[26]。水解度按公式(4)计算:

1.3.5 铁离子还原力的测定
使用S0116总抗氧化能力检测试剂盒进行测定。
1.3.6 超氧阴离子自由基清除能力的测定
使用A052抑制与产生超氧阴离子自由基测定试剂盒进行测定。
1.3.7 超声波同步纤维素酶酶解高温豆粕工艺
1.3.7.1 超声波处理
样品制备:准确称取一定质量的高温豆粕溶于100 mL水中,用0.1 mol/L柠檬酸调节溶液pH值为中性,升温加热60 ℃,磁力搅拌2 h。然后用0.5 mol/L HCl调节溶液pH值为4.5,离心(4 000×g,20 min),取上清液用0.5 mol/L NaOH溶液调节pH值为7.2~7.4,对其进行可溶性多肽和可溶性多糖含量的测定。
将高温豆粕充分溶解,用0.1 mol/L柠檬酸溶液调节溶液pH值至4.2,加入已活化的纤维素酶,酶解3 h。用0.5 mol/L HCl溶液调节溶液pH值为4.5,离心(4 000×g,20 min),取上清液用0.5 mol/L NaOH溶液调节pH值为7.2~7.4,对其进行可溶性多肽和可溶性多糖含量的测定。
超声处理顺序:将高温豆粕充分溶解,在超声功率200 W条件下处理10 min(按工作3 s、间歇3 s进行)。然后用0.1 mol/L柠檬酸调节溶液pH值为4.2,加入已活化的纤维素酶,酶解3 h。
充分溶解高温豆粕,用0.1 mol/L柠檬酸调节溶液pH值为4.2,加入已活化的纤维素酶,在超声功率200 W、超声时间10 min条件下进行纤维素酶酶解。用0.5 mol/L HCl溶液调节溶液pH值为4.5,离心(4 000×g,20 min),取上清液用0.5 mol/L NaOH溶液调节pH值为7.2~7.4,对其进行可溶性多肽和可溶性多糖含量测定。
1.3.7.2 超声功率、超声时间对高温豆粕的影响
充分溶解高温豆粕,用0.1 mol/L柠檬酸调节溶液pH值为4.2,加入已活化的纤维素酶并进行超声处理,超声功率分别为100、200、300、400 W;超声时间分别为10、20、30、40 min。超声结束后,用0.5 mol/L HCl溶液调节溶液pH值为4.5,离心(4 000×g,20 min),取上清液用0.5 mol/L NaOH溶液调节pH值为7.2~7.4,然后对其进行可溶性多肽和可溶性多糖含量的测定。
1.3.7.3 纤维素酶酶解工艺单因素试验
调节高温豆粕质量浓度分别为2、4、6、8、10 g/100 mL,用0.1 mol/L柠檬酸调节溶液pH值为4.2,加入已活化的纤维素酶并进行超声处理,超声功率300 W、超声时间20 min。超声结束后,同1.3.7.2节方法处理。
高温豆粕质量浓度为10 g/100 mL,用0.1 mol/L柠檬酸调节溶液pH值为4.2,加入已活化的纤维素酶,纤维素酶添加量分别为300、600、900、1 200、1 500 U/g,并进行超声处理,超声功率300 W、超声时间20 min。超声结束后,同1.3.7.2节方法处理。
高温豆粕质量浓度为10 g/100 mL,0.1 mol/L柠檬酸调节溶液pH值分别为3.5、4.0、4.5、5.0、5.5,加入已活化的纤维素酶600 U/g,并进行超声处理,超声功率300 W、超声时间20 min。超声结束后,同1.3.7.2节方法处理。
1.3.7.4 纤维素酶酶解工艺响应面试验设计
在单因素试验的基础上,采用Box-Behnken 3因素3水平试验设计原理进行响应面优化试验,因素与水平见表1。

表1 纤维素酶酶解工艺Box-Behnken试验设计因素与水平Table 1 Coded levels and corresponding actual levels of independent variables used in Box-Behnken design for cellulose hydrolysis
1.3.8 蛋白酶水解高温豆粕工艺技术优化
1.3.8.1 蛋白酶制剂的选择
经过超声波纤维素酶预处理的高温豆粕,分别加入酸性蛋白酶、中性蛋白酶、碱性蛋白酶,在相同的酶添加量、酶解时间,进行反应,水浴灭活。重复3 次,测定可溶性多肽和可溶性多糖的含量。
1.3.8.2 碱性蛋白酶水解高温豆粕的单因素试验设计
在酶解时间3 h、酶解温度50 ℃、酶解pH 8.0条件下,考察碱性蛋白酶添加量(15 000、30 000、45 000、60 000、75 000 U)对可溶性多糖、可溶性多肽以及水解度的影响。
在碱性蛋白酶添加量60 000 U、酶解时间3 h、酶解温度50 ℃条件下,考察酶解pH值(8.0、8.5、9.0、9.5、10.0)对可溶性多糖、可溶性多肽以及水解度的影响。
在碱性蛋白酶添加量60 000 U、酶解温度50 ℃、酶解pH 9.0条件下,考察酶解时间(2.5、3.0、3.5、4.0、4.5 h)对可溶性多糖、可溶性多肽以及水解度的影响。
在碱性蛋白酶添加量60 000 U、酶解时间3 h、酶解pH 9.0条件下,考察酶解温度(45、50、55、60、65 ℃)对可溶性多糖、可溶性多肽以及水解度的影响。
1.3.8.3 碱性蛋白酶水解高温豆粕的响应面试验优化方案
在单因素试验的基础上,采用Box-Behnken 3因素3水平试验设计原理进行响应面优化试验,因素与水平见表2。
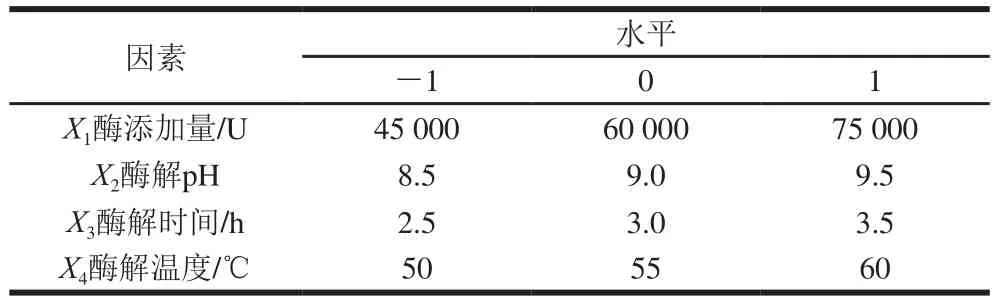
表2 碱性蛋白酶酶解工艺Box-Behnken试验设计因素与水平Table 2 Coded levels and corresponding actual levels of independent variables used in Box-Behnken design for protein hydrolysis
1.3.9 高温豆粕抗氧化产物的分离与纯化
取高温豆粕抗氧化产物粗品若干,用0.01 mol/L Tris-HCl(pH值为7.2)缓冲液溶解,上蛋白质纯化仪,分两步进行抗氧化产物的分离与纯化。首先以DEAE Cellulose 52离子交换树脂为填料,依次用含有0.1、0.25、0.5 mol/L NaCl的0.01 mol/L Tris-HCl(pH 7.2)缓冲液进行梯度洗脱,上样质量浓度为10 mg/mL,上样体积为10 mL,流速为1 mL/min,洗脱液流速为2 mL/min,收集器的装液量为10 mL/管。每一管测定波长208 nm处的多肽吸收,隔管测定波长490 nm处的多糖吸收,收集二者的重合峰,浓缩,透析除盐,冷冻干燥后测定其铁离子还原力和超氧阴离子自由基清除能力。
然后将DEAE-Cellulose52离子交换层析后抗氧化活性较好的产物配成质量浓度为10 mg/mL的溶液,以Sephadex G-25凝胶为填料,用蒸馏水洗脱,上样量为10 mL,洗脱速率为1 mL/min,收集器的装液量为10 mL/管。每一管测定波长208 nm处的多肽吸收,检测波长490 nm处的多糖含量,收集二者重合的峰,冻干后测定其铁离子还原力和超氧阴离子自由基清除能力。
1.4 数据处理
采用Origin 8.0绘图软件、SPSS 11.5分析软件、Microsoft Excel 2013对数据进行处理与分析,数据重复3 次取平均值。
2 结果与分析
2.1 超声波同步纤维素酶处理高温豆粕工艺
2.1.1 超声波处理结果
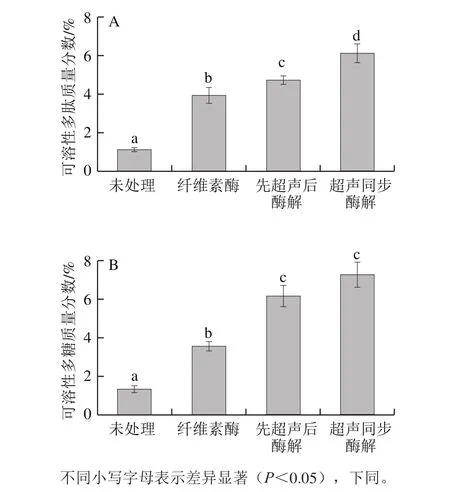
图1 超声波纤维素酶对高温豆粕可溶性多肽(A)、可溶性多糖(B)提取的影响Fig. 1 Effects of ultrasonic-assisted cellulose extraction on the extraction efficiency of soluble polypeptide (A) and polysaccharide (B)from soybean meal
如图1所示,经过超声波同步纤维素酶处理的高温豆粕,其可溶性多肽和可溶性多糖质量分数分别为(6.11±0.49)%和(7.26±0.27)%,显著高于(P<0.05)其他处理方式的可溶性多肽以及多糖含量,这说明超声对于纤维素酶酶解具有一定的促进作用,故选择超声波同步纤维素酶处理工艺进行后续试验。
2.1.2 超声条件对高温豆粕水解效果的影响
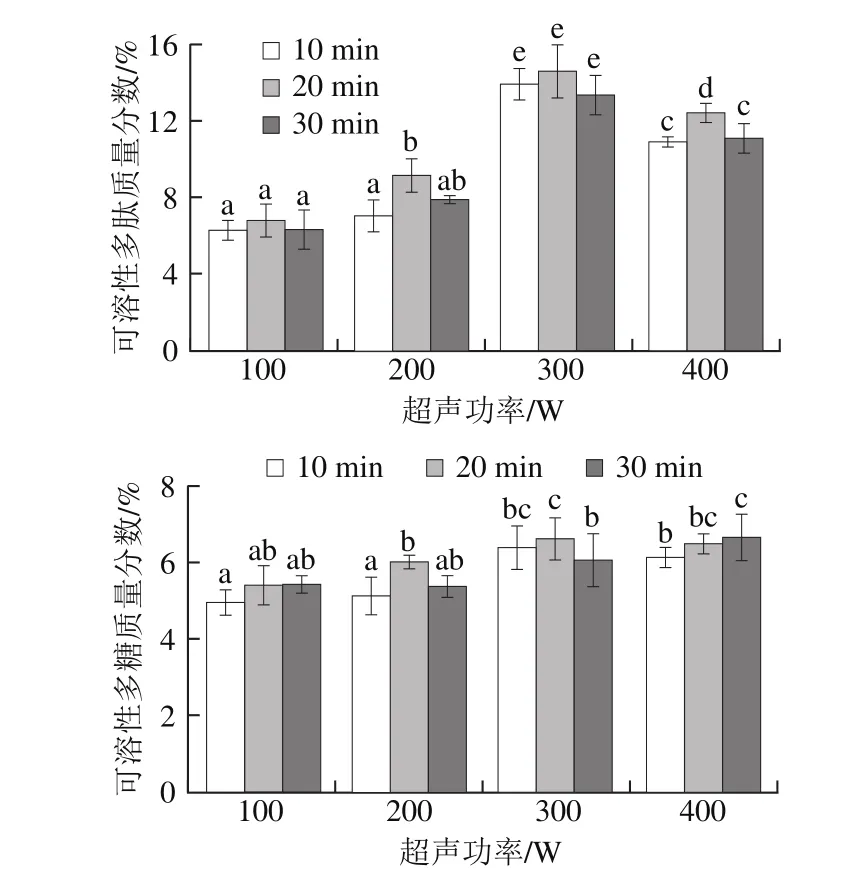
图2 超声功率、超声时间对高温豆粕水解的影响Fig. 2 Effects of ultrasonic power and irradiation time on the extraction efficiency of soluble polysaccharide and polypeptide from soybean meal
如图2所示,在超声功率100~400 W条件下,随着超声功率的增加,高温豆粕可溶性多肽含量和可溶性多糖含量呈现相同趋势,先升高后降低。这说明,在一定的超声功率内,超声波可以有效破坏高温豆粕的细胞壁,加快纤维素酶水解,使大分子纤维素转化为可溶性多糖,同时促进包裹在大分子纤维素里的可溶性物质溶出,使可溶性多糖以及多肽含量增加。但是超声功率过强可能导致细胞及溶液局部温度增加过快,破坏多肽和多糖的结构。此外,较高的超声功率会产生瞬时空化作用,使酶分子结构被破坏,导致酶活力下降[27],也会影响可溶性多肽和可溶性多糖的含量。
超声作用能够缩短反应时间,在超声功率300 W条件下,超声处理20 min的大豆肽含量显著高于(P<0.05)其他处理时间,可溶性多肽质量分数为(14.63±1.56)%,可溶性多糖质量分数为(6.64±0.56)%。在一定的超声时间范围内,处理时间越长,酶催化反应效果越好,超出范围后,可能会使酶催化效果下降,可能更长时间超声波促进了蛋白质变性、聚合的发生。综上所述,选择超声功率300 W、超声时间20 min进行下一步试验。
2.1.3 纤维素酶酶解工艺单因素试验结果
2.1.3.1 底物质量浓度对高温豆粕的影响
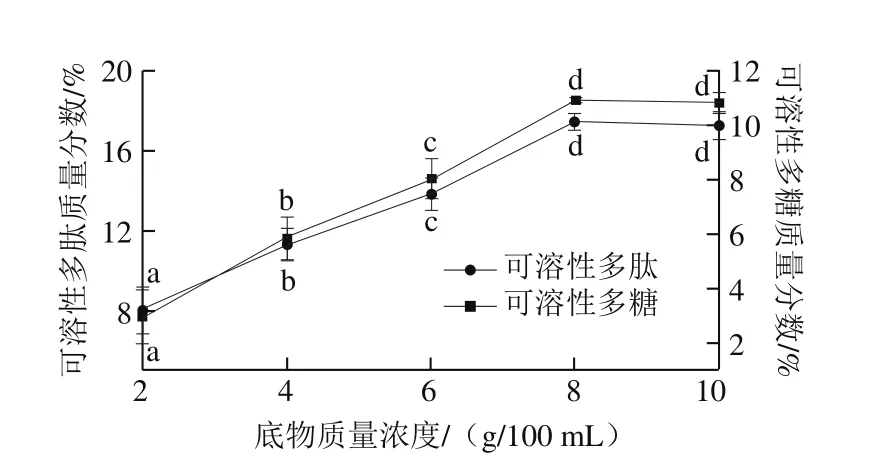
图3 底物质量浓度对高温豆粕水解的影响Fig. 3 Effect of substrate concentration on the extraction efficiency of soluble polysaccharide and polypeptide from soybean meal
如图3所示,随着底物质量浓度的增加,多肽含量及多糖含量呈现先升高到趋于平稳的趋势,当底物质量浓度为8 g/100 mL时,可溶性多肽((17.44±0.42)%)和可溶性多糖((10.92±0.08)%)质量分数为最大值。这是由于在低底物质量浓度情况下,酶解速率降低,酶解效果不佳,但过量则不利于高温豆粕的充分溶解和酶的水解反应进行,造成可溶性多肽和可溶性多糖提取效果上升不明显。因此,较适宜的底物质量浓度确定为8 g/100 mL左右。
2.1.3.2 纤维素酶添加量对高温豆粕的影响
从图4可以看出,随着纤维素酶添加量的增加,高温豆粕可溶性多肽和可溶性多糖质量分数表现为先升后降的趋势,当纤维素酶的添加量为600 U/g时,高温豆粕可溶性多肽和可溶性多糖质量分数最高,分别为(18.44±0.89)%和(10.61±0.32)%,故纤维素酶添加量确定在600 U/g左右最佳。
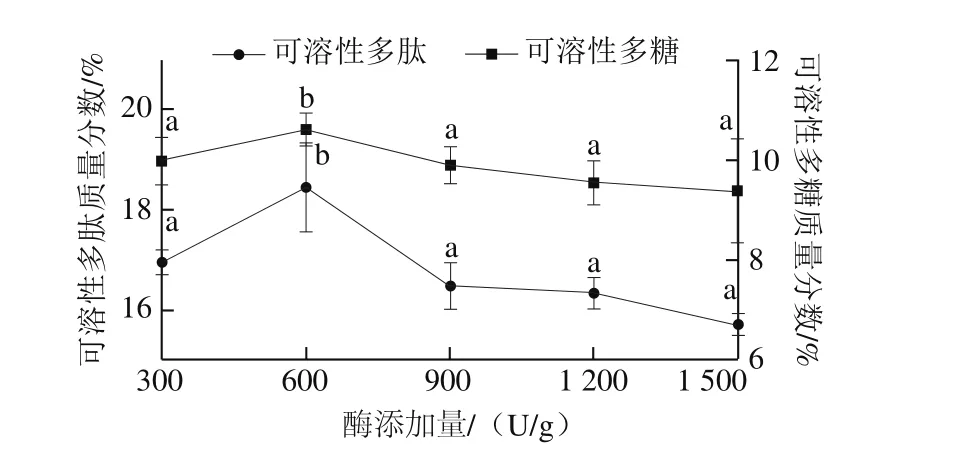
图4 纤维素酶添加量对高温豆粕水解的影响Fig. 4 Effect of cellulase dosage on the extraction efficiency of soluble polysaccharide and polypeptide from soybean meal
2.1.3.3 纤维素酶酶解pH值对高温豆粕的影响
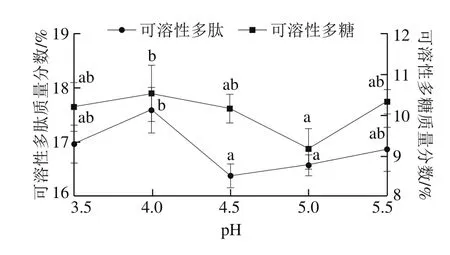
图5 pH值对高温豆粕水解的影响Fig. 5 Effect of hydrolysis pH value on the extraction efficiency of soluble polysaccharide and polypeptide from of soybean meal
如图5所示,当纤维素酶酶解pH值为4.0时,可溶性多肽和可溶性多糖的质量分数分别为(17.59±0.42)%和(10.53±0.69)%,高于其他pH值条件下可溶性多肽和多糖的含量。这可能由于溶液pH值是决定酶催化活性的重要参数之一,一方面过酸过碱可改变酶的空间构象,使酶失活;另一方面,pH值还可以改变反应底物的解离状态,影响其与酶的结合[28]。故酶解pH值确定为4.0左右为宜。
2.1.4 Box-Behnken试验设计结果及响应面试验分析
以可溶性多糖质量分数为响应值,依据Box-Behnken设计因素水平编码值,测定结果见表3。
采用Design-Expert 8.0软件进行回归拟合,去除不显著的因素,得到各试验因素对响应值影响的回归方程为R=10.81+0.17A+0.18B+0.11C-0.055AB-0.077AC+0.035BC-0.42A2-0.37B2-0.27C2。
对模型采用方差分析,由表4可知,一次项A、B、C和二次项A2、B2、C2表现为差异极显著;交互项AB、BC差异不显著;AC为差异显著。模型具有极显著性(P<0.01),因变量与所考察的自变量之间的线性关系显著(R2=0.991 7),模型调整确定系数为0.981 0,该模型拟合程度良好,失拟项(P=0.059 3>0.05)差异不显著,说明所得的回归方程可行度高,可以用于预测纤维素酶酶解高温豆粕工艺参数。
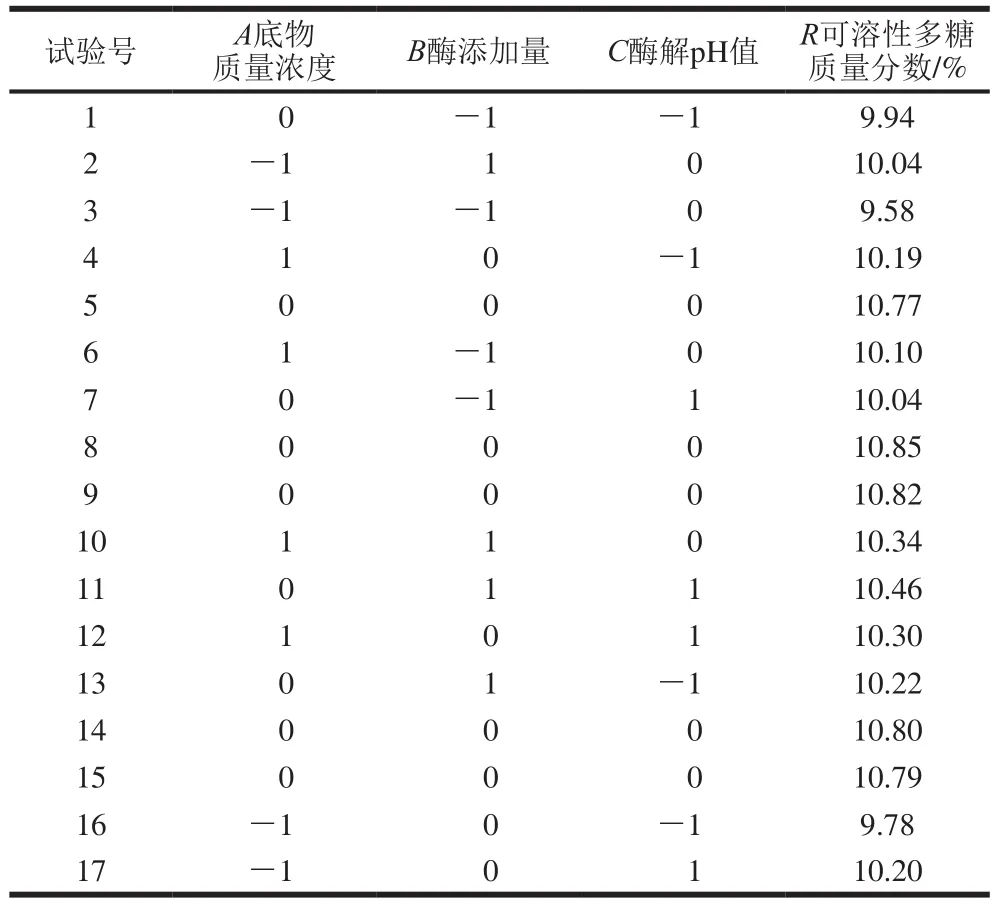
表3 纤维素酶酶解工艺Box-Behnken试验设计方案及结果Table 3 Box-Behnken experimental design and results for optimization of cellulase hydrolysis
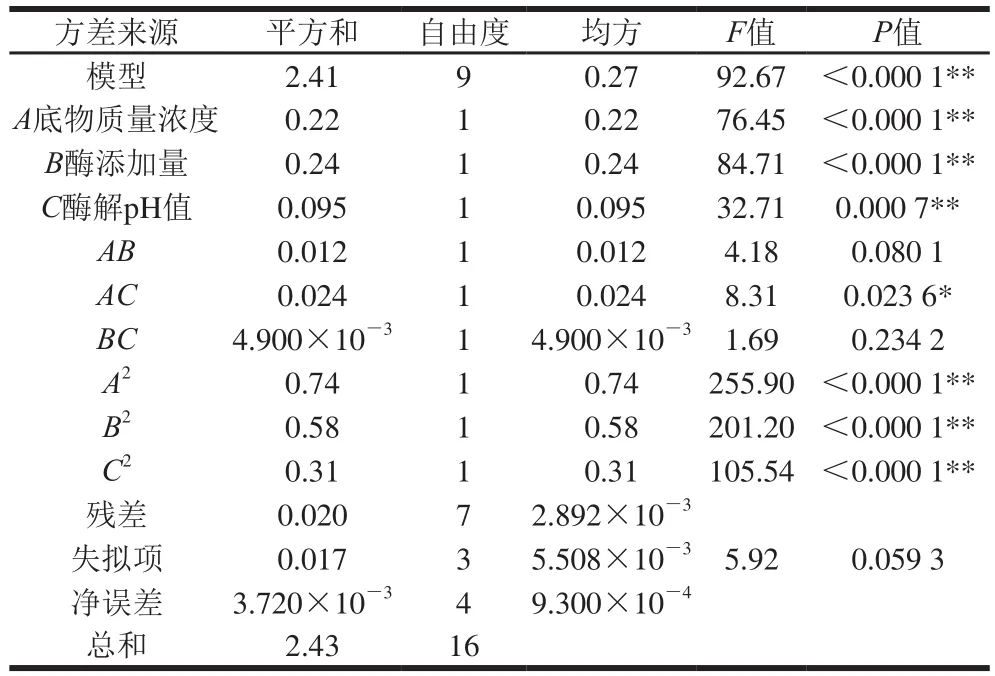
表4 纤维素酶酶解工艺二次回归方程模型方差分析结果Table 4 Analysis of variance for the fi tted quadratic response surface regression model describing cellulase hydrolysis
按照回归方程优化结果,计算得最佳工艺条件为底物质量浓度8.36 g/100 mL、纤维素酶添加量666 U/g、酶解pH值4.1,响应面模型指标值为10.85%。依据最佳工艺,进行验证实验5 次,测出可溶性多糖质量分数的均值为(10.83±0.32)%,实际值与模型值的误差绝对值小于5%,t检验差异不显著(P>0.05),说明可以使用响应面试验优化设计模型参数,作为实际的酶解工艺,并且在最优条件下可溶性多肽质量分数为(18.51±0.36)%。
2.2 蛋白酶水解高温豆粕工艺优化结果
2.2.1 蛋白酶的选择结果
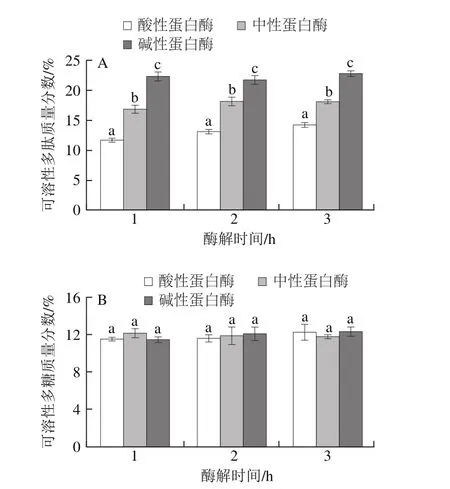
图6 不同酶制剂对高温豆粕可溶性多肽(A)、可溶性多糖(B)提取的影响Fig. 6 Effect of different proteases on the extraction efficiency of soluble polypeptide (A) and polysaccharide (B) from soybean meal
如图6所示,经过超声波-纤维素酶处理后的高温豆粕溶液分别进行3 种蛋白酶处理,相同条件酶添加量和酶解时间,碱性蛋白酶对高温豆粕多肽的影响显著高于(P<0.05)其他2 种酶,碱性蛋白酶在酶解时间1、2、3 h的可溶性多肽质量分数分别为(22.41±80.72)%、(21.76±0.67)%、(22.74±0.53)%,可溶性多糖质量分数分别为(11.458±0.29)%、(12.08±0.71)%、(12.32±0.48)%。这是由于碱性蛋白酶是一种内切型的丝氨酸蛋白酶,一般在芳香族或疏水性氨基酸(如亮氨酸、异亮氨酸、缬氨酸)的羧基发生水解[29-30]。而大豆中7S和11S球蛋白为主要大豆蛋白,碱性氨基酸的含量占大部分,因此更易于被碱性蛋白酶作用,并且水解所产生的断裂位点比其他酶多。综上所述,选取碱性蛋白酶进行下一步试验。
2.2.2 单因素试验结果
2.2.2.1 碱性蛋白酶添加量对高温豆粕的影响
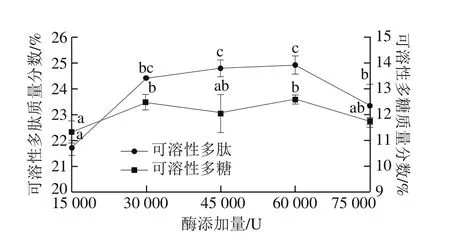
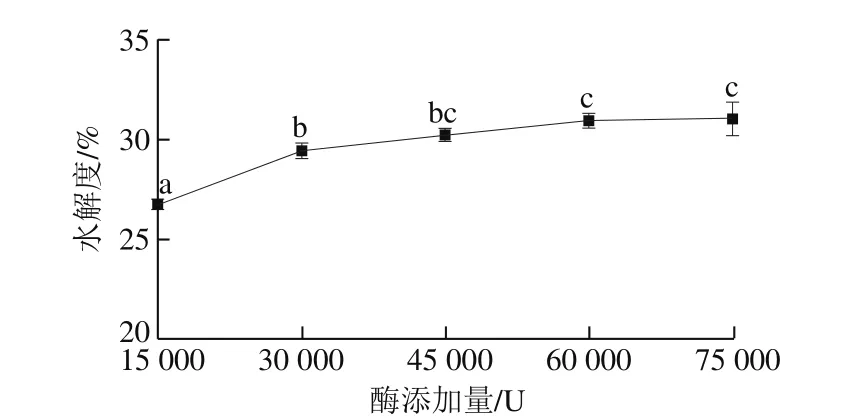
图7 碱性蛋白酶添加量对高温豆粕水解的影响Fig. 7 Effect of protease dosage on the extraction efficiency of soluble polysaccharide and polypeptide from soybean meal
从图7可以看出,随着加酶量的增大,水解度逐渐上升,当蛋白酶添加量为60 000 U时,水解度达到最大,此时高温豆粕的可溶性多肽和可溶性多糖质量分数达到最大值,分别为(24.91±0.37)%和(12.57±0.18)%。这是因为在底物质量浓度一定时,随着碱性蛋白酶添加量增多,使酶与蛋白质分子接触机会增多,高温豆粕中的蛋白质水解越充分,生成的小分子多肽越多,多肽含量和水解度随之上升。但当酶添加量进一步增加时,底物被酶完全饱和,水解度增加缓慢,酶解反应受到抑制。因此,碱性蛋白酶的最适添加量在60 000 U左右。
2.2.2.2 碱性蛋白酶酶解pH值对高温豆粕的影响
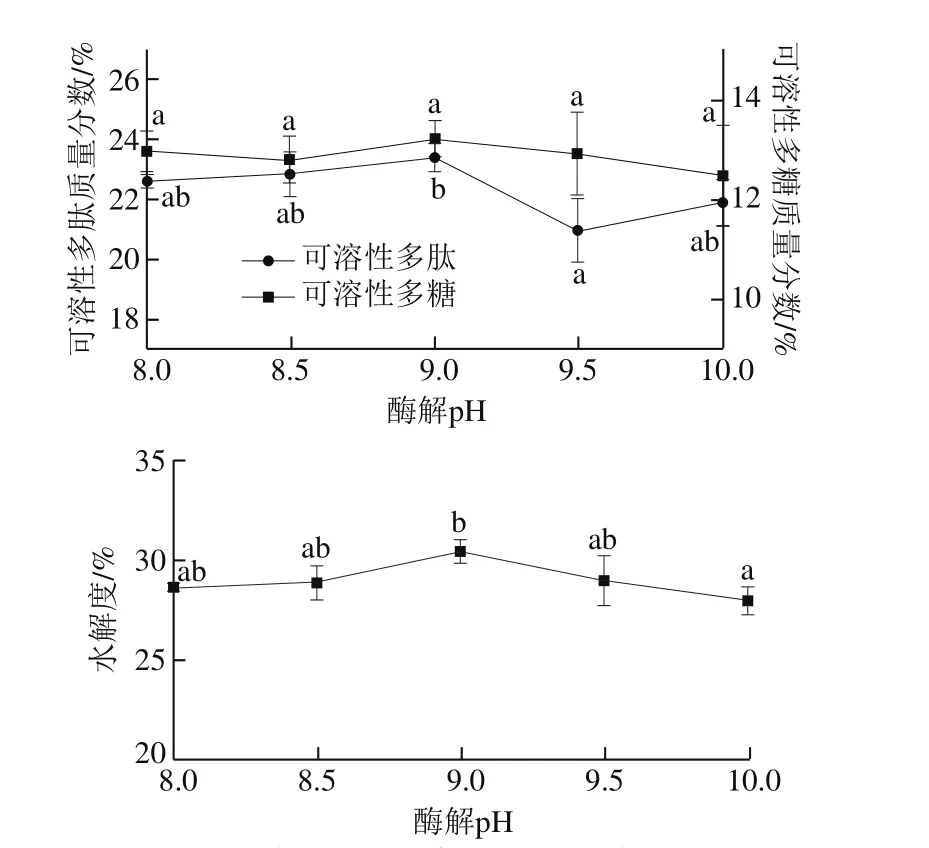
图8 酶解pH值对高温豆粕水解的影响Fig. 8 Effect of hydrolysis pH value on the extraction efficiency of soluble polysaccharide and polypeptide from soybean meal
pH值能影响酶活性部位上有关基团的解离,进而影响酶与底物蛋白的结合与催化,酶只有在其最适的pH值条件下,才能使酶反应速率达到最大[31]。由图8所示,碱性蛋白酶在较低pH值条件下,高温豆粕可溶性多肽质量分数随水解度的增大呈现增加趋势,当pH值为9.0时,水解度达到最大,此时的可溶性多肽质量分数最多,为(23.40±0.49)%,然而pH值继续升高,可溶性多肽含量显著下降(P<0.05)。因此,碱性蛋白酶的较适宜酶解pH值为9.0。
2.2.2.3 碱性蛋白酶酶解时间对高温豆粕的影响
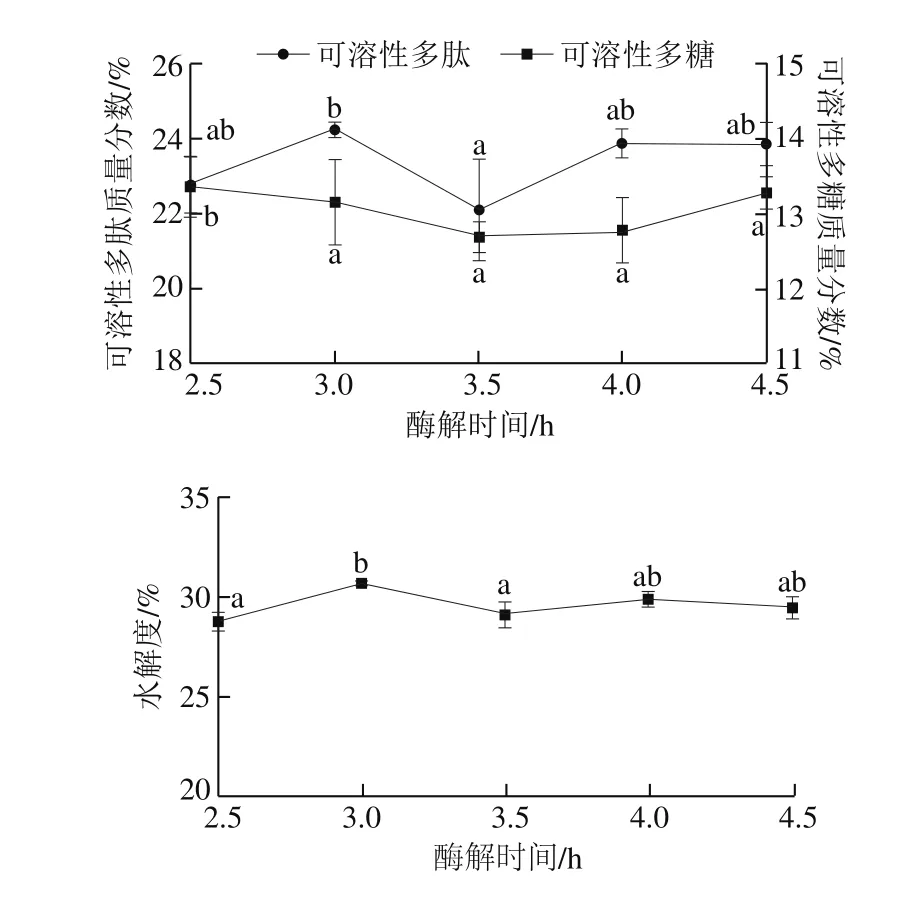
图9 酶解时间对高温豆粕水解的影响Fig. 9 Effect of hydrolysis time on the extraction efficiency of soluble polysaccharide and polypeptide from soybean meal
由图9可以看出,随着酶解时间延长,水解度和可溶性多肽含量增加,当酶解时间为3 h时,水解度最大,此时的可溶性多肽质量分数达到最大值(24.23±0.20)%,继续延长酶解时间,整体表现为多肽含量先降低后升高最后趋于平缓。故最佳酶解时间确定为3 h左右较为合适。
2.2.2.4 碱性蛋白酶酶解温度对高温豆粕的影响
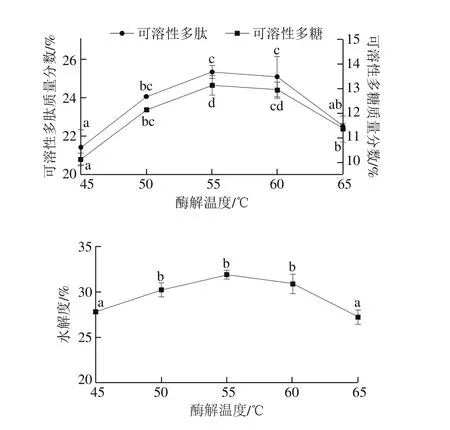
图10 酶解温度对高温豆粕水解的影响Fig. 10 Effect of hydrolysis temperature on the extraction efficiency of soluble polysaccharide and polypeptide from of soybean meal
从图10可以看出,酶解温度在55 ℃以内,随着酶解温度的不断升高,酶活性增加,同时酶解速度加快,水解度不断增加,使可溶性多肽质量分数不断增加。当酶解温度为55 ℃时,水解度效果最好,此时的可溶性多肽和可溶性多糖质量分数最高,分别为(25.33±0.33)%和(13.14±0.39)%。这是由于升高温度可以加速蛋白质分子运动,使蛋白质分子间、分子内的二硫键断裂,导致亚基结构伸展[30];但持续升高酶解温度,酶蛋白部分变性,使碱性蛋白酶钝化失活,降低酶的催化能力,并且温度过高,也会使蛋白分子发生折叠-聚合以至于聚合体增多[32],导致可溶性多肽和多糖含量下降。因此,最佳的酶解温度确定为55 ℃左右。
2.2.3 响应面试验结果
响应值为可溶性多肽含量,依据Box-Behnken设计因素水平编码值,测定结果见表5。
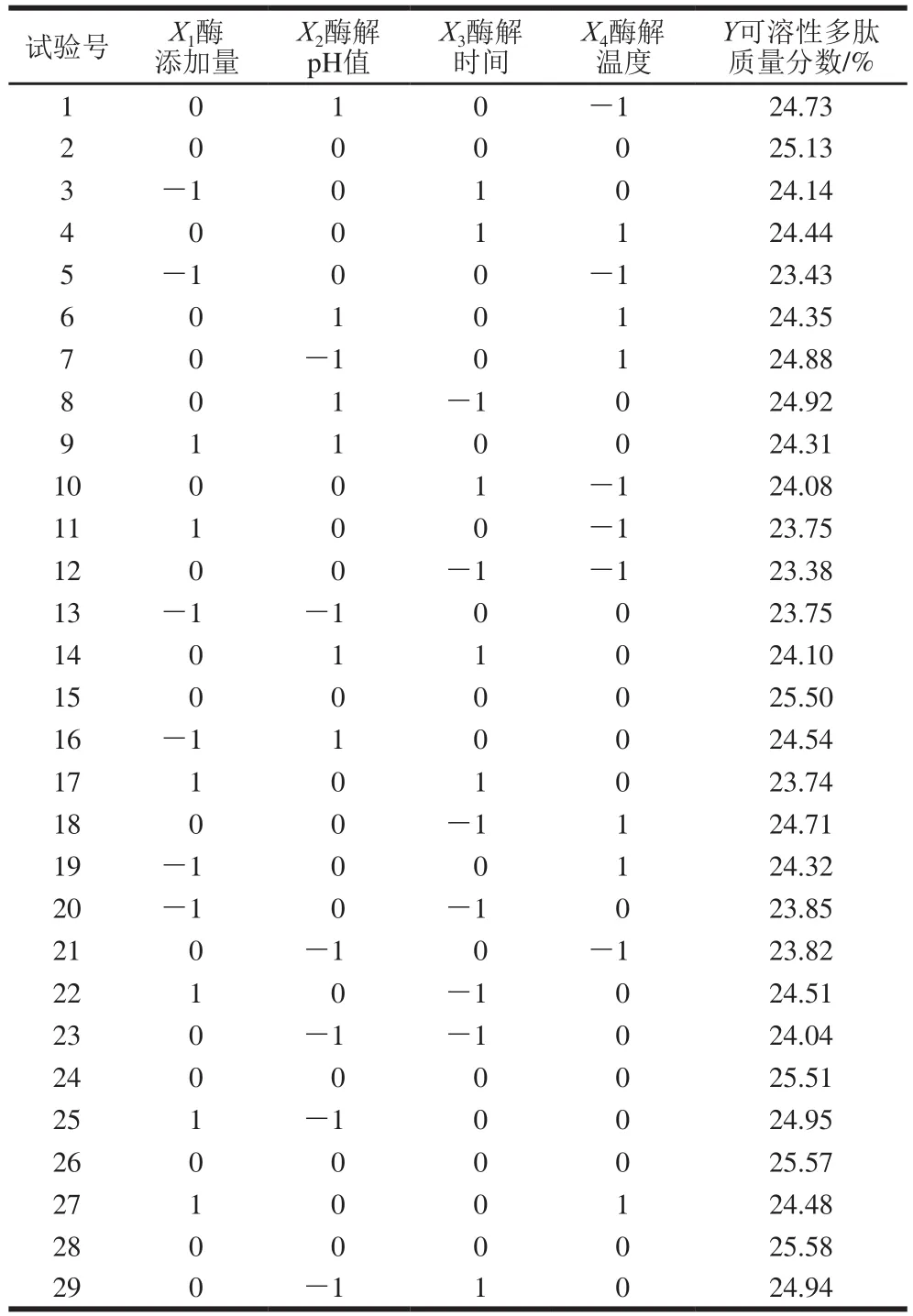
表5 碱性蛋白酶酶解工艺Box-Behnken试验设计方案及结果Table 5 Box-Behnken experimental design and results for optimization alkaline protease hydrolysis
采用Design-Expert 8.0软件进行回归拟合,可溶性多肽质量分数对蛋白酶添加量、酶解pH值、酶解时间和酶解温度的二次多项回归模型为Y=25.46+0.14X1+0.048X2+
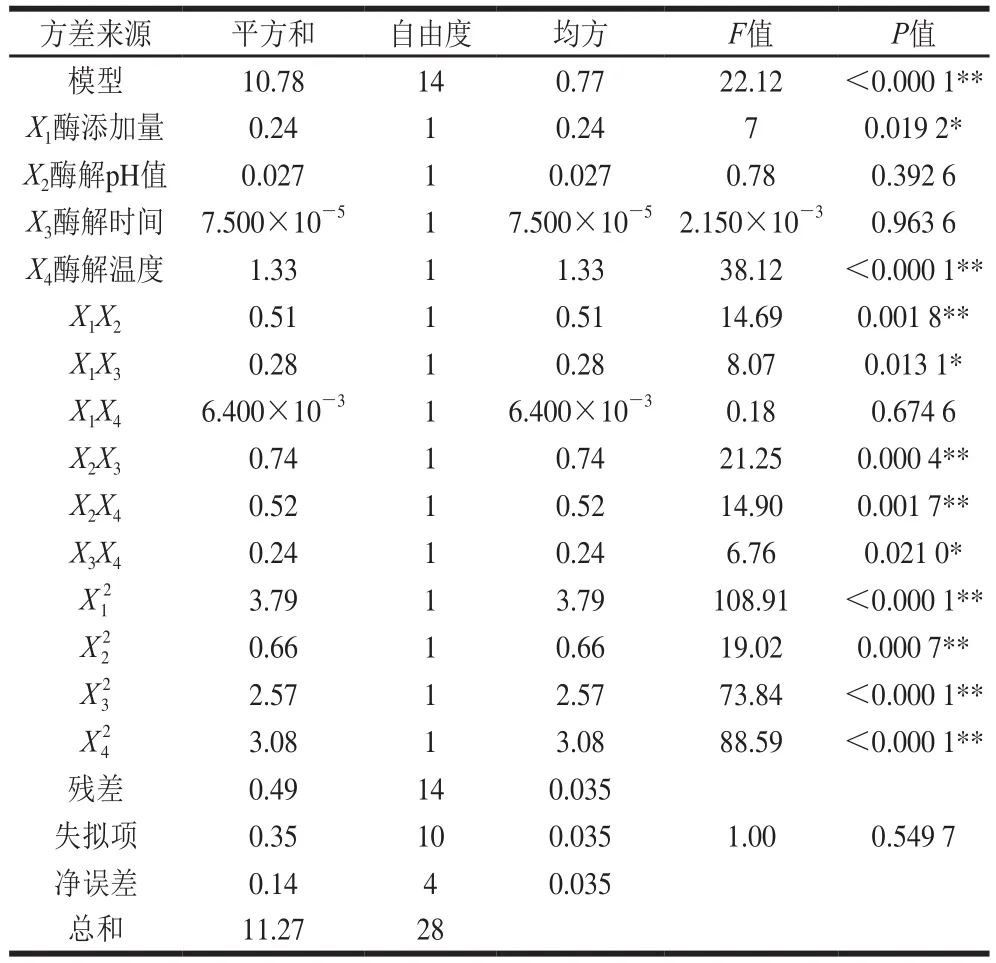
表6 碱性蛋白酶酶解工艺二次回归方程模型方差分析结果Table 6 Analysis of variance for the fi tted quadratic response surface regression model describing alkaline protease hydrolysis
如表6所示,模型的一次项X4、交互项X1X2、X2X3、X2X4和二次项X12、X22、X32、X42差异极显著;X1、X1X3、X3X4差异显著;X2、X3、X1X4差异不显著。模型为极显著(P<0.01),因变量与所考察的自变量之间线性关系显著(R2=0.954 8),调整确定系数R2Adj为0.913 5,该模型拟合程度良好,失拟项(P=0.549 7>0.05)差异不显著,说明所得的回归方程可行度高,可以用于预测蛋白酶酶解工艺。
按照回归方程优化出的工艺条件,蛋白酶添加量61 900 U、酶解pH 9、酶解时间3 h、酶解温度56.4 ℃,响应面模型指标值为25.51%。验证实验重复5 次,获得可溶性多肽质量分数为(25.47±0.81)%,实际值与预测值的误差绝对值小于5%,t检验差异不显著(P>0.05)。在最佳工艺条件下,计算得到高温豆粕的水解度为(33.51±0.42)%,说明运用响应面优化设计出的模型参数准确,可应用实际的酶解实验中,同时在最优条件下可溶性多糖质量分数为(13.22±0.49)%。
2.3 高温豆粕抗氧化产物的分离与纯化
2.3.1 离子交换层析结果
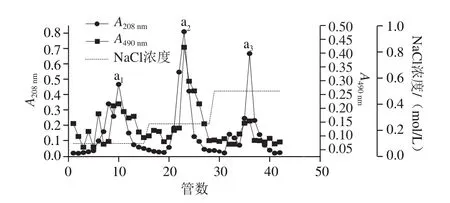
图11 DEAE-Cellulose 52离子交换层析Fig. 11 DEAE-Cellulose 52 anion-exchange chromatography
如图1 1所示,高温豆粕抗氧化产物粗品经DEAE Cellulose 52离子交换层析分离出3 种混合物,分别为抗氧化产物a1、a2和a3,其分别对应第10、23、36管,且每管收集到的量为10 mL。
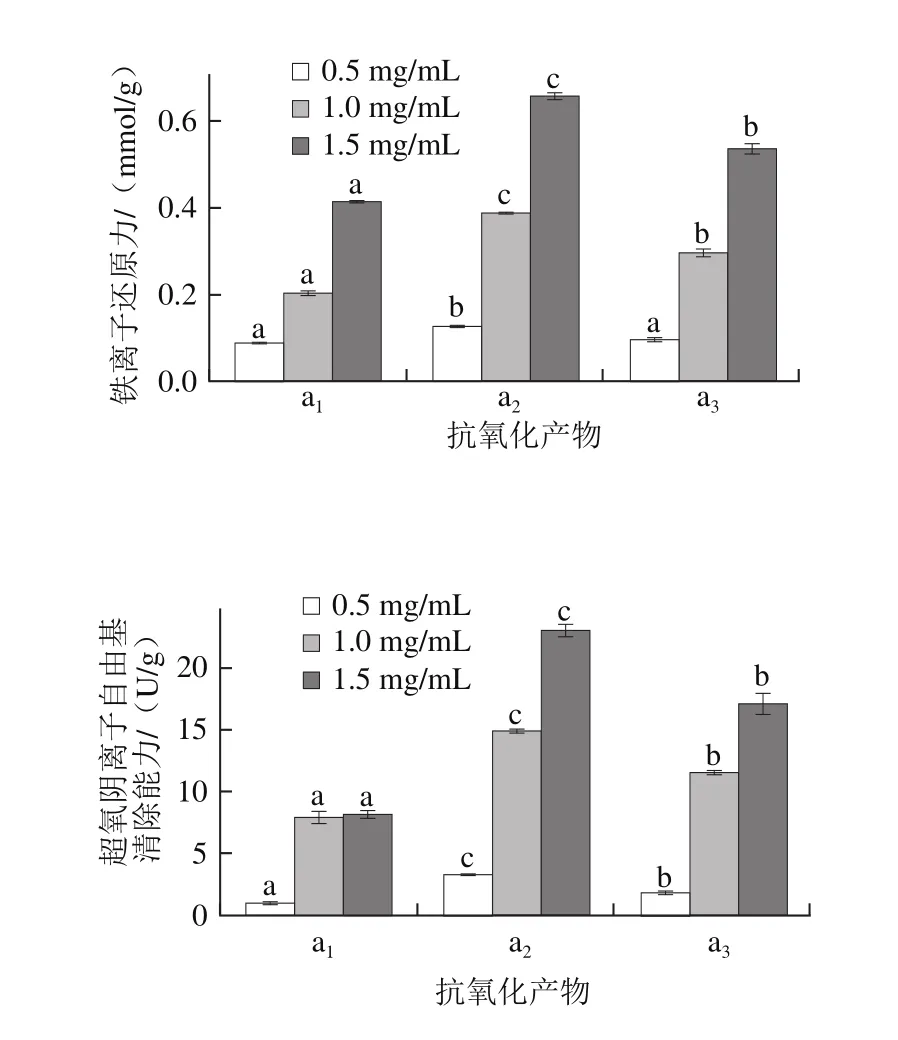
图12 高温豆粕抗氧化产物的抗氧化能力Fig. 12 Antioxidant activity of different antioxidant products from highly denatured soybean meal
如图12所示,3 种混合物的抗氧化效果存在显著差异。在相同浓度情况下,a2的铁离子还原力和超氧阴离子自由基清除能力,显著高于(P<0.05)同一水平的a1、a3,且随着a1、a2、a3产物浓度增加其抗氧化能力也增强。因此选择具有抗氧化能力较强的抗氧化产物a2进行下一步分离纯化。
2.3.2 凝胶色谱层析结果
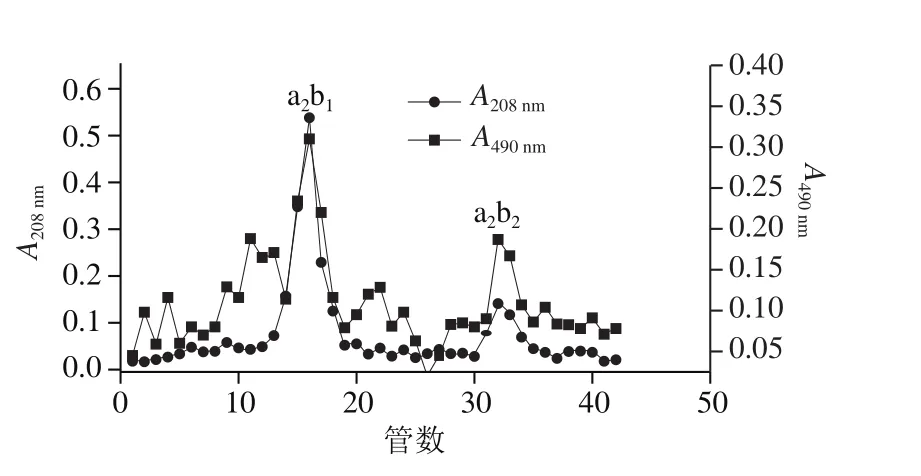
图13 Sephadex G-25凝胶色谱层析Fig. 13 Sephadex G-25 gel chromatography
如图13所示,抗氧化产物a2经Sephadex G-25柱层析分离后获得2 种产物,即抗氧化产物a2b1、a2b2,且2 种产物在波长208 nm和490 nm处均有吸收峰。
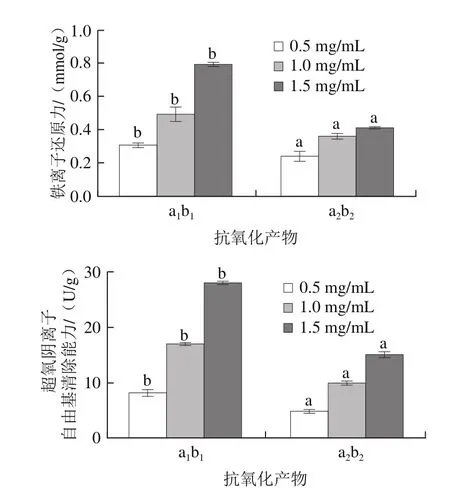
图14 高温豆粕抗氧化产物组分的抗氧化能力Fig. 14 Antioxidant activity of different antioxidant products from highly denatured soybean meal
如图14所示,在相同条件下,a2b1的铁离子还原力和超氧阴离子自由基清除能力显著高于(P<0.05)a2b2,因此a2b1为本研究所提取的高温豆粕抗氧化产物。经计算,其提取得率为2.18%,其中可溶性多肽质量分数为(61.28±0.83)%,可溶性多糖质量分数为(29.76±0.26)%,糖肽复合物质量分数为(8.96±0.55)%。
2.3.3 抗氧化能力测定结果

表7 高温豆粕抗氧化产物的抗氧化能力Table 7 Antioxidant capacity of the hydrolysate of highly denatured soybean meal
如表7所示,当底物质量浓度为1 mg/mL时,高温豆粕抗氧化产物与高温豆粕相比较,其铁离子还原力和超氧阴离子自由基清除能力显著提高(P<0.05)。这说明,高温豆粕经过超声、酶解以及分离纯化处理,其变性蛋白质被分解成多肽和短肽,使蛋白结构中具有抗氧化能力的基团(如巯基、咪唑基、酚羟基等)暴露出来;这些基团具有清除自由基,抑制氧化降解的作用,从而使高温豆粕表现出更强抗氧化活性[32]。
3 结 论
本实验采用超声波复合酶制剂处理高温豆粕,依次进行乙醇沉淀、DEAE-Cellulose52离子交换层析、SephadxeG-25凝胶色谱层析纯化,制备高温豆粕抗氧化产物,拓展了高温豆粕在食品领域的开发与利用。
超声波-纤维素酶处理高温豆粕工艺最优条件为超声功率300 W、超声时间20 min、底物质量浓度8.36 g/100 mL、纤维素酶添加量666 U/g、酶解pH 4.1,可溶性多肽质量分数为(18.51±0.36)%,可溶性多糖质量分数为(10.83±0.32)%。
碱性蛋白酶酶解工艺条件为蛋白酶添加量61 900 U、酶解pH 9、酶解时间3 h、酶解温度56.4 ℃,可溶性多肽质量分数为(25.47±0.81)%,可溶性多糖质量分数为(13.22±0.49)%。
高温豆粕抗氧化产物提取工艺:采用75%乙醇溶液沉淀粗品糖肽,透析、浓缩,利用DEAE-Cellulose52离子交换层析分离、纯化3 种产物,分别为抗氧化产物a1、a2和a3,并对3 种产物进行抗氧化活性的测定,选择具有抗氧化能力较强的抗氧化产物a2进一步分离纯化;采用Sephadex G-25凝胶色谱层析分离、纯化后获得筛选具有抗氧化产物a2b1和a2b2,进行抗氧化活性的测定,抗氧化产物a2b1为本研究所提取的具有抗氧化功能的水溶性高温豆粕抗氧化产物。经计算,其提取得率为2.18%,并且当其质量浓度为1 mg/mL时,其铁离子还原力和超氧阴离子自由基清除能力分别为(0.495±0.042)mmol/g和(17.02±0.22)U/g。
